7.1 第二课时 常见的酸 讲义 鲁教版九年级下册化学
文档属性
| 名称 | 7.1 第二课时 常见的酸 讲义 鲁教版九年级下册化学 |
|
|
| 格式 | docx | ||
| 文件大小 | 390.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-23 22:00:17 | ||
图片预览





文档简介
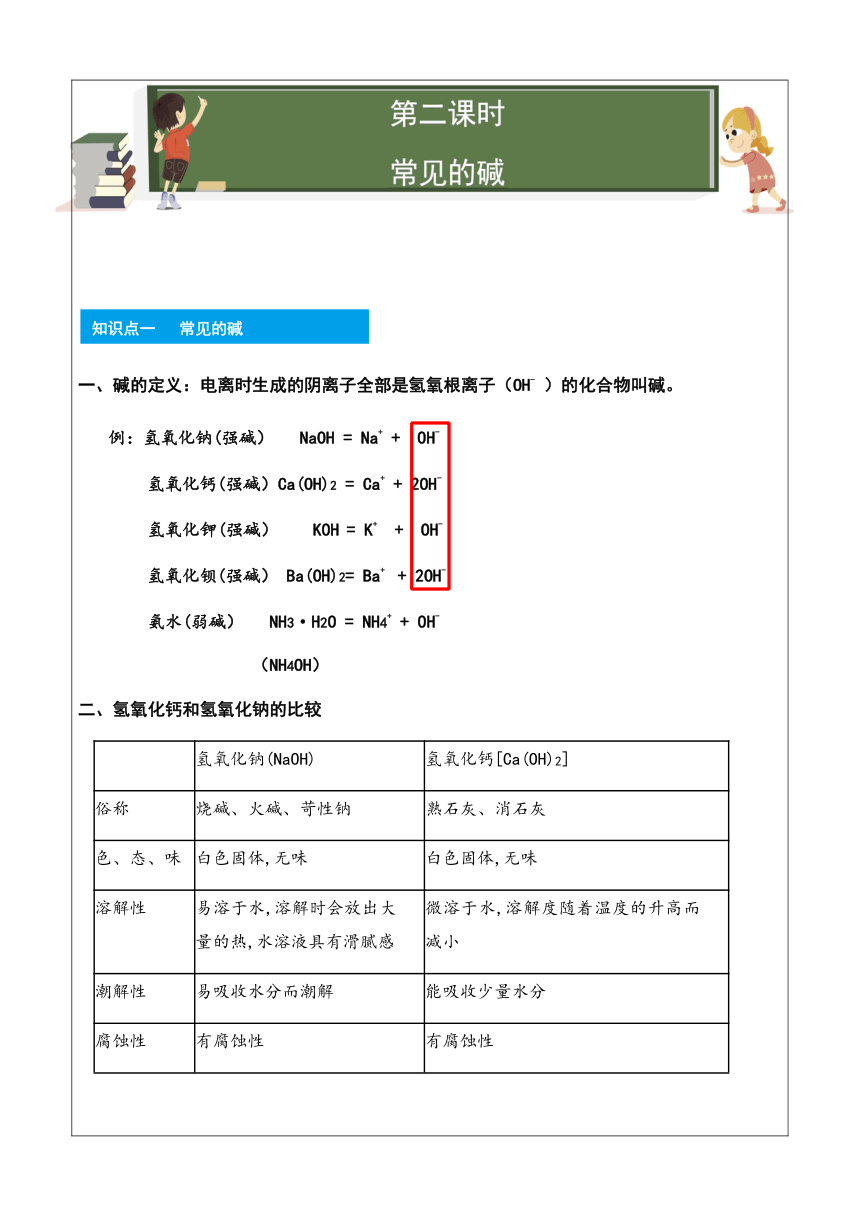
1106170011150600113411037465第二课时
常见的碱
第二课时
常见的碱
-311785-40640
2159058420知识点一 常见的碱
知识点一 常见的碱
一、碱的定义:电离时生成的阴离子全部是氢氧根离子(OH- )的化合物叫碱。
293370010160例:氢氧化钠(强碱) NaOH = Na+ + OH-
氢氧化钙(强碱)Ca(OH)2 = Ca+ + 2OH-
氢氧化钾(强碱) KOH = K+ + OH-
氢氧化钡(强碱) Ba(OH)2= Ba+ + 2OH-
氨水(弱碱) NH3·H2O = NH4+ + OH-
(NH4OH)
二、氢氧化钙和氢氧化钠的比较
氢氧化钠(NaOH)
氢氧化钙[Ca(OH)2]
俗称
烧碱、火碱、苛性钠
熟石灰、消石灰
色、态、味
白色固体,无味
白色固体,无味
溶解性
易溶于水,溶解时会放出大量的热,水溶液具有滑腻感
微溶于水,溶解度随着温度的升高而减小
潮解性
易吸收水分而潮解
能吸收少量水分
腐蚀性
有腐蚀性
有腐蚀性
[拓展延伸]
A、由于氢氧化钠易溶于水,同时吸收空气中的二氧化碳发生变质,所以氢氧化钠必须密封保存。
B、保存碱溶液的试剂瓶应用橡胶塞,不能用玻璃塞。
三、氢氧化钙制法:CaO+H2O=Ca(OH)2
405130635CaCO3 CaO +CO2↑
CaO + H2O = Ca(OH)2 现象:剧烈反应,放出大量的热;(CaO 可做干燥剂)
说明:CaCO3 ,石灰石,大理石的主要成分
Ca(OH)2,熟石灰,消石灰,澄清石灰水的主要溶质
CaO,生石灰,刷墙涂料的主要成分之一
-2603538100知识点二 碱的化学性质
知识点二 碱的化学性质
因为氢氧化钙和氢氧化钠在溶液中都能电离出氢氧离子(OH-),所以化学性质相似(碱的通性)。
1、碱与指示剂的作用
碱能使紫色的石蕊变成蓝色,使无色酚酞变红色,使红色石蕊试纸变成蓝色
2、碱+非金属氧化物——盐+水
①化学方程式
CO2+Ca(OH)2=CaCO3↓+H2O 检验二氧化碳 澄清石灰水变浑浊的原因;检验二氧化碳气体
CO2+2NaOH=Na2CO3+ H2O
SO2+2NaOH= Na2SO3+ H2O 工业除去二氧化硫
SO3+2NaOH= Na2SO4+ H2O
说明:非金属氧化物一般为酸性氧化物,如CO2,SO2等,可以和碱反应
2095568580练习
练习
下列物质露置在空气中一段时间后,因为发生化学变化而质量增加的是( )
A.浓硫酸 B.浓盐酸 C.氢氧化钠 D.石灰石
答案 C 浓硫酸吸水后质量增加,属于物理变化;浓盐酸具有挥发性,会导致质量减少;氢氧化钠吸收空气中的二氧化碳变成碳酸钠,质量增加,发生了化学变化。
3、碱+酸——盐+水
A、化学方程式
①Al(OH)3+3HCl =AlCl3+3H2O 治疗胃酸过多
②Mg(OH)2+H2SO4=MgSO4+2H2O
③Ca(OH)2+2HCl=CaCl2+2H2O
④Ca(OH)2+ H2SO4=CaSO4+2H2O
⑤NaOH+ HCl=NaCl+ H2O
用途:①治疗胃酸过多②中和酸性的土壤
4、碱+盐——另一种碱+另一种盐
Ca(OH)2+ Na2CO3= CaCO3↓+2NaOH 工业制氢氧化钠
Ca(OH)2+CuSO4=Cu(OH)2↓+ CaSO4现象:产生蓝色沉淀
2NaOH+ CuSO4= Cu(OH)2↓+Na2 SO4现象:产生蓝色沉淀
3NaOH+ FeCl3=Fe(OH)3↓+3NaCl现象:产生红褐色沉淀
3048019685例1
例1
3141980285750如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡。经过一段时间后,下列有关叙述正确的是( )
A.指针偏左,食盐溶液一定变稀,烧碱潮解
B.指针偏右,食盐溶液一定饱和,烧碱潮解
C.指针偏左,食盐溶液一定变浓,烧碱潮解
D.指针偏右,食盐溶液一定变浓,烧碱潮解
答案 D 由于氢氧化钠易潮解,能吸收食盐溶液中的水分,所以食盐溶液一定变浓,烧碱潮解,同时指针偏右,但食盐溶液不一定饱和。
1143015875例2
例2
已知氢氧化锂(LiOH)是碱性蓄电池电解质的添加剂,可增加电容量12%~15%,提高使用寿命2~3倍。其化学性质与氢氧化钠相似。下列对氢氧化锂的化学性质的说法中错误的是( D )
A.能与二氧化碳反应 B.能使无色酚酞溶液变红
C.能使紫色石蕊溶液变蓝 D.能与氧化铜反应
解析 本题主要考查碱的化学性质。氢氧化钠、氢氧化锂能与二氧化碳等非金属氧化物反应,A说法正确;氢氧化钠、氢氧化锂能使无色酚酞溶液变红,B说法正确;氢氧化钠、氢氧化锂能使紫色石蕊溶液变蓝,C说法正确;氧化铜是金属氧化物,能与酸发生反应,不能与氢氧化钠等碱反应,D说法不正确。答案 D
3683021590例3
例3
用石灰浆抹的墙壁上掉下了一块白色固体,为探究其成分,进行如下实验:
实验步骤
实验现象
①将固体磨成粉末状,加水搅拌
固体没有全部溶解
②取上层清液,滴加酚酞溶液
溶液呈红色
③取不溶物,滴加稀盐酸
有气泡产生
由此得出的结论正确的是( )
A.固体中一定含有Ca(OH)2,可能有CaCO3
B.固体中一定含有CaCO3和Ca(OH)2
C.固体中一定没有CaCO3和Ca(OH)2
D.固体中一定有CaCO3,可能有Ca(OH)2
3362325329565答案 B 取上层清液,滴加酚酞溶液,溶液呈红色,说明上层清液显碱性,证明固体中有Ca(OH)2。取不溶物,滴加稀盐酸,有气泡产生,证明固体中有CaCO3。
1778068580例4
例4
448945228600写出下列实验装置中出现的现象:
3105150248920
现象:
原因:
答案:鸡蛋背“吞”入集气瓶内 答案:气球变大
CO2与NaOH溶液反应,导致瓶内气压减小 CO2与NaOH溶液反应,导致瓶内气压减小
2095564770练习
练习
1.下列各组物质属于同一物质的是( )
A.苛性钠、火碱、金属钠 B.生石灰、消石灰、石灰石
C.消石灰、熟石灰、氢氧化钙 D.干冰、冰、二氧化碳
答案 C 苛性钠、火碱、烧碱都是氢氧化钠的俗称;氢氧化钙的俗称为熟石灰、消石灰,生石灰是氧化钙的俗称;干冰是固态二氧化碳,冰是固态水,所以只有C正确。
2.有关氢氧化钠的叙述中错误的是 ? ( )
A.能使紫色石蕊试液变蓝色 B.溶于水时放热
C.常用于造纸、纺织、印染、炼油等工业 D.能做治疗胃酸过多的药物
答案 D 氢氧化钠溶液显碱性,能使紫色石蕊试液变蓝色;氢氧化钠溶于水时会放出大量的热;氢氧化钠是一种重要的化工原料,常用于造纸、纺织、印染、炼油等工业;氢氧化钠具有强腐蚀性,不能做治疗胃酸过多的药物。
3.下列溶液中,能使酚酞试液变红的是( A )
A.氢氧化钠溶液 B.稀硫酸 C.稀盐酸 D.醋酸
4.下列物质中,属于碱的是( A )
A.KOH B.ZnO C.HNO3 D.MgSO4
5.化学课上,化学老师为同学们表演了小魔术,他将一张白纸展示给大家,然后用喷壶向纸上喷了一些无色液体,“化学真奇妙”的红色大字立刻显现于纸上。他所用的试剂可能是下列哪一组( A )
A.酚酞——石灰水溶液 B.酚酞——盐酸
C.石蕊——石灰水溶液 D.石蕊——盐酸
8324853498856.某同学为了区别氢氧化钠溶液和澄清石灰水,设计了下列四组实验方案,其中能达到目的的是? ( )
答案 D 二氧化碳能使澄清石灰水变浑浊,而与氢氧化钠反应无352425-952500现象。
7.氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是? ( )
A.都能与指示剂作用 B.都能解离出氢氧根离子
C.都能解离出金属阳离子 D.都含有氢元素和氧元素
答案 B 碱溶液中的阴离子都是氢氧根离子,所以碱溶液具有相似的化学性质。
8.研究NaOH性质实验中的部分实验及现象记录如下,其中现象不合理的是( C )
A.将NaOH固体放在表面皿上,放置一会儿——固体受潮,逐渐溶解
B.向NaOH溶液中滴入无色酚酞溶液——溶液变红
C.向NaOH溶液中滴加稀盐酸——有NaCl生成
D.向NaOH溶液中通入二氧化碳气体——无明显现象
27965403352809.如图所示,在一个盛有氢氧化钠溶液的容器中有一支燃烧的蜡烛,现用一个杯子将蜡烛罩住,猜想一下,发生的现象是( )
A.蜡烛继续燃烧,杯内液面不变
B.蜡烛逐渐熄灭,杯内液面下降
C.蜡烛燃烧更旺,杯内液面上升
D.蜡烛逐渐熄灭,杯内液面上升
答案 D 蜡烛燃烧消耗氧气,生成二氧化碳,因此氧气越来越少,故蜡烛逐渐熄灭;生成的二氧化碳与氢氧化钠溶液发生反应,导致杯内压强减小,故观察到杯内液面上升。
10.下列氧化物中,通常情况下既不与酸反应,又不与碱反应的是( )
A.CO2 B.CO C.CaO D.CuO
答案 B CO2可以与碱反应,CaO和CuO可以与酸反应。
-698534925知识点三 溶液的导电性
知识点三 溶液的导电性
1.用如图所示的装置试验一些物质的导电性,可以看到蒸馏水、乙醇不导电,而盐酸、硫酸、氢氧化钠溶液、氢氧化钙溶液可以导电。
40830580010
图1 图2
溶液能够导电的原因是溶液中存在自由移动的离子。酸、碱溶于水, 在水分子作用下,解离出自由移动的带(正或负)电的(阳或阴)离子(如图所示),因此酸、碱的水溶液都能导电,而蒸馏水和乙醇中不存在自由移动的离子。
8075930164465?
?
酸具有相似的化学性质是因为在不同的酸溶液中都含有H+,如
2359025177165311150177165HCl2157730154940?
?
H++Cl-、 H2 SO4 2H++S?O42 。
567055578485?
?
3195320578485?
?
4.碱具有相似的化学性质是因为在不同的碱溶液中都含有OH-,
3035300250825854075250825如NaOH Na++OH-、 Ca(OH)2 Ca2++2OH-。
190562865练习
练习
1.图所示装置中灯泡发光,瓶内盛放的物质可能是? ( )
250317040640A.烧碱固体
B.蔗糖水
C.食盐固体
D.硫酸钠溶液
答案 D 烧碱固体和食盐固体中虽然都含有离子,但是在固体中这些离子都不能自由移动,所以烧碱固体和食盐固体不能导电;蔗糖水中含蔗糖分子和水分子,所以不导电;硫酸钠溶液中含有自由移动的离子,能导 电。
15455901200152.看图回答问题:
(1)图A中的H2SO4换成HCl,则能得到的离子是 和 。HCl和H2SO4的溶液都含有相同的 ,所以都具有相似的化学性质。
(2)氢氧化钠和氢氧化钙具有相似的性质,试从图C分析原因 ,举一例说明两者性质的相似性 。
答案 (1)H+ Cl- H+ (2)溶液中含有OH- 都能使无色的酚酞溶液变红(或其他合理答案)
-1651052705知识点四 干燥剂(重点)、干燥器的选择(了解)(除去气体中的H2O)
知识点四 干燥剂(重点)、干燥器的选择(了解)(除去气体中的H2O)
干燥剂
可干燥的气体
不能干燥的气体
碱性
生石灰、固体NaOH、碱石灰
碱性气体:NH3等;中性气体:H2、O2、CO、CH4、N2等
酸性气体:H2S、 HCl、CO2、SO2等
酸性
浓H2SO4
酸性气体:CO2、HCl等; 中性气体:H2、O2、 CO、CH4等
碱性气体:NH3等;还原性气体:H2S等(浓H2SO4具有强氧化性)
中性
无水CaCl2
略
绝大多数气体
NH3(无水CaCl2与NH3反应生成CaCl2·8NH3)
2.干燥器(如图所示)的选择:根据干燥剂的状态选择,液态干燥剂(浓H2SO4)用洗气瓶,气流要长进短出;固态干燥剂用U形管或干燥管,用干燥管时,气流要大进小出。
93218033020
458025517145
【练习】
1.下列几种气体可用如图所示装置干 燥、收集的正确组合是( )
①H2 ②O2 ③CO2 ④SO2 ⑤CH4 ⑥NH3
A.①②③ B.②③⑤ C.③④⑥ D.①⑤⑥
答案 D H2、O2、CH4、NH3均不与NaOH或CaO反应,故可用碱石灰干燥,但该收集装置只能用于收集密度比空气小的气体,故应排除O2。
12065115570重点题型 酸碱指示剂的作用
重点题型 酸碱指示剂的作用
1.某溶液中滴入无色酚酞试液后不变色,向该溶液中滴入紫色石蕊试液,则?(B )
A.一定显红色 B.可能仍为紫色,也可能显红色
C.可能显蓝色 D.一定显蓝色
2.同学们在实验室用自制的紫色紫薯汁滴加到一些化学试剂中,观察到下表实验现象,若将紫色紫薯汁滴加到氢氧化钠溶液中,溶液将显示( C )
溶液
白醋
盐酸
蔗糖水
草木灰水
石灰水
加入紫薯汁后的颜色
红色
红色
紫色
绿色
绿色
A.无色 B.红色 C.绿色 D.紫色
答案 C 氢氧化钠溶液、草木灰水、石灰水均显碱性,根据表中信息可知,加入紫薯汁后都变为绿色。
3.用酒精和水浸泡蝴蝶兰花可得到紫色溶液,该溶液遇酸溶液显红色,遇碱溶液显黄色。下列说法正确的是? ( )
A.蝴蝶兰花的溶液与酸作用显红色是物理变化
B.能使蝴蝶兰花的溶液显黄色的一定是碱
C.将食盐溶液滴入蝴蝶兰花的溶液中后,溶液仍为紫色
D.蝴蝶兰花的溶液不可用作酸碱指示剂
答案 C 蝴蝶兰花的溶液遇酸显红色是与酸发生了化学反应生成了新物质,属于化学变化;使蝴蝶兰花的溶液显黄色的溶液显碱性,但不一定是碱溶液;食盐溶液呈中性,所以滴入蝴蝶兰花的溶液中后,溶液仍为紫色; 蝴蝶兰花的溶液遇酸、碱能显示不同的颜色,可用作酸碱指示剂。
4.取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁。各取少许花汁,用稀酸和稀碱进行检验,结果如下表所示:
花的种类
花汁在酒精中的颜色
花汁在酸溶液中的颜色
花汁在碱溶液中的颜色
大红花
粉红色
橙色
绿色
万寿菊
黄色
黄色
黄色
雏菊
无色
无色
黄色
A.研磨花瓣时加入酒精是为了溶解其中的色素
B.在氢氧化钠的溶液中大红花汁会变成橙色
C.万寿菊花汁不能用作酸碱指示剂
D.可用雏菊花汁来区别稀盐酸和氢氧化钠溶液
2073910854710常见的酸碱课后练习
常见的酸碱课后练习
答案 B 色素能用酒精溶解,故A正确;氢氧化钠溶液呈碱性,由表中信息可知碱性溶液中大红花汁会呈现绿色,故B错误;万寿菊花汁在不同的溶液中颜色相同,不可以作指示剂,故C正确;稀盐酸与氢氧化钠溶液分别呈酸性、碱性,雏菊花汁可以区分它们,故D正确。
1.下列物质敞口放置于空气中,一段时间后质量减少的是( C )
A.氧化钙 B.浓硫酸 C.浓盐酸 D.氢氧化钠
2.下列各组物质若曝露在空气中,前者质量增加而不变质,后者变质且质量增加的是( )
A.浓盐酸、熟石灰 B.熟石灰、石灰石
C.浓硫酸、氯化钠 D.浓硫酸、苛性钠
答案 D 浓硫酸有吸水性,能吸收空气中的水分而使质量增加,但不变质;苛性钠是氢氧化钠的俗称,氢氧化钠与空气中的二氧化碳反应而变质,使质量增加。
3.下列有关氢氧化钠性质的说法错误的是( )
A.氢氧化钠有腐蚀性 B.固体氢氧化钠有挥发性
C.氢氧化钠不能用来干燥二氧化碳气体 D.固体氢氧化钠能吸收水蒸气而潮解
答案 B 氢氧化钠有强烈的腐蚀性,A正确;氢氧化钠能吸收空气中的水蒸气而潮解,不具有挥发性,D正确,B不正确;氢氧化钠能与二氧化碳反应,不能用来干燥二氧化碳气体,C正确。
4.下列叙述正确的是( )
A
液态氧、矿泉水、医用酒精均为纯净物
B
NaHCO3、H2SO4、HNO3均为酸
C
NH3?H2O、NaOH、KOH均为碱
D
CO2、Al2O3、KMnO4均为氧化物
解答:
解:A、矿泉水、医用酒精都属于混合物,错误;
B、NaHCO3电离产生了阳离子钠离子,属于盐,错误;
C、NH3?H2O、NaOH、KOH均为碱,正确;
D、KMnO4中含有三种元素,不属于氧化物,错误;
5.下列溶液中,能使酚酞试液变红的是( )
A.氢氧化钠溶液 B.稀硫酸 C.稀盐酸 D.醋酸
答案 A 碱性溶液能使酚酞试液变红,稀硫酸、稀盐酸与醋酸都呈酸性,不能使酚酞试液变色。
6.化学课上,化学老师为同学们表演了小魔术,他将一张白纸展示给大家,然后用喷壶向纸上喷了一些无色液体,“化学真奇妙”的红色大字立刻显现于纸上。他所用的试剂可能是下列哪一组( )
A.酚酞——石灰水溶液 B.酚酞——盐酸
C.石蕊——石灰水溶液 D.石蕊——盐酸
答案 A 石蕊试液呈紫色,酚酞试液呈无色,所以白纸上可能事先喷有酚酞,石灰水能使酚酞变红,向纸上喷的液体可能是石灰水。
7.氢氧化铯是一种可溶性碱,其化学式为CsOH,是制取各种铯盐的原料,也常用于玻璃、陶瓷工业。下列叙述不正确的是( )
A.CsOH溶液能使紫色石蕊试液变蓝 B.CsOH溶液不能使无色酚酞试液变色
C.CsOH溶液中含有OH- D.CsOH与CO2反应生成Cs2CO3和H2O
答案 B 碱溶液能使紫色石蕊试液变蓝,使无色酚酞试液变红,A正确、B不正确;可溶性碱溶于水后能解离出OH-,C正确;结合NaOH与CO2反应的产物可以判断D正确。
8.食醋中含有醋酸,食醋除作调味剂外,生活中还有妙用,下列使用食醋肯定不能达到目的是( )
A.除去水壶壁上的水垢 B.减弱皮蛋的涩性
C.除去菜刀上的铁锈 D.鉴别黄金饰品中是否含有铜
【分析】根据酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应),据此进行分析解答.
解:A、水垢的主要成分是碳酸钙,能与醋酸反应,使用食醋能达到目的,故选项错误.
B、皮蛋的涩性是因为制作过程中产生了氢氧化钠,氢氧化钠能与醋酸发生中和反应,能减弱皮蛋的涩性,使用食醋能达到目的,故选项错误.
C、铁锈的主要成分是氧化铁,能与醋酸反应,使用食醋能达到目的,故选项错误.
D、铜的金属活动性比氢弱,不能与醋酸反应,使用食醋不能达到目的,故选项正确.
9.探究小组利用如图所示装置进行四组实验,胶头滴管中盛装的是液体,烧瓶中盛装的是气体、固体或液体,当胶头滴管滴几滴液体后,能观察到气球变大的实验组合是( )
组合
滴管中
烧瓶中
A
H2SO4(稀)
NaOH(固)
B
稀盐酸
Zn(固)
C
NaOH溶液
CO2(气)
D
H2SO4(浓)
H2O(液)
4467225-19050
答案 C 要使气球变大,必须使烧瓶内气压减小。NaOH能与二氧化碳气体反应,使烧瓶内压强减小。
10.某同学将一朵紫色牵牛花泡在石灰水里,牵牛花很快就变成了蓝色,又将牵牛花泡在稀盐酸中,牵牛花又变成了红色,请你根据以上实验现象回答:
(1)该同学将紫色牵牛花泡在肥皂水中很快就变成了蓝色,肥皂水显 (填“酸性”或“碱性”)。
(2)该牵牛花的汁液 (填“能”或“不能”)用作指示剂。
(3)将牵牛花泡在家庭厨房里的某种调味品中,牵牛花变成了红色,选用的调味品可能是 。
答案 (1)碱性 (2)能 (3)白醋 解析 紫色牵牛花泡在石灰水里,牵牛花很快就变成了蓝色,而将紫色牵牛花泡在肥皂水中很快变成了蓝色,说明肥皂水显碱性;牵牛花在酸性、碱性溶液中能呈现不同的颜色,所以牵牛花汁液能用作指示剂;将牵牛花泡在家庭厨房里的某种调味品中,牵牛花变成了红色,说明该溶液呈酸性, 可能是白醋。
常见的碱
第二课时
常见的碱
-311785-40640
2159058420知识点一 常见的碱
知识点一 常见的碱
一、碱的定义:电离时生成的阴离子全部是氢氧根离子(OH- )的化合物叫碱。
293370010160例:氢氧化钠(强碱) NaOH = Na+ + OH-
氢氧化钙(强碱)Ca(OH)2 = Ca+ + 2OH-
氢氧化钾(强碱) KOH = K+ + OH-
氢氧化钡(强碱) Ba(OH)2= Ba+ + 2OH-
氨水(弱碱) NH3·H2O = NH4+ + OH-
(NH4OH)
二、氢氧化钙和氢氧化钠的比较
氢氧化钠(NaOH)
氢氧化钙[Ca(OH)2]
俗称
烧碱、火碱、苛性钠
熟石灰、消石灰
色、态、味
白色固体,无味
白色固体,无味
溶解性
易溶于水,溶解时会放出大量的热,水溶液具有滑腻感
微溶于水,溶解度随着温度的升高而减小
潮解性
易吸收水分而潮解
能吸收少量水分
腐蚀性
有腐蚀性
有腐蚀性
[拓展延伸]
A、由于氢氧化钠易溶于水,同时吸收空气中的二氧化碳发生变质,所以氢氧化钠必须密封保存。
B、保存碱溶液的试剂瓶应用橡胶塞,不能用玻璃塞。
三、氢氧化钙制法:CaO+H2O=Ca(OH)2
405130635CaCO3 CaO +CO2↑
CaO + H2O = Ca(OH)2 现象:剧烈反应,放出大量的热;(CaO 可做干燥剂)
说明:CaCO3 ,石灰石,大理石的主要成分
Ca(OH)2,熟石灰,消石灰,澄清石灰水的主要溶质
CaO,生石灰,刷墙涂料的主要成分之一
-2603538100知识点二 碱的化学性质
知识点二 碱的化学性质
因为氢氧化钙和氢氧化钠在溶液中都能电离出氢氧离子(OH-),所以化学性质相似(碱的通性)。
1、碱与指示剂的作用
碱能使紫色的石蕊变成蓝色,使无色酚酞变红色,使红色石蕊试纸变成蓝色
2、碱+非金属氧化物——盐+水
①化学方程式
CO2+Ca(OH)2=CaCO3↓+H2O 检验二氧化碳 澄清石灰水变浑浊的原因;检验二氧化碳气体
CO2+2NaOH=Na2CO3+ H2O
SO2+2NaOH= Na2SO3+ H2O 工业除去二氧化硫
SO3+2NaOH= Na2SO4+ H2O
说明:非金属氧化物一般为酸性氧化物,如CO2,SO2等,可以和碱反应
2095568580练习
练习
下列物质露置在空气中一段时间后,因为发生化学变化而质量增加的是( )
A.浓硫酸 B.浓盐酸 C.氢氧化钠 D.石灰石
答案 C 浓硫酸吸水后质量增加,属于物理变化;浓盐酸具有挥发性,会导致质量减少;氢氧化钠吸收空气中的二氧化碳变成碳酸钠,质量增加,发生了化学变化。
3、碱+酸——盐+水
A、化学方程式
①Al(OH)3+3HCl =AlCl3+3H2O 治疗胃酸过多
②Mg(OH)2+H2SO4=MgSO4+2H2O
③Ca(OH)2+2HCl=CaCl2+2H2O
④Ca(OH)2+ H2SO4=CaSO4+2H2O
⑤NaOH+ HCl=NaCl+ H2O
用途:①治疗胃酸过多②中和酸性的土壤
4、碱+盐——另一种碱+另一种盐
Ca(OH)2+ Na2CO3= CaCO3↓+2NaOH 工业制氢氧化钠
Ca(OH)2+CuSO4=Cu(OH)2↓+ CaSO4现象:产生蓝色沉淀
2NaOH+ CuSO4= Cu(OH)2↓+Na2 SO4现象:产生蓝色沉淀
3NaOH+ FeCl3=Fe(OH)3↓+3NaCl现象:产生红褐色沉淀
3048019685例1
例1
3141980285750如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡。经过一段时间后,下列有关叙述正确的是( )
A.指针偏左,食盐溶液一定变稀,烧碱潮解
B.指针偏右,食盐溶液一定饱和,烧碱潮解
C.指针偏左,食盐溶液一定变浓,烧碱潮解
D.指针偏右,食盐溶液一定变浓,烧碱潮解
答案 D 由于氢氧化钠易潮解,能吸收食盐溶液中的水分,所以食盐溶液一定变浓,烧碱潮解,同时指针偏右,但食盐溶液不一定饱和。
1143015875例2
例2
已知氢氧化锂(LiOH)是碱性蓄电池电解质的添加剂,可增加电容量12%~15%,提高使用寿命2~3倍。其化学性质与氢氧化钠相似。下列对氢氧化锂的化学性质的说法中错误的是( D )
A.能与二氧化碳反应 B.能使无色酚酞溶液变红
C.能使紫色石蕊溶液变蓝 D.能与氧化铜反应
解析 本题主要考查碱的化学性质。氢氧化钠、氢氧化锂能与二氧化碳等非金属氧化物反应,A说法正确;氢氧化钠、氢氧化锂能使无色酚酞溶液变红,B说法正确;氢氧化钠、氢氧化锂能使紫色石蕊溶液变蓝,C说法正确;氧化铜是金属氧化物,能与酸发生反应,不能与氢氧化钠等碱反应,D说法不正确。答案 D
3683021590例3
例3
用石灰浆抹的墙壁上掉下了一块白色固体,为探究其成分,进行如下实验:
实验步骤
实验现象
①将固体磨成粉末状,加水搅拌
固体没有全部溶解
②取上层清液,滴加酚酞溶液
溶液呈红色
③取不溶物,滴加稀盐酸
有气泡产生
由此得出的结论正确的是( )
A.固体中一定含有Ca(OH)2,可能有CaCO3
B.固体中一定含有CaCO3和Ca(OH)2
C.固体中一定没有CaCO3和Ca(OH)2
D.固体中一定有CaCO3,可能有Ca(OH)2
3362325329565答案 B 取上层清液,滴加酚酞溶液,溶液呈红色,说明上层清液显碱性,证明固体中有Ca(OH)2。取不溶物,滴加稀盐酸,有气泡产生,证明固体中有CaCO3。
1778068580例4
例4
448945228600写出下列实验装置中出现的现象:
3105150248920
现象:
原因:
答案:鸡蛋背“吞”入集气瓶内 答案:气球变大
CO2与NaOH溶液反应,导致瓶内气压减小 CO2与NaOH溶液反应,导致瓶内气压减小
2095564770练习
练习
1.下列各组物质属于同一物质的是( )
A.苛性钠、火碱、金属钠 B.生石灰、消石灰、石灰石
C.消石灰、熟石灰、氢氧化钙 D.干冰、冰、二氧化碳
答案 C 苛性钠、火碱、烧碱都是氢氧化钠的俗称;氢氧化钙的俗称为熟石灰、消石灰,生石灰是氧化钙的俗称;干冰是固态二氧化碳,冰是固态水,所以只有C正确。
2.有关氢氧化钠的叙述中错误的是 ? ( )
A.能使紫色石蕊试液变蓝色 B.溶于水时放热
C.常用于造纸、纺织、印染、炼油等工业 D.能做治疗胃酸过多的药物
答案 D 氢氧化钠溶液显碱性,能使紫色石蕊试液变蓝色;氢氧化钠溶于水时会放出大量的热;氢氧化钠是一种重要的化工原料,常用于造纸、纺织、印染、炼油等工业;氢氧化钠具有强腐蚀性,不能做治疗胃酸过多的药物。
3.下列溶液中,能使酚酞试液变红的是( A )
A.氢氧化钠溶液 B.稀硫酸 C.稀盐酸 D.醋酸
4.下列物质中,属于碱的是( A )
A.KOH B.ZnO C.HNO3 D.MgSO4
5.化学课上,化学老师为同学们表演了小魔术,他将一张白纸展示给大家,然后用喷壶向纸上喷了一些无色液体,“化学真奇妙”的红色大字立刻显现于纸上。他所用的试剂可能是下列哪一组( A )
A.酚酞——石灰水溶液 B.酚酞——盐酸
C.石蕊——石灰水溶液 D.石蕊——盐酸
8324853498856.某同学为了区别氢氧化钠溶液和澄清石灰水,设计了下列四组实验方案,其中能达到目的的是? ( )
答案 D 二氧化碳能使澄清石灰水变浑浊,而与氢氧化钠反应无352425-952500现象。
7.氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是? ( )
A.都能与指示剂作用 B.都能解离出氢氧根离子
C.都能解离出金属阳离子 D.都含有氢元素和氧元素
答案 B 碱溶液中的阴离子都是氢氧根离子,所以碱溶液具有相似的化学性质。
8.研究NaOH性质实验中的部分实验及现象记录如下,其中现象不合理的是( C )
A.将NaOH固体放在表面皿上,放置一会儿——固体受潮,逐渐溶解
B.向NaOH溶液中滴入无色酚酞溶液——溶液变红
C.向NaOH溶液中滴加稀盐酸——有NaCl生成
D.向NaOH溶液中通入二氧化碳气体——无明显现象
27965403352809.如图所示,在一个盛有氢氧化钠溶液的容器中有一支燃烧的蜡烛,现用一个杯子将蜡烛罩住,猜想一下,发生的现象是( )
A.蜡烛继续燃烧,杯内液面不变
B.蜡烛逐渐熄灭,杯内液面下降
C.蜡烛燃烧更旺,杯内液面上升
D.蜡烛逐渐熄灭,杯内液面上升
答案 D 蜡烛燃烧消耗氧气,生成二氧化碳,因此氧气越来越少,故蜡烛逐渐熄灭;生成的二氧化碳与氢氧化钠溶液发生反应,导致杯内压强减小,故观察到杯内液面上升。
10.下列氧化物中,通常情况下既不与酸反应,又不与碱反应的是( )
A.CO2 B.CO C.CaO D.CuO
答案 B CO2可以与碱反应,CaO和CuO可以与酸反应。
-698534925知识点三 溶液的导电性
知识点三 溶液的导电性
1.用如图所示的装置试验一些物质的导电性,可以看到蒸馏水、乙醇不导电,而盐酸、硫酸、氢氧化钠溶液、氢氧化钙溶液可以导电。
40830580010
图1 图2
溶液能够导电的原因是溶液中存在自由移动的离子。酸、碱溶于水, 在水分子作用下,解离出自由移动的带(正或负)电的(阳或阴)离子(如图所示),因此酸、碱的水溶液都能导电,而蒸馏水和乙醇中不存在自由移动的离子。
8075930164465?
?
酸具有相似的化学性质是因为在不同的酸溶液中都含有H+,如
2359025177165311150177165HCl2157730154940?
?
H++Cl-、 H2 SO4 2H++S?O42 。
567055578485?
?
3195320578485?
?
4.碱具有相似的化学性质是因为在不同的碱溶液中都含有OH-,
3035300250825854075250825如NaOH Na++OH-、 Ca(OH)2 Ca2++2OH-。
190562865练习
练习
1.图所示装置中灯泡发光,瓶内盛放的物质可能是? ( )
250317040640A.烧碱固体
B.蔗糖水
C.食盐固体
D.硫酸钠溶液
答案 D 烧碱固体和食盐固体中虽然都含有离子,但是在固体中这些离子都不能自由移动,所以烧碱固体和食盐固体不能导电;蔗糖水中含蔗糖分子和水分子,所以不导电;硫酸钠溶液中含有自由移动的离子,能导 电。
15455901200152.看图回答问题:
(1)图A中的H2SO4换成HCl,则能得到的离子是 和 。HCl和H2SO4的溶液都含有相同的 ,所以都具有相似的化学性质。
(2)氢氧化钠和氢氧化钙具有相似的性质,试从图C分析原因 ,举一例说明两者性质的相似性 。
答案 (1)H+ Cl- H+ (2)溶液中含有OH- 都能使无色的酚酞溶液变红(或其他合理答案)
-1651052705知识点四 干燥剂(重点)、干燥器的选择(了解)(除去气体中的H2O)
知识点四 干燥剂(重点)、干燥器的选择(了解)(除去气体中的H2O)
干燥剂
可干燥的气体
不能干燥的气体
碱性
生石灰、固体NaOH、碱石灰
碱性气体:NH3等;中性气体:H2、O2、CO、CH4、N2等
酸性气体:H2S、 HCl、CO2、SO2等
酸性
浓H2SO4
酸性气体:CO2、HCl等; 中性气体:H2、O2、 CO、CH4等
碱性气体:NH3等;还原性气体:H2S等(浓H2SO4具有强氧化性)
中性
无水CaCl2
略
绝大多数气体
NH3(无水CaCl2与NH3反应生成CaCl2·8NH3)
2.干燥器(如图所示)的选择:根据干燥剂的状态选择,液态干燥剂(浓H2SO4)用洗气瓶,气流要长进短出;固态干燥剂用U形管或干燥管,用干燥管时,气流要大进小出。
93218033020
458025517145
【练习】
1.下列几种气体可用如图所示装置干 燥、收集的正确组合是( )
①H2 ②O2 ③CO2 ④SO2 ⑤CH4 ⑥NH3
A.①②③ B.②③⑤ C.③④⑥ D.①⑤⑥
答案 D H2、O2、CH4、NH3均不与NaOH或CaO反应,故可用碱石灰干燥,但该收集装置只能用于收集密度比空气小的气体,故应排除O2。
12065115570重点题型 酸碱指示剂的作用
重点题型 酸碱指示剂的作用
1.某溶液中滴入无色酚酞试液后不变色,向该溶液中滴入紫色石蕊试液,则?(B )
A.一定显红色 B.可能仍为紫色,也可能显红色
C.可能显蓝色 D.一定显蓝色
2.同学们在实验室用自制的紫色紫薯汁滴加到一些化学试剂中,观察到下表实验现象,若将紫色紫薯汁滴加到氢氧化钠溶液中,溶液将显示( C )
溶液
白醋
盐酸
蔗糖水
草木灰水
石灰水
加入紫薯汁后的颜色
红色
红色
紫色
绿色
绿色
A.无色 B.红色 C.绿色 D.紫色
答案 C 氢氧化钠溶液、草木灰水、石灰水均显碱性,根据表中信息可知,加入紫薯汁后都变为绿色。
3.用酒精和水浸泡蝴蝶兰花可得到紫色溶液,该溶液遇酸溶液显红色,遇碱溶液显黄色。下列说法正确的是? ( )
A.蝴蝶兰花的溶液与酸作用显红色是物理变化
B.能使蝴蝶兰花的溶液显黄色的一定是碱
C.将食盐溶液滴入蝴蝶兰花的溶液中后,溶液仍为紫色
D.蝴蝶兰花的溶液不可用作酸碱指示剂
答案 C 蝴蝶兰花的溶液遇酸显红色是与酸发生了化学反应生成了新物质,属于化学变化;使蝴蝶兰花的溶液显黄色的溶液显碱性,但不一定是碱溶液;食盐溶液呈中性,所以滴入蝴蝶兰花的溶液中后,溶液仍为紫色; 蝴蝶兰花的溶液遇酸、碱能显示不同的颜色,可用作酸碱指示剂。
4.取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁。各取少许花汁,用稀酸和稀碱进行检验,结果如下表所示:
花的种类
花汁在酒精中的颜色
花汁在酸溶液中的颜色
花汁在碱溶液中的颜色
大红花
粉红色
橙色
绿色
万寿菊
黄色
黄色
黄色
雏菊
无色
无色
黄色
A.研磨花瓣时加入酒精是为了溶解其中的色素
B.在氢氧化钠的溶液中大红花汁会变成橙色
C.万寿菊花汁不能用作酸碱指示剂
D.可用雏菊花汁来区别稀盐酸和氢氧化钠溶液
2073910854710常见的酸碱课后练习
常见的酸碱课后练习
答案 B 色素能用酒精溶解,故A正确;氢氧化钠溶液呈碱性,由表中信息可知碱性溶液中大红花汁会呈现绿色,故B错误;万寿菊花汁在不同的溶液中颜色相同,不可以作指示剂,故C正确;稀盐酸与氢氧化钠溶液分别呈酸性、碱性,雏菊花汁可以区分它们,故D正确。
1.下列物质敞口放置于空气中,一段时间后质量减少的是( C )
A.氧化钙 B.浓硫酸 C.浓盐酸 D.氢氧化钠
2.下列各组物质若曝露在空气中,前者质量增加而不变质,后者变质且质量增加的是( )
A.浓盐酸、熟石灰 B.熟石灰、石灰石
C.浓硫酸、氯化钠 D.浓硫酸、苛性钠
答案 D 浓硫酸有吸水性,能吸收空气中的水分而使质量增加,但不变质;苛性钠是氢氧化钠的俗称,氢氧化钠与空气中的二氧化碳反应而变质,使质量增加。
3.下列有关氢氧化钠性质的说法错误的是( )
A.氢氧化钠有腐蚀性 B.固体氢氧化钠有挥发性
C.氢氧化钠不能用来干燥二氧化碳气体 D.固体氢氧化钠能吸收水蒸气而潮解
答案 B 氢氧化钠有强烈的腐蚀性,A正确;氢氧化钠能吸收空气中的水蒸气而潮解,不具有挥发性,D正确,B不正确;氢氧化钠能与二氧化碳反应,不能用来干燥二氧化碳气体,C正确。
4.下列叙述正确的是( )
A
液态氧、矿泉水、医用酒精均为纯净物
B
NaHCO3、H2SO4、HNO3均为酸
C
NH3?H2O、NaOH、KOH均为碱
D
CO2、Al2O3、KMnO4均为氧化物
解答:
解:A、矿泉水、医用酒精都属于混合物,错误;
B、NaHCO3电离产生了阳离子钠离子,属于盐,错误;
C、NH3?H2O、NaOH、KOH均为碱,正确;
D、KMnO4中含有三种元素,不属于氧化物,错误;
5.下列溶液中,能使酚酞试液变红的是( )
A.氢氧化钠溶液 B.稀硫酸 C.稀盐酸 D.醋酸
答案 A 碱性溶液能使酚酞试液变红,稀硫酸、稀盐酸与醋酸都呈酸性,不能使酚酞试液变色。
6.化学课上,化学老师为同学们表演了小魔术,他将一张白纸展示给大家,然后用喷壶向纸上喷了一些无色液体,“化学真奇妙”的红色大字立刻显现于纸上。他所用的试剂可能是下列哪一组( )
A.酚酞——石灰水溶液 B.酚酞——盐酸
C.石蕊——石灰水溶液 D.石蕊——盐酸
答案 A 石蕊试液呈紫色,酚酞试液呈无色,所以白纸上可能事先喷有酚酞,石灰水能使酚酞变红,向纸上喷的液体可能是石灰水。
7.氢氧化铯是一种可溶性碱,其化学式为CsOH,是制取各种铯盐的原料,也常用于玻璃、陶瓷工业。下列叙述不正确的是( )
A.CsOH溶液能使紫色石蕊试液变蓝 B.CsOH溶液不能使无色酚酞试液变色
C.CsOH溶液中含有OH- D.CsOH与CO2反应生成Cs2CO3和H2O
答案 B 碱溶液能使紫色石蕊试液变蓝,使无色酚酞试液变红,A正确、B不正确;可溶性碱溶于水后能解离出OH-,C正确;结合NaOH与CO2反应的产物可以判断D正确。
8.食醋中含有醋酸,食醋除作调味剂外,生活中还有妙用,下列使用食醋肯定不能达到目的是( )
A.除去水壶壁上的水垢 B.减弱皮蛋的涩性
C.除去菜刀上的铁锈 D.鉴别黄金饰品中是否含有铜
【分析】根据酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应),据此进行分析解答.
解:A、水垢的主要成分是碳酸钙,能与醋酸反应,使用食醋能达到目的,故选项错误.
B、皮蛋的涩性是因为制作过程中产生了氢氧化钠,氢氧化钠能与醋酸发生中和反应,能减弱皮蛋的涩性,使用食醋能达到目的,故选项错误.
C、铁锈的主要成分是氧化铁,能与醋酸反应,使用食醋能达到目的,故选项错误.
D、铜的金属活动性比氢弱,不能与醋酸反应,使用食醋不能达到目的,故选项正确.
9.探究小组利用如图所示装置进行四组实验,胶头滴管中盛装的是液体,烧瓶中盛装的是气体、固体或液体,当胶头滴管滴几滴液体后,能观察到气球变大的实验组合是( )
组合
滴管中
烧瓶中
A
H2SO4(稀)
NaOH(固)
B
稀盐酸
Zn(固)
C
NaOH溶液
CO2(气)
D
H2SO4(浓)
H2O(液)
4467225-19050
答案 C 要使气球变大,必须使烧瓶内气压减小。NaOH能与二氧化碳气体反应,使烧瓶内压强减小。
10.某同学将一朵紫色牵牛花泡在石灰水里,牵牛花很快就变成了蓝色,又将牵牛花泡在稀盐酸中,牵牛花又变成了红色,请你根据以上实验现象回答:
(1)该同学将紫色牵牛花泡在肥皂水中很快就变成了蓝色,肥皂水显 (填“酸性”或“碱性”)。
(2)该牵牛花的汁液 (填“能”或“不能”)用作指示剂。
(3)将牵牛花泡在家庭厨房里的某种调味品中,牵牛花变成了红色,选用的调味品可能是 。
答案 (1)碱性 (2)能 (3)白醋 解析 紫色牵牛花泡在石灰水里,牵牛花很快就变成了蓝色,而将紫色牵牛花泡在肥皂水中很快变成了蓝色,说明肥皂水显碱性;牵牛花在酸性、碱性溶液中能呈现不同的颜色,所以牵牛花汁液能用作指示剂;将牵牛花泡在家庭厨房里的某种调味品中,牵牛花变成了红色,说明该溶液呈酸性, 可能是白醋。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
