苏教版高中化学物质结构与性质专题5《物质结构的探索无止境》测试卷
文档属性
| 名称 | 苏教版高中化学物质结构与性质专题5《物质结构的探索无止境》测试卷 |

|
|
| 格式 | docx | ||
| 文件大小 | 55.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-25 23:18:13 | ||
图片预览




文档简介
专题5《物质结构的探索无止境》测试卷
一、单选题(共15小题)
1.X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
A.
四种元素的原子半径:rZ>rX>rY>rW
B.
四种元素形成的单质最多有6种
C.
四种元素均可与氢元素形成电子总数为18的分子
D.
四种元素中,Z的最高价氧化物对应的水化物酸性最强
2.X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6.下列说法正确的是( )
A.
Y元素最高价氧化物对应的水化物化学式H2YO4
B.
原子半径由小到大的顺序为:X<Z<Y
C.
Y、Z两种元素气态氢化物中,Z的气态氢化物最稳定
D.
X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2
3.据报道我国科学家最近研制出一种新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成。下列相关叙述不正确的是( )
A.
它耐高温抗氧化
B.
它比钢铁轻、硬,但质地较脆
C.
它没有固定熔点
D.
它是一种新型无机非金属材料
4.短周期原子序数依次增大的主族元素R、T、Q、W、Y具有如下信息:①R、Y原子的最外层电子数与电子层数相同;②Q是地壳中含量最高的元素,R与T的核电荷数之和等于Q的核电荷数;③W与R同主族.下列说法正确的是( )
A.
元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子,属于同种晶体类型
B.
元素T、Q、W、Y的原子半径大小为:T<Q<Y<W
C.
Q与Y组成的常见物质是一种两性物质,结构中含有共价键
D.
由Y和T组成的物质YT是原子晶体,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成
5.已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
A.
Z元素的原子半径可能比Y元素的小
B.
W的原子序数可能是Y的原子序数的2倍
C.
W的气态氢化物的稳定性一定比Y的强
D.
Z的化学活泼性一定比X强
6.J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )
A.
J和氢组成的化合物分子中只含有极性共价键
B.
工业上用电解熔融的M的氧化物方法来制备M
C.
R、T两元素的气态氢化物中,T的气态氢化物更稳定
D.
J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4
7.下列含氧酸中酸性最强的是( )
A.
H3PO4
B.
H3AsO4
C.
HNO3
D.
HClO
8.已知1~18号元素的离子aW3+、bX+、cY2﹣、dZ﹣都具有相同的电子层结构,下列关系正确的是( )
A.
质子数:c>d
B.
离子的还原性:Y2﹣>Z﹣
C.
氢化物的稳定性:H2Y>HZ
D.
原子半径:X<W
9.下列说法不正确的是( )
A.
化学反应有新物质生成,并遵循质量守恒定律和能量守恒定律
B.
原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物的官能团
C.
分子间作用力比化学键弱得多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响
D.
酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义
10.下列描述正确的是( )
A.
2004年我国首创用CO2合成可降解塑料聚二氧化碳,但该塑料仍然产生白色污染
B.
超临界流体是介于气态和液态之间的一种状态,故超临界流体CO2是合成的新物质
C.
澳大利亚开发出被称为第五形态的固体碳——“纳米泡沫”,其形似海绵,密度极小且有磁性。可以预见,这种新材料的化学性质与金刚石完全不同
D.
由于氢键的影响,甲酸蒸气的密度在373
K时为1.335
g·L-1,在293
K时为2.5
g·L-1
11.90年代初,国际上提出了“预防污染”的绿色化学基本手段,下列各项中,符合绿色化学含义的是( )
A.
回收废的物品
B.
生产绿色的产品
C.
不生产有毒物质
D.
进行无污染的化工生产
12.据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60的结构。下列叙述不正确的是( )
①该物质有很高的熔点、很大的硬度
②该物质形成的晶体属分子晶体
③该物质分子中Si60被包裹在C60里面
④该物质的相对分子质量为2400
A.
①②
B.
③④
C.
①③
D.
②④
13.“绿色化学”是当今社会提出的一个新概念。在“绿色化学工艺”中,理想状态是反应原子全部转化为欲制得的产物,即原子利用率为100%。用甲烷合成乙酸乙酯,欲使原子利用率达到最高,还需要消耗的其他反应物有( )
A.
CO
B.
CO2和H2O
C.
H2O和O2
D.
CH3OH和O2
14.已知下列数据:
下列事实可用上述数据解释的是( )
A.
乙烯的熔沸点比乙烷的低
B.
乙炔在水中的溶解度比乙烯的大
C.
乙炔燃烧时有浓烟产生
D.
乙烯、乙炔都易发生加成反应
15.最近,医学界通过用放射性14C标记C60的羧酸衍生物在特定的条件下可断裂DNA杀死细胞,从而可用于抑制艾滋病毒。关于放射性14C的下列说法中,正确的是( )
A.
与12C互为同位素
B.
是12C的同素异形体
C.
与14N所含中子数相同
D.
与C60中普通碳原子的化学性质不同
二、填空题(共3小题)
16.有下列物质:①HCl、②Na2O2、③HClO、④NH4Cl、⑤Br2、⑥Fe,请填写下列空白:[第(1)~(5)小题填序号]
(1)只以非极性共价键结合的是________。
(2)既存在离子键,又存在非极性共价键的是________。
(3)具有极性共价键和离子键的是________。
(4)相邻原子间以共价键结合,不稳定,易分解的是__________________________。
(5)含有配位键的是________。
(6)④中含有键的类型为______________________________________________。
(7)⑥中存在________键。
17.过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
(1)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是________(填字母)。
A.苯与B3N3H6互为等电子体,且分子中原子共平面
B.甲醛、苯和二氧化碳中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
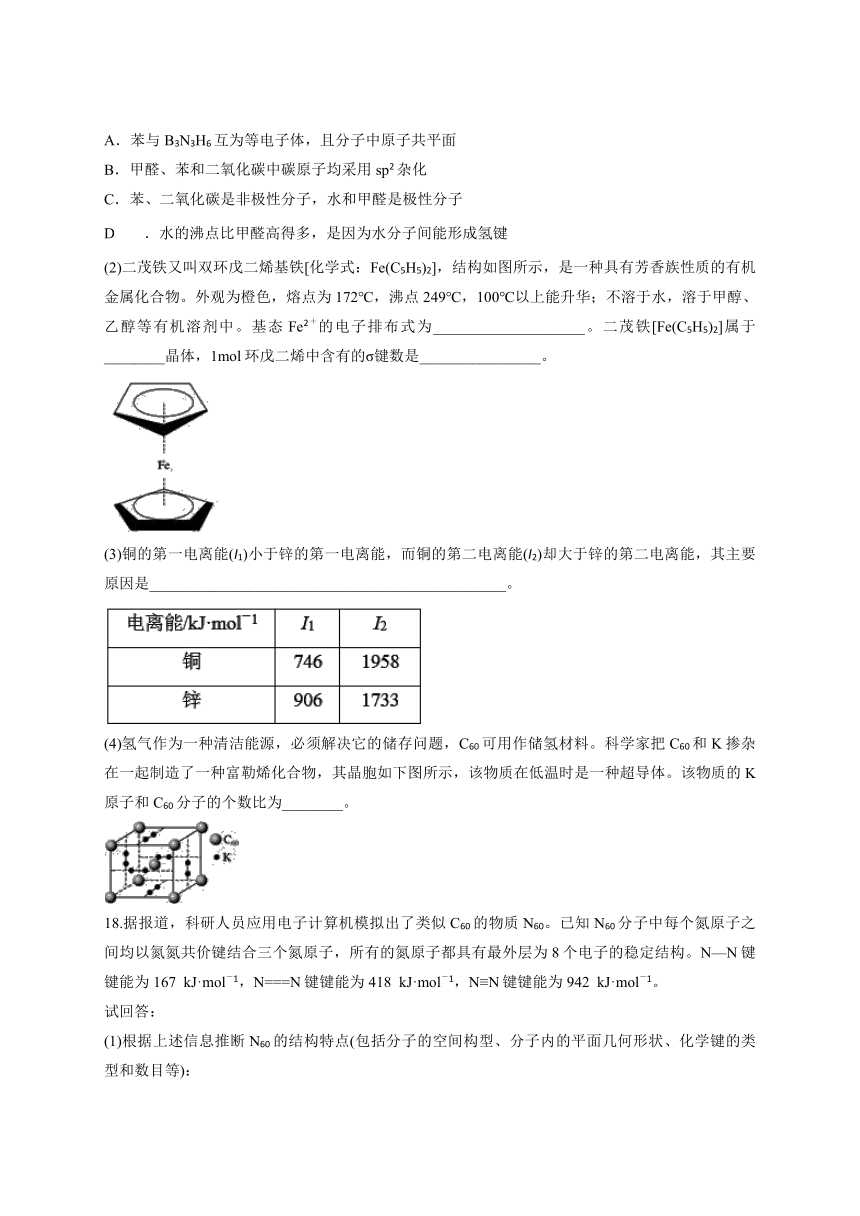
(2)二茂铁又叫双环戊二烯基铁[化学式:Fe(C5H5)2],结构如图所示,是一种具有芳香族性质的有机金属化合物。外观为橙色,熔点为172℃,沸点249℃,100℃以上能升华;不溶于水,溶于甲醇、乙醇等有机溶剂中。基态Fe2+的电子排布式为____________________。二茂铁[Fe(C5H5)2]属于________晶体,1mol环戊二烯中含有的σ键数是________________。
(3)铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是_______________________________________________。
(4)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如下图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为________。
18.据报道,科研人员应用电子计算机模拟出了类似C60的物质N60。已知N60分子中每个氮原子之间均以氮氮共价键结合三个氮原子,所有的氮原子都具有最外层为8个电子的稳定结构。N—N键键能为167
kJ·mol-1,N===N键键能为418
kJ·mol-1,N≡N键键能为942
kJ·mol-1。
试回答:
(1)根据上述信息推断N60的结构特点(包括分子的空间构型、分子内的平面几何形状、化学键的类型和数目等):
________________________________________________________________________
________________________________________________________________________。
(2)根据键能和物质化学变化中的能量变化原理计算,1
mol
N60全部分解为N2所吸收或放出的能量(热量)为____
kJ。
(3)根据(2)的计算结论推断,下列N60的用途中正确的是________。
A.可用作高能炸药
B.可用作高能燃料
答案解析
1.【答案】C
【解析】X、Y、Z、W四种属于短周期元素,根据元素在周期表中的位置知,W、X、Y属于第二周期元素,Z属于第三周期元素,设X的原子最外层电子数是a,则W的最外层电子数是a﹣1,Y的最外层电子数是a+1,Z最外层电子数是a,这四种元素原子的最外层电子数之和为20,则a﹣1+a+a+1+a=20,a=5,所以X是N元素、W是C元素、Y是O元素、Z是P元素,
A.原子的电子层数越多,其原子半径越大,同一周期中,原子半径随着原子序数的增大而减小,所以四种元素的原子半径:rZ>rX>rY>rW,故A错误;
B.形成单质最多的元素是C元素,碳元素的单质有:金刚石、石墨、木炭、焦炭、活性炭、炭黑、C60等,故B错误;
C.这四种元素形成的18电子的分子为:C2H6、N2H4、H2O2、PH3,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,这几种元素中,虽然O元素的非金属性最强,但O元素没有最高价含氧酸,所以X的最高价氧化物的水化物酸性最强,故D错误;
2.【答案】D
【解析】X、Y、Z、W为四种短周期主族元素,W是短周期主族元素中原子半径最大的,则W为Na元素;X原子最外层电子数是核外电子层数的3倍,只能为电子层数为2,最外层电子数为6,即X为O元素,X、Z同族,则Z为S元素;Y的最高正价与最低负价代数和为6,其最高价为+7价,Y、Z同周期,Y为Cl元素,
A.Y为Cl,Y元素最高价氧化物对应的水化物化学式HYO4,故A错误;
B.电子层越多,半径越大,同周期从左向右原子半径在减小,则原子半径由小到大的顺序为:X<Y<Z,故B错误;
C.非金属性Cl>S,则Y、Z两种元素气态氢化物中,Y的气态氢化物最稳定,故C错误;
D.X与W形成的两种化合物为Na2O、Na2O2,阴、阳离子物质的量之比均为1:2,故D正确;
3.【答案】B
【解析】由该材料主要成分的性质可知其应具有耐高温抗氧化的性能,A项正确;题中给出信息“连续纤维增韧”航空材料,则说明该材料具有良好的韧性,B项错误;该材料是由碳化硅、陶瓷和碳纤维复合而成,属于混合物,没有固定的熔、沸点,C项正确;该材料由无机物复合而成,应为新型无机非金属材料,D项正确。
4.【答案】A
【解析】短周期原子序数依次增大的主族元素R、T、Q、W、Y,其中R、Y原子的最外层电子数与电子层数相同,符合条件的元素有H、Be、Al;Q是地壳中含量最高的元素,则Q为O元素;由于R与T的核电荷数之和等于Q的核电荷数,Al原子序数大于O,R为Be时,T的原子序数为4,R、T原子序数相同,故R只能为H元素,故Y为Al,则T的原子序数=8﹣1=7,即T为N元素;W与R同主族,结合原子序数可知W为Na元素,
A.Q与W形成的两种常见化合物为Na2O、Na2O2,二者含有阴、阳离子之比都是2:1,均属于离子化合物,故A正确;
B.同主族自上而下原子半径增大,同周期随原子序数增大原子半径减小,故原子半径:O<N<Al<Na,即Q<T<Y<W,故B错误;
C.Q与Y组成的常见物质是一种两性物质为Al2O3,属于离子化合物,不含共价键,故C错误;
D.Y和T组成的物质AlN是原子晶体,不能由单质Al和氮气在低温下合成,故D错误,
5.【答案】B
【解析】A、为主族元素,原子核外电子层数越多,半径越大,则Z元素的原子半径一定比Y元素的大,故A错误;
B、若Y为O,原子序数为8,W为S,原子序数为16,则符合,故B正确;
C、同主族元素,从上到下元素的非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则W的气态氢化物的稳定性一定比Y的弱,故C错误;
D、若Z、X是非金属元素,则Z的化学活泼性比X弱,若Z、X是金属元素,则Z的化学活泼性比X强,故D错误;
6.【答案】A
【解析】J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素可知J为C元素,则R应为S元素,M是地壳中含量最多的金属元素,故M为Al元素,而T是原子序数最大的元素,且为短周期主族元素,故T为Cl元素.
A.J为C元素,和H元素组成的化合物烃中C﹣H键为极性键,C﹣C键,C═C,C≡C为非极性键,故A错误;
B.B.AlCl3为共价化合物,熔融状态下不导电,工业冶炼应用Al2O3,故B正确;
C.R应为S元素,T为Cl元素,同周期元素中,从左到右元素的非金属性逐渐增强,则对应的氢化物的稳定性逐渐增强,故T对应的氢化物更稳定,故C正确;
D.T的非金属性最强,最高化合价为+7价,对应的最高价氧化物对应的水化物中酸性最强的是HClO4,故D正确.
7.【答案】C.
【解析】A、H3PO4可以为PO(OH)3,非羟基氧原子数目为1,
B、H3AsO4可以改写为AsO1(OH)3,非羟基氧原子数目为1;
C、HNO3可以改写为NO2(OH)1,非羟基氧原子数目为2;
D、HClO可以改写为Cl(OH)1,非羟基氧原子数目为0;
HNO3中非羟基氧原子数目最多,酸性最强,
8.【答案】B
【解析】因四种离子的电子层结构相同,所以质子数a、b、c、d的大小关系应为a>b>d>c,且Y、Z在上一周期,Y在Z的左边,Y的非金属性小于Z;W、X在下一周期,X在W的左边,X的金属性大于W.
A、质子数d>c,故A错误;
B、离子的还原性:Y2﹣>Z﹣,故B正确;
C、氢化物稳定性应为HZ>H2Y,故C错误;
D、原子半径大小关系应为X>W,故D错误
9.【答案】C
【解析】 化学反应有新物质生成并且遵循质量守恒定律和能量守恒定律,光谱分析可以测定金属元素和官能团,酶具有高效、专一等性质,因此A、B、D正确;分子间作用力对物质的熔点、沸点、溶解度都有影响,因此C项错误。
10.【答案】D
【解析】A项,可降解塑料不会产生白色污染;B项,CO2的分子组成未变,只是状态改变,故超临界流体CO2不是新物质;C项,“纳米泡沫”和金刚石是由碳元素组成的不同单质,互为同素异形体,化学性质是相似的;D项,甲酸蒸气随温度的降低,氢键被破坏的程度减小,分子间的作用力增大,所以密度增大。
11.【答案】D
【解析】
12.【答案】C
【解析】分子晶体的熔点比较低,硬度比较小。Si原子半径大于C原子半径,C60应被包裹在Si60里面。
13.【答案】A
【解析】根据原子利用率为100%,甲烷和其他反应物的原子应全部变成乙酸乙酯,2
mol
CH4和2
mol
CO可合成1
mol乙酸乙酯(C4H8O2),并无副产物,而其余的都有副产物。
14.【答案】D
【解析】A.分子晶体的熔沸点与相对分子质量成正比,与键长、键能无关,故A错误;
B.键长和键能与物质的溶解性无关,故B错误;
C.是否产生浓烟与含碳量有关,与键长、键能无关,故C错误;
D.乙烯和乙炔中的双键和三键并不是碳碳单键的加和,平均键能比碳碳单键的小,所以碳碳双键和碳碳三键易发生加成反应,故D正确;
15.【答案】A
【解析】
16.【答案】(1)⑤ (2)② (3)④ (4)③ (5)④
(6)离子键、极性共价键、配位键 (7)金属
【解析】
17.【答案】(1)ACD
(2)1s22s22p63s23p63d6或[Ar]3d6 分子 11NA(或11×6.02×1023)
(3)Cu失去一个电子成为Cu+后,核外电子排布为[Ar]3d10,属于能量较低的稳定结构,所以Cu的第二电离能相对较大
(4)3∶1
【解析】(1)苯分子中有12个原子,电子总数为42,B3N3H6分子中有12个原子,电子总数为42,因此二者属于等电子体,选项A正确;甲醛和苯分子中碳原子为sp2杂化,二氧化碳分子中碳原子为sp杂化,选项B错误;苯和二氧化碳是非极性分子、水和甲醛是极性分子,选项C正确;水分子间能形成氢键,但甲醛分子间由于没有和O、N、F等相连的氢,因此甲醛分子间不能形成氢键,选项D正确。
(2)铁元素的原子序数为26,+2价铁原子核外有24个电子,其电子排布式为1s22s22p63s23p63d6或[Ar]3d6;从性质上可以判断二茂铁属于分子晶体;1个环戊二烯分子中有11个σ键;因此1mol环戊二烯中含有的σ键数是11NA。
(3)+1价铜原子核外电子结构为全满或全空的稳定结构,所以铜的第二电离能较大。
(4)由均摊法可知晶胞中有2个C60,6个K,则K原子和C60分子的个数比为3∶1。
18.【答案】(1)分子的空间构型为球形,球面由五边形和六边形组成,化学键全部为氮氮单键,共90个
(2)13
230
(3)AB
【解析】(1)C60分子的空间结构为球形,N60分子的空间结构也是球形的。N原子有5个价电子,每个N原子又结合了3个N原子,所有的氮原子都具有最外层为8个电子的稳定结构,所以N60分子中的化学键只能是N—N键。每个N原子形成3个单键,每个单键由2个N原子共用,则N60分子中的单键数为60×个=90个。
(2)1
mol
N60分子含有90
mol
N—N键,它分解生成30
mol
N≡N键。
1
mol
N60分子中化学键拆开吸收的能量为
90
mol×167
kJ·mol-1=15
030
kJ。
30
mol
N2分子中化学键的形成放出的能量为
30
mol×942
kJ·mol-1=28
260
kJ。
放出的总能量比吸收的总能量多13
230
kJ,化学反应是放热反应。
(3)由于N60的分解放出大量的热,因此N60用作高能炸药和高能燃料都是可以的。
一、单选题(共15小题)
1.X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
A.
四种元素的原子半径:rZ>rX>rY>rW
B.
四种元素形成的单质最多有6种
C.
四种元素均可与氢元素形成电子总数为18的分子
D.
四种元素中,Z的最高价氧化物对应的水化物酸性最强
2.X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6.下列说法正确的是( )
A.
Y元素最高价氧化物对应的水化物化学式H2YO4
B.
原子半径由小到大的顺序为:X<Z<Y
C.
Y、Z两种元素气态氢化物中,Z的气态氢化物最稳定
D.
X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2
3.据报道我国科学家最近研制出一种新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成。下列相关叙述不正确的是( )
A.
它耐高温抗氧化
B.
它比钢铁轻、硬,但质地较脆
C.
它没有固定熔点
D.
它是一种新型无机非金属材料
4.短周期原子序数依次增大的主族元素R、T、Q、W、Y具有如下信息:①R、Y原子的最外层电子数与电子层数相同;②Q是地壳中含量最高的元素,R与T的核电荷数之和等于Q的核电荷数;③W与R同主族.下列说法正确的是( )
A.
元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子,属于同种晶体类型
B.
元素T、Q、W、Y的原子半径大小为:T<Q<Y<W
C.
Q与Y组成的常见物质是一种两性物质,结构中含有共价键
D.
由Y和T组成的物质YT是原子晶体,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成
5.已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
A.
Z元素的原子半径可能比Y元素的小
B.
W的原子序数可能是Y的原子序数的2倍
C.
W的气态氢化物的稳定性一定比Y的强
D.
Z的化学活泼性一定比X强
6.J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )
A.
J和氢组成的化合物分子中只含有极性共价键
B.
工业上用电解熔融的M的氧化物方法来制备M
C.
R、T两元素的气态氢化物中,T的气态氢化物更稳定
D.
J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4
7.下列含氧酸中酸性最强的是( )
A.
H3PO4
B.
H3AsO4
C.
HNO3
D.
HClO
8.已知1~18号元素的离子aW3+、bX+、cY2﹣、dZ﹣都具有相同的电子层结构,下列关系正确的是( )
A.
质子数:c>d
B.
离子的还原性:Y2﹣>Z﹣
C.
氢化物的稳定性:H2Y>HZ
D.
原子半径:X<W
9.下列说法不正确的是( )
A.
化学反应有新物质生成,并遵循质量守恒定律和能量守恒定律
B.
原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物的官能团
C.
分子间作用力比化学键弱得多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响
D.
酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义
10.下列描述正确的是( )
A.
2004年我国首创用CO2合成可降解塑料聚二氧化碳,但该塑料仍然产生白色污染
B.
超临界流体是介于气态和液态之间的一种状态,故超临界流体CO2是合成的新物质
C.
澳大利亚开发出被称为第五形态的固体碳——“纳米泡沫”,其形似海绵,密度极小且有磁性。可以预见,这种新材料的化学性质与金刚石完全不同
D.
由于氢键的影响,甲酸蒸气的密度在373
K时为1.335
g·L-1,在293
K时为2.5
g·L-1
11.90年代初,国际上提出了“预防污染”的绿色化学基本手段,下列各项中,符合绿色化学含义的是( )
A.
回收废的物品
B.
生产绿色的产品
C.
不生产有毒物质
D.
进行无污染的化工生产
12.据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60的结构。下列叙述不正确的是( )
①该物质有很高的熔点、很大的硬度
②该物质形成的晶体属分子晶体
③该物质分子中Si60被包裹在C60里面
④该物质的相对分子质量为2400
A.
①②
B.
③④
C.
①③
D.
②④
13.“绿色化学”是当今社会提出的一个新概念。在“绿色化学工艺”中,理想状态是反应原子全部转化为欲制得的产物,即原子利用率为100%。用甲烷合成乙酸乙酯,欲使原子利用率达到最高,还需要消耗的其他反应物有( )
A.
CO
B.
CO2和H2O
C.
H2O和O2
D.
CH3OH和O2
14.已知下列数据:
下列事实可用上述数据解释的是( )
A.
乙烯的熔沸点比乙烷的低
B.
乙炔在水中的溶解度比乙烯的大
C.
乙炔燃烧时有浓烟产生
D.
乙烯、乙炔都易发生加成反应
15.最近,医学界通过用放射性14C标记C60的羧酸衍生物在特定的条件下可断裂DNA杀死细胞,从而可用于抑制艾滋病毒。关于放射性14C的下列说法中,正确的是( )
A.
与12C互为同位素
B.
是12C的同素异形体
C.
与14N所含中子数相同
D.
与C60中普通碳原子的化学性质不同
二、填空题(共3小题)
16.有下列物质:①HCl、②Na2O2、③HClO、④NH4Cl、⑤Br2、⑥Fe,请填写下列空白:[第(1)~(5)小题填序号]
(1)只以非极性共价键结合的是________。
(2)既存在离子键,又存在非极性共价键的是________。
(3)具有极性共价键和离子键的是________。
(4)相邻原子间以共价键结合,不稳定,易分解的是__________________________。
(5)含有配位键的是________。
(6)④中含有键的类型为______________________________________________。
(7)⑥中存在________键。
17.过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
(1)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是________(填字母)。
A.苯与B3N3H6互为等电子体,且分子中原子共平面
B.甲醛、苯和二氧化碳中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
(2)二茂铁又叫双环戊二烯基铁[化学式:Fe(C5H5)2],结构如图所示,是一种具有芳香族性质的有机金属化合物。外观为橙色,熔点为172℃,沸点249℃,100℃以上能升华;不溶于水,溶于甲醇、乙醇等有机溶剂中。基态Fe2+的电子排布式为____________________。二茂铁[Fe(C5H5)2]属于________晶体,1mol环戊二烯中含有的σ键数是________________。
(3)铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是_______________________________________________。
(4)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如下图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为________。
18.据报道,科研人员应用电子计算机模拟出了类似C60的物质N60。已知N60分子中每个氮原子之间均以氮氮共价键结合三个氮原子,所有的氮原子都具有最外层为8个电子的稳定结构。N—N键键能为167
kJ·mol-1,N===N键键能为418
kJ·mol-1,N≡N键键能为942
kJ·mol-1。
试回答:
(1)根据上述信息推断N60的结构特点(包括分子的空间构型、分子内的平面几何形状、化学键的类型和数目等):
________________________________________________________________________
________________________________________________________________________。
(2)根据键能和物质化学变化中的能量变化原理计算,1
mol
N60全部分解为N2所吸收或放出的能量(热量)为____
kJ。
(3)根据(2)的计算结论推断,下列N60的用途中正确的是________。
A.可用作高能炸药
B.可用作高能燃料
答案解析
1.【答案】C
【解析】X、Y、Z、W四种属于短周期元素,根据元素在周期表中的位置知,W、X、Y属于第二周期元素,Z属于第三周期元素,设X的原子最外层电子数是a,则W的最外层电子数是a﹣1,Y的最外层电子数是a+1,Z最外层电子数是a,这四种元素原子的最外层电子数之和为20,则a﹣1+a+a+1+a=20,a=5,所以X是N元素、W是C元素、Y是O元素、Z是P元素,
A.原子的电子层数越多,其原子半径越大,同一周期中,原子半径随着原子序数的增大而减小,所以四种元素的原子半径:rZ>rX>rY>rW,故A错误;
B.形成单质最多的元素是C元素,碳元素的单质有:金刚石、石墨、木炭、焦炭、活性炭、炭黑、C60等,故B错误;
C.这四种元素形成的18电子的分子为:C2H6、N2H4、H2O2、PH3,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,这几种元素中,虽然O元素的非金属性最强,但O元素没有最高价含氧酸,所以X的最高价氧化物的水化物酸性最强,故D错误;
2.【答案】D
【解析】X、Y、Z、W为四种短周期主族元素,W是短周期主族元素中原子半径最大的,则W为Na元素;X原子最外层电子数是核外电子层数的3倍,只能为电子层数为2,最外层电子数为6,即X为O元素,X、Z同族,则Z为S元素;Y的最高正价与最低负价代数和为6,其最高价为+7价,Y、Z同周期,Y为Cl元素,
A.Y为Cl,Y元素最高价氧化物对应的水化物化学式HYO4,故A错误;
B.电子层越多,半径越大,同周期从左向右原子半径在减小,则原子半径由小到大的顺序为:X<Y<Z,故B错误;
C.非金属性Cl>S,则Y、Z两种元素气态氢化物中,Y的气态氢化物最稳定,故C错误;
D.X与W形成的两种化合物为Na2O、Na2O2,阴、阳离子物质的量之比均为1:2,故D正确;
3.【答案】B
【解析】由该材料主要成分的性质可知其应具有耐高温抗氧化的性能,A项正确;题中给出信息“连续纤维增韧”航空材料,则说明该材料具有良好的韧性,B项错误;该材料是由碳化硅、陶瓷和碳纤维复合而成,属于混合物,没有固定的熔、沸点,C项正确;该材料由无机物复合而成,应为新型无机非金属材料,D项正确。
4.【答案】A
【解析】短周期原子序数依次增大的主族元素R、T、Q、W、Y,其中R、Y原子的最外层电子数与电子层数相同,符合条件的元素有H、Be、Al;Q是地壳中含量最高的元素,则Q为O元素;由于R与T的核电荷数之和等于Q的核电荷数,Al原子序数大于O,R为Be时,T的原子序数为4,R、T原子序数相同,故R只能为H元素,故Y为Al,则T的原子序数=8﹣1=7,即T为N元素;W与R同主族,结合原子序数可知W为Na元素,
A.Q与W形成的两种常见化合物为Na2O、Na2O2,二者含有阴、阳离子之比都是2:1,均属于离子化合物,故A正确;
B.同主族自上而下原子半径增大,同周期随原子序数增大原子半径减小,故原子半径:O<N<Al<Na,即Q<T<Y<W,故B错误;
C.Q与Y组成的常见物质是一种两性物质为Al2O3,属于离子化合物,不含共价键,故C错误;
D.Y和T组成的物质AlN是原子晶体,不能由单质Al和氮气在低温下合成,故D错误,
5.【答案】B
【解析】A、为主族元素,原子核外电子层数越多,半径越大,则Z元素的原子半径一定比Y元素的大,故A错误;
B、若Y为O,原子序数为8,W为S,原子序数为16,则符合,故B正确;
C、同主族元素,从上到下元素的非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则W的气态氢化物的稳定性一定比Y的弱,故C错误;
D、若Z、X是非金属元素,则Z的化学活泼性比X弱,若Z、X是金属元素,则Z的化学活泼性比X强,故D错误;
6.【答案】A
【解析】J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素可知J为C元素,则R应为S元素,M是地壳中含量最多的金属元素,故M为Al元素,而T是原子序数最大的元素,且为短周期主族元素,故T为Cl元素.
A.J为C元素,和H元素组成的化合物烃中C﹣H键为极性键,C﹣C键,C═C,C≡C为非极性键,故A错误;
B.B.AlCl3为共价化合物,熔融状态下不导电,工业冶炼应用Al2O3,故B正确;
C.R应为S元素,T为Cl元素,同周期元素中,从左到右元素的非金属性逐渐增强,则对应的氢化物的稳定性逐渐增强,故T对应的氢化物更稳定,故C正确;
D.T的非金属性最强,最高化合价为+7价,对应的最高价氧化物对应的水化物中酸性最强的是HClO4,故D正确.
7.【答案】C.
【解析】A、H3PO4可以为PO(OH)3,非羟基氧原子数目为1,
B、H3AsO4可以改写为AsO1(OH)3,非羟基氧原子数目为1;
C、HNO3可以改写为NO2(OH)1,非羟基氧原子数目为2;
D、HClO可以改写为Cl(OH)1,非羟基氧原子数目为0;
HNO3中非羟基氧原子数目最多,酸性最强,
8.【答案】B
【解析】因四种离子的电子层结构相同,所以质子数a、b、c、d的大小关系应为a>b>d>c,且Y、Z在上一周期,Y在Z的左边,Y的非金属性小于Z;W、X在下一周期,X在W的左边,X的金属性大于W.
A、质子数d>c,故A错误;
B、离子的还原性:Y2﹣>Z﹣,故B正确;
C、氢化物稳定性应为HZ>H2Y,故C错误;
D、原子半径大小关系应为X>W,故D错误
9.【答案】C
【解析】 化学反应有新物质生成并且遵循质量守恒定律和能量守恒定律,光谱分析可以测定金属元素和官能团,酶具有高效、专一等性质,因此A、B、D正确;分子间作用力对物质的熔点、沸点、溶解度都有影响,因此C项错误。
10.【答案】D
【解析】A项,可降解塑料不会产生白色污染;B项,CO2的分子组成未变,只是状态改变,故超临界流体CO2不是新物质;C项,“纳米泡沫”和金刚石是由碳元素组成的不同单质,互为同素异形体,化学性质是相似的;D项,甲酸蒸气随温度的降低,氢键被破坏的程度减小,分子间的作用力增大,所以密度增大。
11.【答案】D
【解析】
12.【答案】C
【解析】分子晶体的熔点比较低,硬度比较小。Si原子半径大于C原子半径,C60应被包裹在Si60里面。
13.【答案】A
【解析】根据原子利用率为100%,甲烷和其他反应物的原子应全部变成乙酸乙酯,2
mol
CH4和2
mol
CO可合成1
mol乙酸乙酯(C4H8O2),并无副产物,而其余的都有副产物。
14.【答案】D
【解析】A.分子晶体的熔沸点与相对分子质量成正比,与键长、键能无关,故A错误;
B.键长和键能与物质的溶解性无关,故B错误;
C.是否产生浓烟与含碳量有关,与键长、键能无关,故C错误;
D.乙烯和乙炔中的双键和三键并不是碳碳单键的加和,平均键能比碳碳单键的小,所以碳碳双键和碳碳三键易发生加成反应,故D正确;
15.【答案】A
【解析】
16.【答案】(1)⑤ (2)② (3)④ (4)③ (5)④
(6)离子键、极性共价键、配位键 (7)金属
【解析】
17.【答案】(1)ACD
(2)1s22s22p63s23p63d6或[Ar]3d6 分子 11NA(或11×6.02×1023)
(3)Cu失去一个电子成为Cu+后,核外电子排布为[Ar]3d10,属于能量较低的稳定结构,所以Cu的第二电离能相对较大
(4)3∶1
【解析】(1)苯分子中有12个原子,电子总数为42,B3N3H6分子中有12个原子,电子总数为42,因此二者属于等电子体,选项A正确;甲醛和苯分子中碳原子为sp2杂化,二氧化碳分子中碳原子为sp杂化,选项B错误;苯和二氧化碳是非极性分子、水和甲醛是极性分子,选项C正确;水分子间能形成氢键,但甲醛分子间由于没有和O、N、F等相连的氢,因此甲醛分子间不能形成氢键,选项D正确。
(2)铁元素的原子序数为26,+2价铁原子核外有24个电子,其电子排布式为1s22s22p63s23p63d6或[Ar]3d6;从性质上可以判断二茂铁属于分子晶体;1个环戊二烯分子中有11个σ键;因此1mol环戊二烯中含有的σ键数是11NA。
(3)+1价铜原子核外电子结构为全满或全空的稳定结构,所以铜的第二电离能较大。
(4)由均摊法可知晶胞中有2个C60,6个K,则K原子和C60分子的个数比为3∶1。
18.【答案】(1)分子的空间构型为球形,球面由五边形和六边形组成,化学键全部为氮氮单键,共90个
(2)13
230
(3)AB
【解析】(1)C60分子的空间结构为球形,N60分子的空间结构也是球形的。N原子有5个价电子,每个N原子又结合了3个N原子,所有的氮原子都具有最外层为8个电子的稳定结构,所以N60分子中的化学键只能是N—N键。每个N原子形成3个单键,每个单键由2个N原子共用,则N60分子中的单键数为60×个=90个。
(2)1
mol
N60分子含有90
mol
N—N键,它分解生成30
mol
N≡N键。
1
mol
N60分子中化学键拆开吸收的能量为
90
mol×167
kJ·mol-1=15
030
kJ。
30
mol
N2分子中化学键的形成放出的能量为
30
mol×942
kJ·mol-1=28
260
kJ。
放出的总能量比吸收的总能量多13
230
kJ,化学反应是放热反应。
(3)由于N60的分解放出大量的热,因此N60用作高能炸药和高能燃料都是可以的。
