总结与检测 寒假作业综合练 【新教材】2020-2021学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 总结与检测 寒假作业综合练 【新教材】2020-2021学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 304.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-27 14:13:24 | ||
图片预览



文档简介
2020-2021学年化学【新教材】鲁科版(2019)必修第一册寒假综合练:总结与检测
一、单选题
1.下列物质与其用途完全符合的有(
)条
①Na2CO3—制玻璃;②SiO2—太阳能电池;③AgI—人工降雨;④NaCl—制纯碱;
⑤Al2O3—
焊接钢轨;⑥NaClO—消毒剂⑦Fe2O3—红色油漆或涂料
⑧MgO—耐火材料
A.4
B.5
C.6
D.7
2.下列燃料不属于可再生能源的是(
)
A.乙醇
B.沼气
C.天然气
D.生物柴油
3.下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
某溶液中加入硝酸酸化的BaCl2溶液
白色沉淀
溶液中一定含有SO42-
B
某溶液中加入KSCN溶液
溶液呈血红色
溶液中一定有Fe3+无Fe2+
C
某气体通入澄清石灰水中
石灰水变浑浊
该气体一定是CO2
D
用铂丝蘸取溶液进行焰色反应
火焰呈黄色
溶液中一定有Na+可能有K+
A.A
B.B
C.C
D.D
4.下列物质的贮存方法错误的是
A.金属钠存放于煤油中
B.硝酸贮存在避光低温处
C.在盛溴的试剂瓶中加一定量的水液封,防止溴的挥发
D.单质碘贮存在棕色的细口瓶中
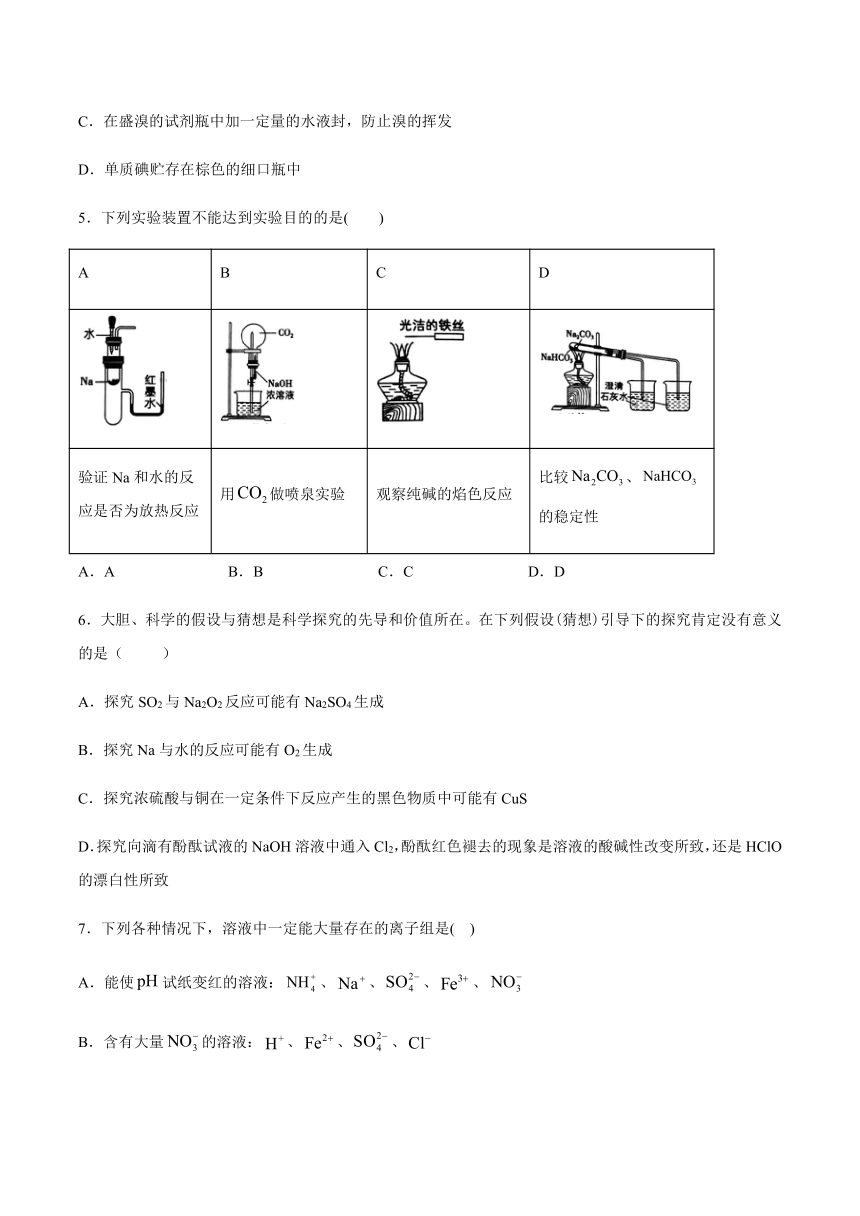
5.下列实验装置不能达到实验目的的是(
)
A
B
C
D
验证Na和水的反应是否为放热反应
用做喷泉实验
观察纯碱的焰色反应
比较、的稳定性
A.A
B.B
C.C
D.D
6.大胆、科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定没有意义的是(
)
A.探究SO2与Na2O2反应可能有Na2SO4生成
B.探究Na与水的反应可能有O2生成
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能有CuS
D.探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致
7.下列各种情况下,溶液中一定能大量存在的离子组是(
)
A.能使试纸变红的溶液:、、、、
B.含有大量的溶液:、、、
C.含有大量的溶液:、、、
D.加入铝粉后产生大量氢气的溶液:、、、
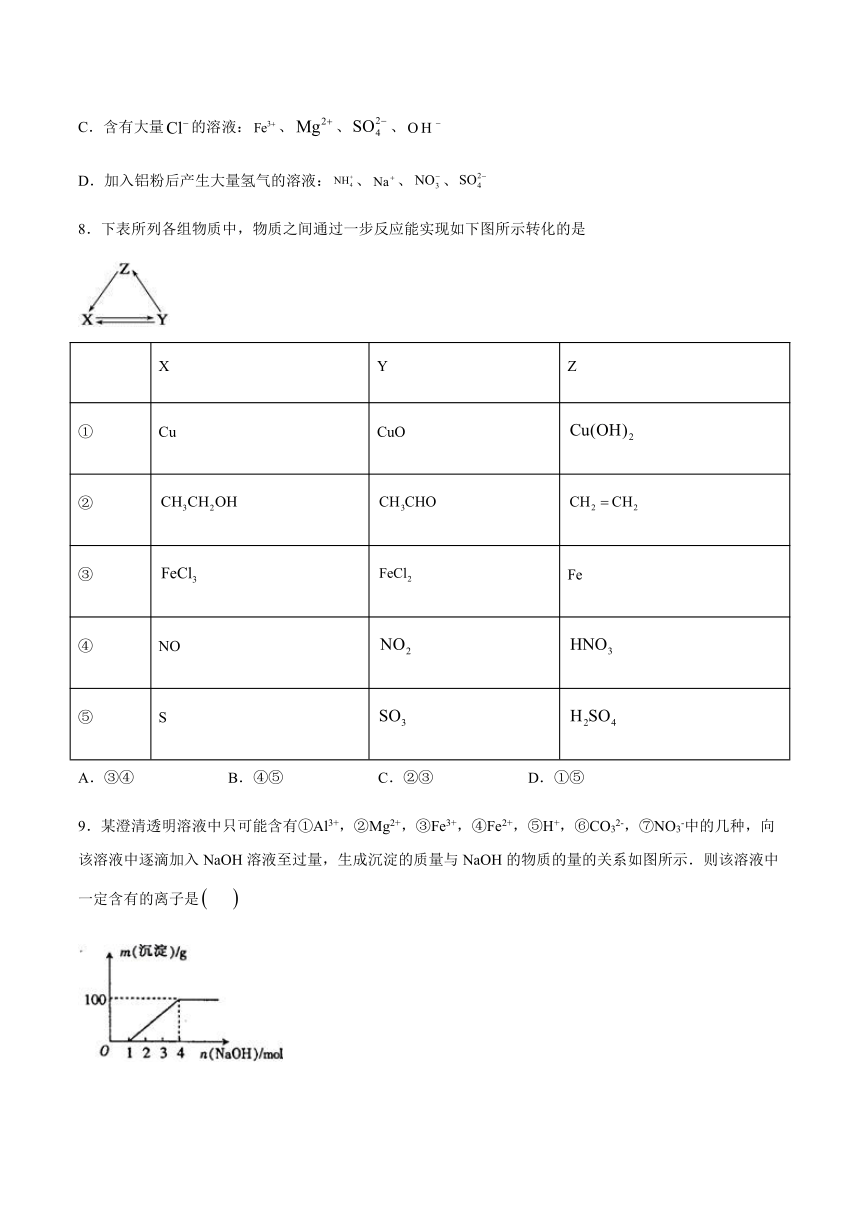
8.下表所列各组物质中,物质之间通过一步反应能实现如下图所示转化的是
X
Y
Z
①
Cu
CuO
②
③
Fe
④
NO
⑤
S
A.③④
B.④⑤
C.②③
D.①⑤
9.某澄清透明溶液中只可能含有①Al3+,②Mg2+,③Fe3+,④Fe2+,⑤H+,⑥CO32-,⑦NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是
A.⑤⑥⑦
B.②③⑤⑦
C.①②③⑥⑦
D.①②③④⑤⑦
10.实验室中的试纸种类很多、用途也比较广泛。下列试纸使用时不需要对试纸预先用蒸馏水润湿的是( )
A.用蓝色石蕊试纸检验氯化氢气体
B.用KI淀粉试纸检验氯气的存在
C.收集氨气时,用红色石蕊试纸检验是否收集满
D.用pH试纸检测稀盐酸溶液的pH
11.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品置于盛有足量水的烧杯中,充分搅拌后仍有部分固体存在,过滤后得到固体X与滤液Y;②将固体X置于稀硝酸中无明显变化;③取滤液Y少许滴加到NaOH溶液中有白色沉淀生成,则该白色粉末可能为(
)
A.Na2CO3、Al(OH)3
B.AgNO3、NH4Cl
C.MgSO4、BaCl2
D.CuCl2、Al(NO3)3
12.下列实验装置、选用的试剂或实验操作中,都正确的是
A.实验室用装置A制取氨气
B.用B装置吸收氨气,并防止倒吸
C.用C装置稀释浓硫酸
D.用D装置除去CO2中的HCl
13.下列反应中,改变反应物的用量或浓度,不会改变生成物的是
A.铜和硝酸反应
B.二氧化碳通入氢氧化钠溶液中
C.细铁丝在氯气中燃烧
D.氯化铝与氢氧化钠溶液反应
14.向27.2
g
Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5
L,固体物质完全反应,得到标准状况下8.96
L
NO和NO2的混合气体及Cu(NO3)2。在所得溶液中加入1.0
mol/L的NaOH溶液1.0
L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2
g。下列有关说法不正确的是
A.Cu和Cu2O的物质的量之比为2:1
B.硝酸的物质的量浓度为2.8
mol/L
C.产生的NO2的体积在标准状况下为2.24
L
D.原混合物中Cu元素的质量分数为94.1%
15.把含有某一氯化物杂质的氯化钙5.55克溶于水后,与足量的硝酸银溶液反应,生成的氯化银沉淀15克,则该杂质可能是
A.氯化钠
B.氯化钾
C.氯化铜
D.氯化铝
二、填空题
16.健康人体内含铁元素大约2~3g,人体内铁元素以亚铁离子和三价铁离子的形式存在,Fe2+易被吸收,所以给贫血者补充铁元素时,应补充含Fe2+的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
(1)试剂1的名称是__,试剂2的名称是__。
(2)加入新制氯水,溶液中发生反应的离子方程式是__。
(3)加入试剂2时溶液为淡红色说明“速力菲”中的Fe2+已部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有__性。
(4)不仅溶液中Fe2+易被氧化成Fe3+,溶液中白色沉淀Fe(OH)2更易被O2氧化,请写出反应的化学方程式___,现象为__。
17.化学来源于生活又服务于生活,请用化学用语回答下列问题:
(1)漂粉精中有效成分的化学式为:___________
(2)“硅材料”是无机非金属材料的主角,其中广泛应用于光导纤维的材料是:____________
(3)向浑浊的水中加入明矾KAl(SO4)2·12H2O后,水可得到净化。写出明矾在水中的电离方程式:___________。往明矾溶液中逐滴加入Ba(OH)2溶液,若使SO42-
恰好完全沉淀,发生反应的离子方程式为:___________;若使Al3+恰好完全沉淀,发生反应的离子方程式为:_____。
(4)饮用水中的NO3-对人类健康产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al
+
6NaNO3
+
4NaOH
=
10NaAlO2
+
3N2↑
+
2H2O
请回答下列问题:
①在化学方程式上用单线桥标出该反应中电子转移的方向和数目:____________
②上述反应中若生成标准状况下3.36LN2,则转移的电子数目为:_____________。
三、实验题
18.人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(1)实验室需要450
mL
0.02
mol/L酸性KMnO4标准溶液,现有仪器:①托盘天平②玻璃棒③药匙④烧杯⑤量筒,还需要__________玻璃仪器才能完成配制,需用托盘天平称量KMnO4固体__________g。
(2)下列操作会使配制的KMnO4溶液浓度偏大的是__________(填写编号,假设其他操作均正确)。
A
没有冷却至室温就转移液体到容量瓶并完成定容
B
将溶液移入容量瓶过程中有少量溶液溅出
C
使用容量瓶配制溶液,定容时,仰视刻度线
D
容量瓶刚用蒸馏水洗净,没有烘干就用来配制溶液
E
定容时,滴加蒸馏水,不慎加多高于刻度线,吸出少量水使凹液面最低点与刻度线相切
(3)测定血液样品中Ca2+的浓度:抽取血样20.0
mL,经过上述处理后得到草酸,再用0.020
mol/L
KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00
mL
KMnO4溶液。
①写出草酸与酸性KMnO4溶液反应的离子方程式______________。
②滴定终点时的现象是_________________。
③经过计算,血液样品中Ca2+的浓度为__________mg/cm3。
19.(1)实验室常用的几种气体发生装置如图A、B、C所示:
回答下列问题:
①若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的_____。
A.CO2
B.H2
C.Cl2
D.NH3
②D装置的小烧杯中应盛放NaOH溶液,目的是__________________。
③若要收集干净纯净的X气体,上述装置应如何改进____________________。
④若用B装置制取氨气可以用_________(填试剂名称)进行干燥。
(2)某化学兴趣小组为探究SO2的性质,按下图所示装置进行试验。
请回答下列问题:
①装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是_________、________。
②反应后,装置B中发生的现象是__________,装置D表现了SO2的_____性,装置E表现了SO2的_____性。
③F装置漏斗的作用是_____________。
④装置C中发生的离子方程式________________________________。
20.常温下,三硫代碳酸钠(Na2CS3)是玫瑰红色针状固体,与碳酸钠性质相近。在工农业生产中有广泛的用途。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验一:探究Na2CS3的性质
(1)向Na2CS3溶液中滴入酚酞试液,溶液变红色。用离子方程式说明溶液呈碱性的原因__。
(2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。该反应中被氧化的元素是__。
实验二:测定Na2CS3溶液的浓度
按如图所示连接好装置,取50.0mLNa2CS3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol·L-1稀H2SO4,关闭活塞。
已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,密度1.26g·mL-1,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放碱石灰的仪器的名称是__,碱石灰的主要成分是__(填化学式)。
(4)反应结束后打开活塞K,再缓慢通入热N2一段时间,其目的是_。
(5)C中发生反应的离子方程式是__。
(6)为了计算Na2CS3溶液的浓度,对充分反应后B中混合物进行过滤、洗涤、干燥、称重,得8.4g固体,则三颈瓶中Na2CS3的物质的量浓度为__。
(7)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值__(填“偏高”、“偏低”或“无影响”)。
参考答案
1.D2.C3.D4.D5.D6.B7.A8.A9.B10.D11.C12.B13.C14.C15.D
16.盐酸
KSCN
2Fe2++Cl2=2Fe3++2Cl-
还原
4Fe(OH)2+O2+2H2O=4Fe(OH)3
白色沉淀迅速变为灰绿色,最终变为红褐色
17.Ca(ClO)2
SiO2
KAl(SO4)2
=
K+
+
Al3+
+
2SO42-
2SO42-
+2Ba2++Al3++4OH-
=
2BaSO4↓
+
AlO2-+
2H2O
2Al3+
+
3Ba2+
+
6OH-
+
3SO42-
=
2Al(OH)3↓
+
3BaSO4↓
1.5NA
18.500?mL?容量瓶,胶头滴管
1.6
A
当滴入最后一滴酸性高锰酸钾溶液时,溶液恰好由无色变为紫红色,且半分钟内不褪色
1.2
19.C
尾气进行处理,防止污染环境
在装置A、
D之间增加一个盛有饱和食盐水的洗瓶
碱石灰(或CaO、Ca(OH)2等)
分液漏斗
圆底烧瓶
黄绿色逐渐变浅
氧化
漂白
防止倒吸
2MnO4-+5SO2+2H2O=5SO42-+2Mn2++4H+
20.CS32-+H2OHCS3-+OH-
S
干燥管
CaO和
NaOH
将装置中残留的CS2和H2S全部排入后续装置中,使其被完全吸收
CS2+2OH-=COS22-+H2O
1.75mol/L
偏高
一、单选题
1.下列物质与其用途完全符合的有(
)条
①Na2CO3—制玻璃;②SiO2—太阳能电池;③AgI—人工降雨;④NaCl—制纯碱;
⑤Al2O3—
焊接钢轨;⑥NaClO—消毒剂⑦Fe2O3—红色油漆或涂料
⑧MgO—耐火材料
A.4
B.5
C.6
D.7
2.下列燃料不属于可再生能源的是(
)
A.乙醇
B.沼气
C.天然气
D.生物柴油
3.下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
某溶液中加入硝酸酸化的BaCl2溶液
白色沉淀
溶液中一定含有SO42-
B
某溶液中加入KSCN溶液
溶液呈血红色
溶液中一定有Fe3+无Fe2+
C
某气体通入澄清石灰水中
石灰水变浑浊
该气体一定是CO2
D
用铂丝蘸取溶液进行焰色反应
火焰呈黄色
溶液中一定有Na+可能有K+
A.A
B.B
C.C
D.D
4.下列物质的贮存方法错误的是
A.金属钠存放于煤油中
B.硝酸贮存在避光低温处
C.在盛溴的试剂瓶中加一定量的水液封,防止溴的挥发
D.单质碘贮存在棕色的细口瓶中
5.下列实验装置不能达到实验目的的是(
)
A
B
C
D
验证Na和水的反应是否为放热反应
用做喷泉实验
观察纯碱的焰色反应
比较、的稳定性
A.A
B.B
C.C
D.D
6.大胆、科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定没有意义的是(
)
A.探究SO2与Na2O2反应可能有Na2SO4生成
B.探究Na与水的反应可能有O2生成
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能有CuS
D.探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致
7.下列各种情况下,溶液中一定能大量存在的离子组是(
)
A.能使试纸变红的溶液:、、、、
B.含有大量的溶液:、、、
C.含有大量的溶液:、、、
D.加入铝粉后产生大量氢气的溶液:、、、
8.下表所列各组物质中,物质之间通过一步反应能实现如下图所示转化的是
X
Y
Z
①
Cu
CuO
②
③
Fe
④
NO
⑤
S
A.③④
B.④⑤
C.②③
D.①⑤
9.某澄清透明溶液中只可能含有①Al3+,②Mg2+,③Fe3+,④Fe2+,⑤H+,⑥CO32-,⑦NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是
A.⑤⑥⑦
B.②③⑤⑦
C.①②③⑥⑦
D.①②③④⑤⑦
10.实验室中的试纸种类很多、用途也比较广泛。下列试纸使用时不需要对试纸预先用蒸馏水润湿的是( )
A.用蓝色石蕊试纸检验氯化氢气体
B.用KI淀粉试纸检验氯气的存在
C.收集氨气时,用红色石蕊试纸检验是否收集满
D.用pH试纸检测稀盐酸溶液的pH
11.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品置于盛有足量水的烧杯中,充分搅拌后仍有部分固体存在,过滤后得到固体X与滤液Y;②将固体X置于稀硝酸中无明显变化;③取滤液Y少许滴加到NaOH溶液中有白色沉淀生成,则该白色粉末可能为(
)
A.Na2CO3、Al(OH)3
B.AgNO3、NH4Cl
C.MgSO4、BaCl2
D.CuCl2、Al(NO3)3
12.下列实验装置、选用的试剂或实验操作中,都正确的是
A.实验室用装置A制取氨气
B.用B装置吸收氨气,并防止倒吸
C.用C装置稀释浓硫酸
D.用D装置除去CO2中的HCl
13.下列反应中,改变反应物的用量或浓度,不会改变生成物的是
A.铜和硝酸反应
B.二氧化碳通入氢氧化钠溶液中
C.细铁丝在氯气中燃烧
D.氯化铝与氢氧化钠溶液反应
14.向27.2
g
Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5
L,固体物质完全反应,得到标准状况下8.96
L
NO和NO2的混合气体及Cu(NO3)2。在所得溶液中加入1.0
mol/L的NaOH溶液1.0
L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2
g。下列有关说法不正确的是
A.Cu和Cu2O的物质的量之比为2:1
B.硝酸的物质的量浓度为2.8
mol/L
C.产生的NO2的体积在标准状况下为2.24
L
D.原混合物中Cu元素的质量分数为94.1%
15.把含有某一氯化物杂质的氯化钙5.55克溶于水后,与足量的硝酸银溶液反应,生成的氯化银沉淀15克,则该杂质可能是
A.氯化钠
B.氯化钾
C.氯化铜
D.氯化铝
二、填空题
16.健康人体内含铁元素大约2~3g,人体内铁元素以亚铁离子和三价铁离子的形式存在,Fe2+易被吸收,所以给贫血者补充铁元素时,应补充含Fe2+的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
(1)试剂1的名称是__,试剂2的名称是__。
(2)加入新制氯水,溶液中发生反应的离子方程式是__。
(3)加入试剂2时溶液为淡红色说明“速力菲”中的Fe2+已部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有__性。
(4)不仅溶液中Fe2+易被氧化成Fe3+,溶液中白色沉淀Fe(OH)2更易被O2氧化,请写出反应的化学方程式___,现象为__。
17.化学来源于生活又服务于生活,请用化学用语回答下列问题:
(1)漂粉精中有效成分的化学式为:___________
(2)“硅材料”是无机非金属材料的主角,其中广泛应用于光导纤维的材料是:____________
(3)向浑浊的水中加入明矾KAl(SO4)2·12H2O后,水可得到净化。写出明矾在水中的电离方程式:___________。往明矾溶液中逐滴加入Ba(OH)2溶液,若使SO42-
恰好完全沉淀,发生反应的离子方程式为:___________;若使Al3+恰好完全沉淀,发生反应的离子方程式为:_____。
(4)饮用水中的NO3-对人类健康产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al
+
6NaNO3
+
4NaOH
=
10NaAlO2
+
3N2↑
+
2H2O
请回答下列问题:
①在化学方程式上用单线桥标出该反应中电子转移的方向和数目:____________
②上述反应中若生成标准状况下3.36LN2,则转移的电子数目为:_____________。
三、实验题
18.人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(1)实验室需要450
mL
0.02
mol/L酸性KMnO4标准溶液,现有仪器:①托盘天平②玻璃棒③药匙④烧杯⑤量筒,还需要__________玻璃仪器才能完成配制,需用托盘天平称量KMnO4固体__________g。
(2)下列操作会使配制的KMnO4溶液浓度偏大的是__________(填写编号,假设其他操作均正确)。
A
没有冷却至室温就转移液体到容量瓶并完成定容
B
将溶液移入容量瓶过程中有少量溶液溅出
C
使用容量瓶配制溶液,定容时,仰视刻度线
D
容量瓶刚用蒸馏水洗净,没有烘干就用来配制溶液
E
定容时,滴加蒸馏水,不慎加多高于刻度线,吸出少量水使凹液面最低点与刻度线相切
(3)测定血液样品中Ca2+的浓度:抽取血样20.0
mL,经过上述处理后得到草酸,再用0.020
mol/L
KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00
mL
KMnO4溶液。
①写出草酸与酸性KMnO4溶液反应的离子方程式______________。
②滴定终点时的现象是_________________。
③经过计算,血液样品中Ca2+的浓度为__________mg/cm3。
19.(1)实验室常用的几种气体发生装置如图A、B、C所示:
回答下列问题:
①若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的_____。
A.CO2
B.H2
C.Cl2
D.NH3
②D装置的小烧杯中应盛放NaOH溶液,目的是__________________。
③若要收集干净纯净的X气体,上述装置应如何改进____________________。
④若用B装置制取氨气可以用_________(填试剂名称)进行干燥。
(2)某化学兴趣小组为探究SO2的性质,按下图所示装置进行试验。
请回答下列问题:
①装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是_________、________。
②反应后,装置B中发生的现象是__________,装置D表现了SO2的_____性,装置E表现了SO2的_____性。
③F装置漏斗的作用是_____________。
④装置C中发生的离子方程式________________________________。
20.常温下,三硫代碳酸钠(Na2CS3)是玫瑰红色针状固体,与碳酸钠性质相近。在工农业生产中有广泛的用途。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验一:探究Na2CS3的性质
(1)向Na2CS3溶液中滴入酚酞试液,溶液变红色。用离子方程式说明溶液呈碱性的原因__。
(2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。该反应中被氧化的元素是__。
实验二:测定Na2CS3溶液的浓度
按如图所示连接好装置,取50.0mLNa2CS3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol·L-1稀H2SO4,关闭活塞。
已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,密度1.26g·mL-1,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放碱石灰的仪器的名称是__,碱石灰的主要成分是__(填化学式)。
(4)反应结束后打开活塞K,再缓慢通入热N2一段时间,其目的是_。
(5)C中发生反应的离子方程式是__。
(6)为了计算Na2CS3溶液的浓度,对充分反应后B中混合物进行过滤、洗涤、干燥、称重,得8.4g固体,则三颈瓶中Na2CS3的物质的量浓度为__。
(7)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值__(填“偏高”、“偏低”或“无影响”)。
参考答案
1.D2.C3.D4.D5.D6.B7.A8.A9.B10.D11.C12.B13.C14.C15.D
16.盐酸
KSCN
2Fe2++Cl2=2Fe3++2Cl-
还原
4Fe(OH)2+O2+2H2O=4Fe(OH)3
白色沉淀迅速变为灰绿色,最终变为红褐色
17.Ca(ClO)2
SiO2
KAl(SO4)2
=
K+
+
Al3+
+
2SO42-
2SO42-
+2Ba2++Al3++4OH-
=
2BaSO4↓
+
AlO2-+
2H2O
2Al3+
+
3Ba2+
+
6OH-
+
3SO42-
=
2Al(OH)3↓
+
3BaSO4↓
1.5NA
18.500?mL?容量瓶,胶头滴管
1.6
A
当滴入最后一滴酸性高锰酸钾溶液时,溶液恰好由无色变为紫红色,且半分钟内不褪色
1.2
19.C
尾气进行处理,防止污染环境
在装置A、
D之间增加一个盛有饱和食盐水的洗瓶
碱石灰(或CaO、Ca(OH)2等)
分液漏斗
圆底烧瓶
黄绿色逐渐变浅
氧化
漂白
防止倒吸
2MnO4-+5SO2+2H2O=5SO42-+2Mn2++4H+
20.CS32-+H2OHCS3-+OH-
S
干燥管
CaO和
NaOH
将装置中残留的CS2和H2S全部排入后续装置中,使其被完全吸收
CS2+2OH-=COS22-+H2O
1.75mol/L
偏高
同课章节目录
