高中化学新教材同步必修第二册 第5章 本章知识体系构建与核心素养提升
文档属性
| 名称 | 高中化学新教材同步必修第二册 第5章 本章知识体系构建与核心素养提升 |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-27 19:21:03 | ||
图片预览





文档简介
(共35张PPT)
本章知识体系构建与核心素养提升
第五章 化工生产中的重要非金属元素
内容索引
NEIRONGSUOYIN
知识体系构建
理清脉络
纲举目张
核心素养提升
理念渗透
贯穿始终
知识体系构建
ZHI
SHI
TI
XI
GOU
JIAN
01
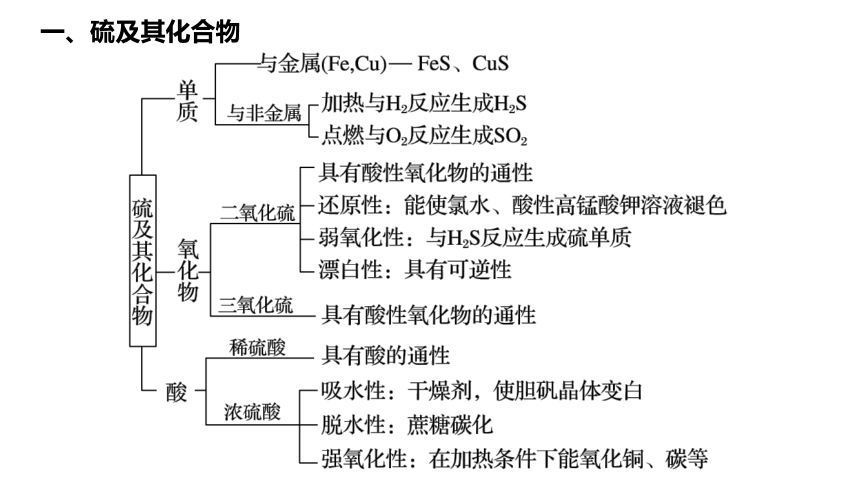
一、硫及其化合物
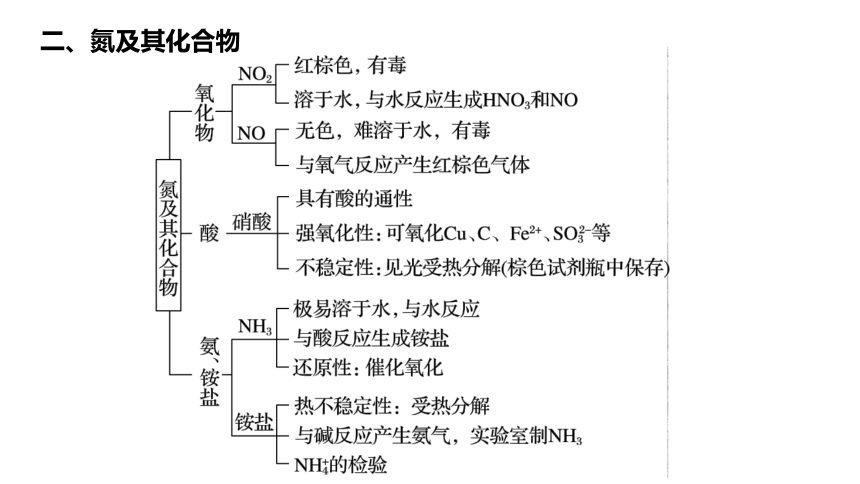
二、氮及其化合物
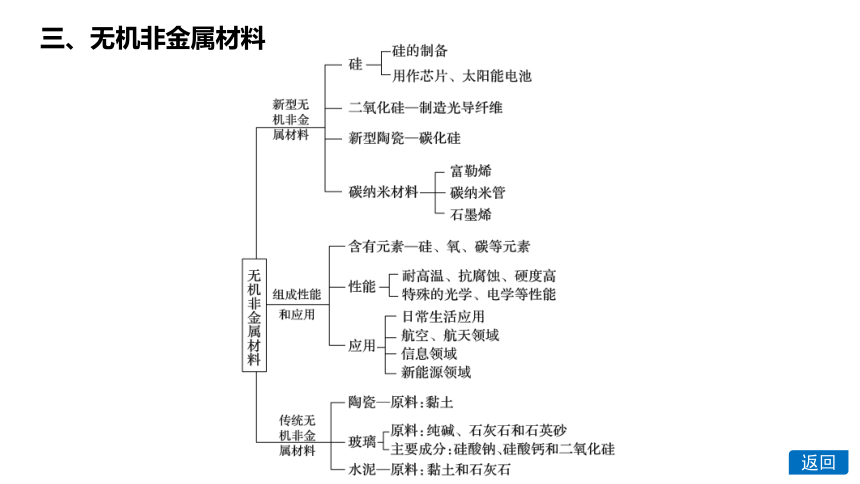
三、无机非金属材料
返回
02
核心素养提升
HE
XIN
SU
YANG
TI
SHENG
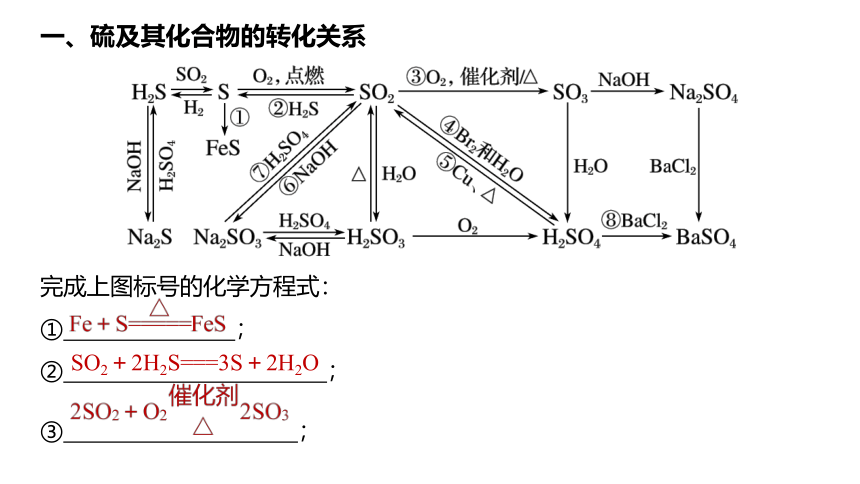
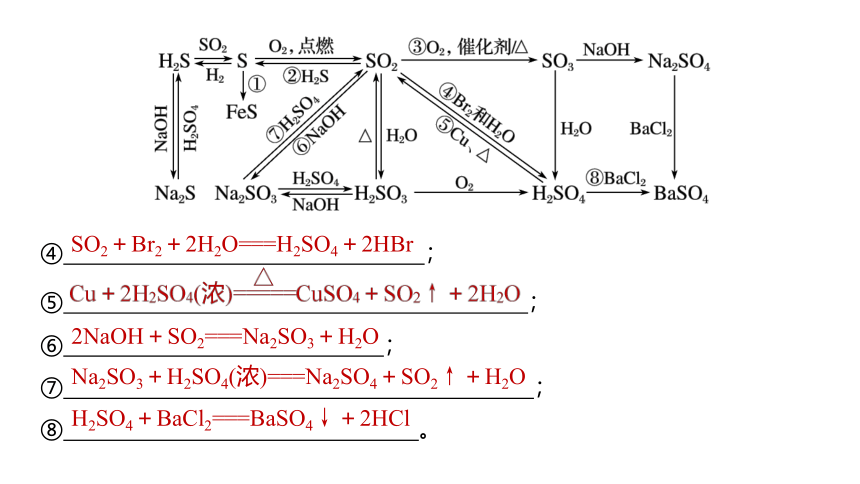
一、硫及其化合物的转化关系
完成上图标号的化学方程式:
①
;
②
;
③
;
SO2+2H2S===3S+2H2O
④
;
⑤
;
⑥
;
⑦
;
⑧
。
SO2+Br2+2H2O===H2SO4+2HBr
2NaOH+SO2===Na2SO3+H2O
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
H2SO4+BaCl2===BaSO4↓+2HCl
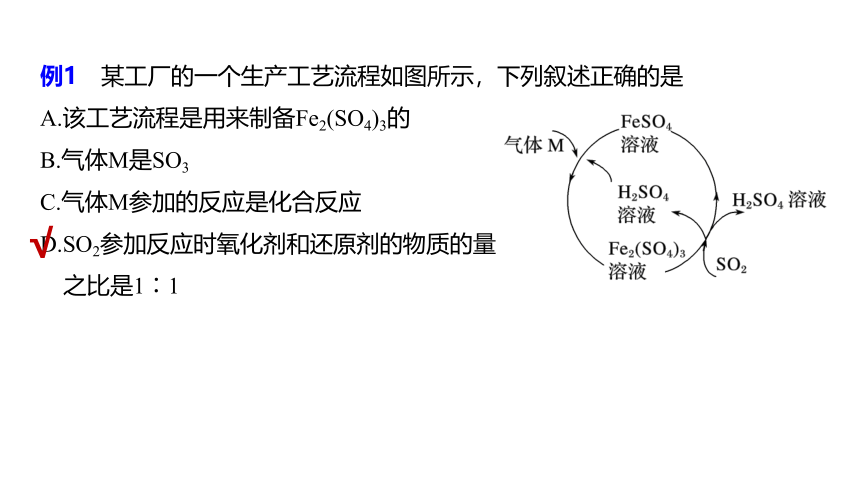
例1 某工厂的一个生产工艺流程如图所示,下列叙述正确的是
A.该工艺流程是用来制备Fe2(SO4)3的
B.气体M是SO3
C.气体M参加的反应是化合反应
D.SO2参加反应时氧化剂和还原剂的物质的量
之比是1∶1
√
解析 由工艺流程的箭头指向可知,该过程中硫酸亚铁和硫酸铁可循环使用,气体M和SO2为反应物,指向流程之外的箭头只有硫酸(部分硫酸又参与循环),即硫酸铁和二氧化硫作用生成硫酸和硫酸亚铁。气体M和硫酸、硫酸亚铁作用生成硫酸铁。根据上述分析知该工艺流程是用来制备硫酸的,A项错误;
根据反应关系知气体M、H2SO4和FeSO4作用生成Fe2(SO4)3,所以M是具有氧化性的气体,如O2等,B项错误;
气体M、FeSO4溶液和硫酸溶液作用生成Fe2(SO4)3,气体M参加的反应是氧化还原反应,C项错误;
SO2参加反应时的化学方程式为SO2+Fe2(SO4)3+2H2O===2FeSO4+2H2SO4,参加反应时氧化剂和还原剂的物质的量之比是1∶1,D项正确。
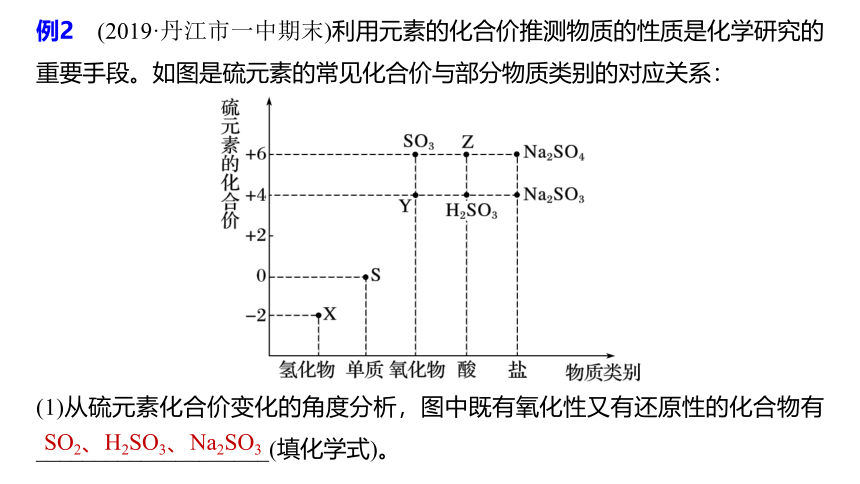
例2 (2019·丹江市一中期末)利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有____________________(填化学式)。
SO2、H2SO3、Na2SO3
解析 S元素的化合价有-2价、0价、+4价、+6价。
具有中间价态的元素既有还原性又有氧化性,所以化合物SO2、H2SO3、Na2SO3既有还原性又有氧化性。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为______。
解析 将H2S与SO2混合,SO2氧化H2S生成淡黄色沉淀S和水,反应的化学方程式为2H2S+SO2===3S+2H2O,则该反应的氧化剂SO2与还原剂H2S的物质的量之比为1∶2。
1∶2
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式
为________________________________________。
Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是____(填字母)。
a.Na2S+S
b.Na2SO3+S
c.SO2+Na2SO4
d.Na2SO3+Na2SO4
b
解析 Na2S2O3中S元素化合价为+2价,从氧化还原的角度分析,反应物中S元素化合价必须一种物质中的大于+2,另一种物质中的小于+2,选项a中S元素化合价都小于+2,选项c、d中S元素化合价都大于+2,所以只有选项b符合题意。
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24
mL
0.05
mol·L-1的Na2SO3溶液与20
mL
0.02
mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_____。
+3
解析 假设Cr元素在生成物中的化合价为+a价,根据电子转移守恒,则24×
10-3
L×0.05
mol·L-1×(6-4)=20×10-3
L×0.02
mol·L-1×2×(6-a),解得a=3。
二、氮及其化合物的转化关系
氮及其化合物的“价—类”二维图:
根据上图,写出下列反应的化学方程式:
(1)自然界中产生硝酸
①
(自然固氮);
②
;
③
。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
(2)工业上制备硝酸
①
(人工固氮);
②
;
③
;
④
。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
(3)硝酸在反应中只表现酸性
(其他合理答案也可)。
(4)浓硝酸在反应中只表现氧化性
。
2HNO3+Na2CO3===2NaNO3+CO2↑+H2O
(5)稀硝酸在反应中既表现氧化性,又表现酸性
。
(6)氯化铵与消石灰混合加热
。
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
例3 如图,根据图示回答:
(1)A的分子式为_____;B的分子式为____;C的分子式为_____。
(2)将E溶于水,配制成0.1
mol·L-1的溶液,滴入酚酞,显___色。
(3)写出NH4Cl溶液与NaOH溶液共热反应的离子方程式:__________________
____________。
(4)D―→B的化学方程式为__________________________________________。
NH3
NO
NO2
无
NH
+OH-
NH3↑+H2O
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
例4 氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
氨与二氧化氮的反应:将收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置(部分装置已略去)进行实验。
操作步骤
实验现象
解释原因
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中
(1)Y管中___________
_____________
(2)反应的化学方程式为________
________________________
将注射器活塞退回原处并固定,待装置恢复到室温
Y管中有少量水珠
生成的气态水凝聚
打开K2
(3)__________________________
(4)____________________________________________________
红棕色气体
颜色慢慢变浅
8NH3+
6NO2
7N2+12H2O
Z中NaOH溶液产生
倒吸现象
反应后气体分子数减少,Y管中气体压强小于外界大气压
解析 将X中NH3缓慢通入盛有少量催化剂和NO2的Y管中,在一定温度和催化剂条件下NH3将NO2还原生成N2,观察到Y管中气体的红棕色逐渐变浅,
反应的化学方程式为8NH3+6NO2
7N2+12H2O。反应过程中体系的
压强减小,打开K2,烧杯Z中NaOH溶液被倒吸到玻璃管Y中,其中NaOH溶
液用于吸收尾气,防止环境污染。
三、非金属及其化合物对环境的影响
通过本章学习,充分认识某些化学过程对人类健康和社会发展带来的双重影响,既了解硫、氮及其化合物和无机非金属材料对人类社会发展的贡献:如无机非金属材料在生活、生产、科技(航空、航天、信息、新能源等领域)有着广泛的应用;二氧化硫常用作漂白剂;工业上合成氨用于制造氮肥和生产硝酸;硫酸和硝酸都是重要的化工原料等。又熟知硫、氮及其化合物对环境的影响:工业生产和日常生活中大量使用化石燃料产生的二氧化硫、氮氧化物都是大气污染物,都能形成酸雨,严重威胁自然生态环境和人类生存环境,氮氧化物还是形成光化学烟雾、雾霾的重要原因;工业废水、生活污水、农业上过量使用氮肥、水产养殖使用饵料等,造成水体污染,使水体富营养化。
例5 为落实“五水共治”,某工厂拟综合处理含NH
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图所示流程:
下列说法不正确的是
A.固体1中主要含有Ca(OH)2、
CaCO3、CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含NH
废水时,发生反应的离子方程式为NH
+NO
===N2↑+2H2O
√
解析 A项,根据题中的流程,可以得出固体1为CaCO3、CaSO3和过量的Ca(OH)2的混合物,正确;
B项,气体1为N2、NO、CO的混合物,通入X,然后再与NaOH溶液反应生成的产物为NaNO2,若X为过量空气,则反应后的产物中没有NaNO2,这与题图流程不符,错误;
C项,气体2为N2、CO,因“无污染气体”为N2,故捕获的气体主要是CO,正确;
例6 气候条件独特,空气质量优良的新疆阿勒泰市,已成为我国第8个国家大气背景监测点。监测点安装的监测设备可日常监测二氧化硫、二氧化氮、一氧化氮等大气污染物。
(1)汽车尾气(含CO、SO2、NO等)是城市空气的污染源之一,治理方法之一是在汽车的排气管上装一个“催化转化器”(用铂、钯合金作催化剂),它能使一氧化碳跟一氧化氮反应生成可参与大气循环的无毒气体。
①汽车尾气中导致酸雨形成的主要物质是__________。
②请写出形成硝酸型酸雨的主要反应的化学方程式:____________________
__________________________。
SO2和NO
2NO+O2===2NO2、
3NO2+H2O===2HNO3+NO
③在汽车排气管上加装“催化转化器”,可使CO和NO反应产生可参与大气
循环的无毒气体,请写出该反应的化学方程式:__________________________。
2CO+2NO
2CO2+N2
解析 根据题给信息可知,CO与NO反应,生成的可参与大气循环的无毒气
体是CO2和N2,所以该反应的化学方程式为2CO+2NO
2CO2+N2。
④下列选项中,控制城市空气污染的合理措施有______(填字母)。
A.充分利用太阳能,减少化石燃料的燃烧
B.使用电动车,减少汽油消耗
C.禁止人们出行
D.带上呼吸面具
AB
(2)实验室里,处理含氮氧化物的尾气一般用NaOH溶液来吸收。
①若用NaOH溶液吸收NO2,可生成2种含氮元素的钠盐,请写出化学方程式:_____________________________________。
2NO2+2NaOH===NaNO3+H2O+NaNO2
解析 NO2与NaOH溶液反应生成的2种含氮的钠盐为NaNO2和NaNO3,化学方程式为2NO2+2NaOH===NaNO2+NaNO3+H2O。
②NO2和NO的混合气体也可用NaOH溶液吸收,只生成一种盐,请写出化学方程式:__________________________________。
NO+NO2+2NaOH===2NaNO2+H2O
解析 NO2(N元素+4价)、NO(N元素+2价)与NaOH溶液反应只生成一种盐,根据氧化还原反应规律,可知该盐为NaNO2(N元素+3价),化学方程式为NO+NO2+2NaOH===2NaNO2+H2O。
返回
本章知识体系构建与核心素养提升
第五章 化工生产中的重要非金属元素
内容索引
NEIRONGSUOYIN
知识体系构建
理清脉络
纲举目张
核心素养提升
理念渗透
贯穿始终
知识体系构建
ZHI
SHI
TI
XI
GOU
JIAN
01
一、硫及其化合物
二、氮及其化合物
三、无机非金属材料
返回
02
核心素养提升
HE
XIN
SU
YANG
TI
SHENG
一、硫及其化合物的转化关系
完成上图标号的化学方程式:
①
;
②
;
③
;
SO2+2H2S===3S+2H2O
④
;
⑤
;
⑥
;
⑦
;
⑧
。
SO2+Br2+2H2O===H2SO4+2HBr
2NaOH+SO2===Na2SO3+H2O
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
H2SO4+BaCl2===BaSO4↓+2HCl
例1 某工厂的一个生产工艺流程如图所示,下列叙述正确的是
A.该工艺流程是用来制备Fe2(SO4)3的
B.气体M是SO3
C.气体M参加的反应是化合反应
D.SO2参加反应时氧化剂和还原剂的物质的量
之比是1∶1
√
解析 由工艺流程的箭头指向可知,该过程中硫酸亚铁和硫酸铁可循环使用,气体M和SO2为反应物,指向流程之外的箭头只有硫酸(部分硫酸又参与循环),即硫酸铁和二氧化硫作用生成硫酸和硫酸亚铁。气体M和硫酸、硫酸亚铁作用生成硫酸铁。根据上述分析知该工艺流程是用来制备硫酸的,A项错误;
根据反应关系知气体M、H2SO4和FeSO4作用生成Fe2(SO4)3,所以M是具有氧化性的气体,如O2等,B项错误;
气体M、FeSO4溶液和硫酸溶液作用生成Fe2(SO4)3,气体M参加的反应是氧化还原反应,C项错误;
SO2参加反应时的化学方程式为SO2+Fe2(SO4)3+2H2O===2FeSO4+2H2SO4,参加反应时氧化剂和还原剂的物质的量之比是1∶1,D项正确。
例2 (2019·丹江市一中期末)利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有____________________(填化学式)。
SO2、H2SO3、Na2SO3
解析 S元素的化合价有-2价、0价、+4价、+6价。
具有中间价态的元素既有还原性又有氧化性,所以化合物SO2、H2SO3、Na2SO3既有还原性又有氧化性。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为______。
解析 将H2S与SO2混合,SO2氧化H2S生成淡黄色沉淀S和水,反应的化学方程式为2H2S+SO2===3S+2H2O,则该反应的氧化剂SO2与还原剂H2S的物质的量之比为1∶2。
1∶2
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式
为________________________________________。
Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是____(填字母)。
a.Na2S+S
b.Na2SO3+S
c.SO2+Na2SO4
d.Na2SO3+Na2SO4
b
解析 Na2S2O3中S元素化合价为+2价,从氧化还原的角度分析,反应物中S元素化合价必须一种物质中的大于+2,另一种物质中的小于+2,选项a中S元素化合价都小于+2,选项c、d中S元素化合价都大于+2,所以只有选项b符合题意。
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24
mL
0.05
mol·L-1的Na2SO3溶液与20
mL
0.02
mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_____。
+3
解析 假设Cr元素在生成物中的化合价为+a价,根据电子转移守恒,则24×
10-3
L×0.05
mol·L-1×(6-4)=20×10-3
L×0.02
mol·L-1×2×(6-a),解得a=3。
二、氮及其化合物的转化关系
氮及其化合物的“价—类”二维图:
根据上图,写出下列反应的化学方程式:
(1)自然界中产生硝酸
①
(自然固氮);
②
;
③
。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
(2)工业上制备硝酸
①
(人工固氮);
②
;
③
;
④
。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
(3)硝酸在反应中只表现酸性
(其他合理答案也可)。
(4)浓硝酸在反应中只表现氧化性
。
2HNO3+Na2CO3===2NaNO3+CO2↑+H2O
(5)稀硝酸在反应中既表现氧化性,又表现酸性
。
(6)氯化铵与消石灰混合加热
。
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
例3 如图,根据图示回答:
(1)A的分子式为_____;B的分子式为____;C的分子式为_____。
(2)将E溶于水,配制成0.1
mol·L-1的溶液,滴入酚酞,显___色。
(3)写出NH4Cl溶液与NaOH溶液共热反应的离子方程式:__________________
____________。
(4)D―→B的化学方程式为__________________________________________。
NH3
NO
NO2
无
NH
+OH-
NH3↑+H2O
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
例4 氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
氨与二氧化氮的反应:将收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置(部分装置已略去)进行实验。
操作步骤
实验现象
解释原因
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中
(1)Y管中___________
_____________
(2)反应的化学方程式为________
________________________
将注射器活塞退回原处并固定,待装置恢复到室温
Y管中有少量水珠
生成的气态水凝聚
打开K2
(3)__________________________
(4)____________________________________________________
红棕色气体
颜色慢慢变浅
8NH3+
6NO2
7N2+12H2O
Z中NaOH溶液产生
倒吸现象
反应后气体分子数减少,Y管中气体压强小于外界大气压
解析 将X中NH3缓慢通入盛有少量催化剂和NO2的Y管中,在一定温度和催化剂条件下NH3将NO2还原生成N2,观察到Y管中气体的红棕色逐渐变浅,
反应的化学方程式为8NH3+6NO2
7N2+12H2O。反应过程中体系的
压强减小,打开K2,烧杯Z中NaOH溶液被倒吸到玻璃管Y中,其中NaOH溶
液用于吸收尾气,防止环境污染。
三、非金属及其化合物对环境的影响
通过本章学习,充分认识某些化学过程对人类健康和社会发展带来的双重影响,既了解硫、氮及其化合物和无机非金属材料对人类社会发展的贡献:如无机非金属材料在生活、生产、科技(航空、航天、信息、新能源等领域)有着广泛的应用;二氧化硫常用作漂白剂;工业上合成氨用于制造氮肥和生产硝酸;硫酸和硝酸都是重要的化工原料等。又熟知硫、氮及其化合物对环境的影响:工业生产和日常生活中大量使用化石燃料产生的二氧化硫、氮氧化物都是大气污染物,都能形成酸雨,严重威胁自然生态环境和人类生存环境,氮氧化物还是形成光化学烟雾、雾霾的重要原因;工业废水、生活污水、农业上过量使用氮肥、水产养殖使用饵料等,造成水体污染,使水体富营养化。
例5 为落实“五水共治”,某工厂拟综合处理含NH
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图所示流程:
下列说法不正确的是
A.固体1中主要含有Ca(OH)2、
CaCO3、CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含NH
废水时,发生反应的离子方程式为NH
+NO
===N2↑+2H2O
√
解析 A项,根据题中的流程,可以得出固体1为CaCO3、CaSO3和过量的Ca(OH)2的混合物,正确;
B项,气体1为N2、NO、CO的混合物,通入X,然后再与NaOH溶液反应生成的产物为NaNO2,若X为过量空气,则反应后的产物中没有NaNO2,这与题图流程不符,错误;
C项,气体2为N2、CO,因“无污染气体”为N2,故捕获的气体主要是CO,正确;
例6 气候条件独特,空气质量优良的新疆阿勒泰市,已成为我国第8个国家大气背景监测点。监测点安装的监测设备可日常监测二氧化硫、二氧化氮、一氧化氮等大气污染物。
(1)汽车尾气(含CO、SO2、NO等)是城市空气的污染源之一,治理方法之一是在汽车的排气管上装一个“催化转化器”(用铂、钯合金作催化剂),它能使一氧化碳跟一氧化氮反应生成可参与大气循环的无毒气体。
①汽车尾气中导致酸雨形成的主要物质是__________。
②请写出形成硝酸型酸雨的主要反应的化学方程式:____________________
__________________________。
SO2和NO
2NO+O2===2NO2、
3NO2+H2O===2HNO3+NO
③在汽车排气管上加装“催化转化器”,可使CO和NO反应产生可参与大气
循环的无毒气体,请写出该反应的化学方程式:__________________________。
2CO+2NO
2CO2+N2
解析 根据题给信息可知,CO与NO反应,生成的可参与大气循环的无毒气
体是CO2和N2,所以该反应的化学方程式为2CO+2NO
2CO2+N2。
④下列选项中,控制城市空气污染的合理措施有______(填字母)。
A.充分利用太阳能,减少化石燃料的燃烧
B.使用电动车,减少汽油消耗
C.禁止人们出行
D.带上呼吸面具
AB
(2)实验室里,处理含氮氧化物的尾气一般用NaOH溶液来吸收。
①若用NaOH溶液吸收NO2,可生成2种含氮元素的钠盐,请写出化学方程式:_____________________________________。
2NO2+2NaOH===NaNO3+H2O+NaNO2
解析 NO2与NaOH溶液反应生成的2种含氮的钠盐为NaNO2和NaNO3,化学方程式为2NO2+2NaOH===NaNO2+NaNO3+H2O。
②NO2和NO的混合气体也可用NaOH溶液吸收,只生成一种盐,请写出化学方程式:__________________________________。
NO+NO2+2NaOH===2NaNO2+H2O
解析 NO2(N元素+4价)、NO(N元素+2价)与NaOH溶液反应只生成一种盐,根据氧化还原反应规律,可知该盐为NaNO2(N元素+3价),化学方程式为NO+NO2+2NaOH===2NaNO2+H2O。
返回
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
