初中化学沪教版(全国)九年级上册第五章金属的冶炼与利用单元训练
文档属性
| 名称 | 初中化学沪教版(全国)九年级上册第五章金属的冶炼与利用单元训练 |  | |
| 格式 | docx | ||
| 文件大小 | 149.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-26 21:42:03 | ||
图片预览

文档简介
初中化学沪教版(全国)九年级上册第五章金属的冶炼与利用单元训练
一、单选题
1.已部分变质的Ca(OH)2固体试样10g,与足量稀盐酸反应,产生2.2gCO2,则该固体试样中Ca(OH)2的质量分数为
A.30%
B.40%
C.50%
D.60%
2.ClO2是一种高效的水处理剂,其制备反应为:2NaClO3+SO2+H2SO4=2ClO2+2X,下列说法错误的是
A.SO2的名称为二氧化硫
B.该反应属于置换反应
C.X的化学式是NaHSO4
D.ClO2中氯、氧元素的质量比为71:64
3.下列关于金属材料的说法中,不正确的是
A.生铁、硬铝、焊锡都属于合金
B.铜有良好的导电性,因而大量用于制作电线
C.铝表面易生成致密氧化铝薄膜,因而具有良好的抗腐蚀性
D.锈蚀后的铁制品没有回收价值
4.84
消毒液(主要成分为次氯酸钠
NaClO)可用于物体表面和环境消毒。用钛、石墨等作电极组装简易装置电解食盐水可制备次氯酸钠,能起到一定的应急作用,化学方程式可表示为:NaCl+H2ONaClO+X,下列说法正确的是
A.X
的化学式为
H2
B.反应前后只有一种元素的化合价发生改变
C.该反应为置换反应
D.84
消毒液无需稀释可直接使用
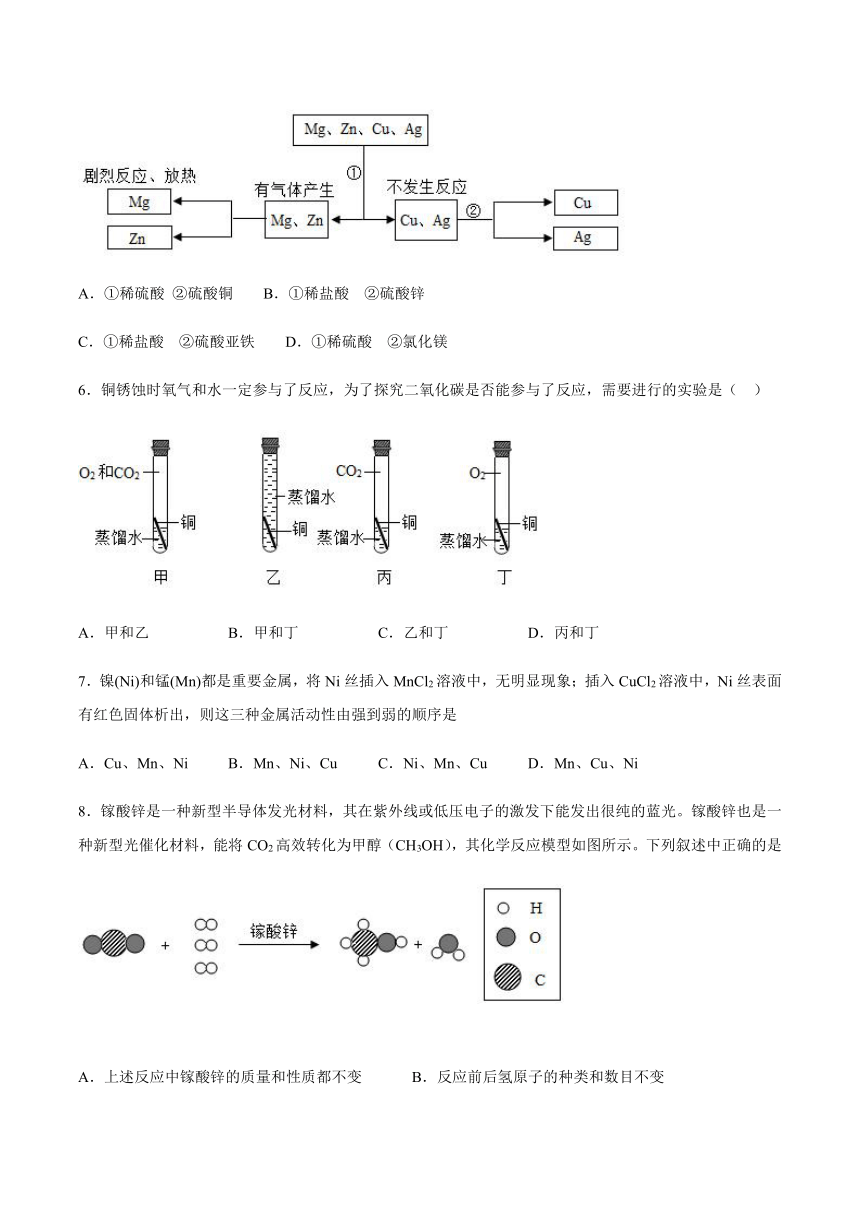
5.某同学为探究镁、锌、铜、银的活动性顺序,设计如图试验流程:依据流程设计,下面对物质①②的选择合理的是(______)
A.①稀硫酸
②硫酸铜
B.①稀盐酸
②硫酸锌
C.①稀盐酸
②硫酸亚铁
D.①稀硫酸
②氯化镁
6.铜锈蚀时氧气和水一定参与了反应,为了探究二氧化碳是否能参与了反应,需要进行的实验是(
)
A.甲和乙
B.甲和丁
C.乙和丁
D.丙和丁
7.镍(Ni)和锰(Mn)都是重要金属,将Ni丝插入MnCl2溶液中,无明显现象;插入CuCl2溶液中,Ni丝表面有红色固体析出,则这三种金属活动性由强到弱的顺序是
A.Cu、Mn、Ni
B.Mn、Ni、Cu
C.Ni、Mn、Cu
D.Mn、Cu、Ni
8.镓酸锌是一种新型半导体发光材料,其在紫外线或低压电子的激发下能发出很纯的蓝光。镓酸锌也是一种新型光催化材料,能将CO2高效转化为甲醇(CH3OH),其化学反应模型如图所示。下列叙述中正确的是
A.上述反应中镓酸锌的质量和性质都不变
B.反应前后氢原子的种类和数目不变
C.反应前后分子总数不变
D.该反应属于置换反应的
9.往AgNO3、Cu(NO3)2和Mg(NO3)2的混合溶液中加入一定量的铁粉,充分反应后溶液中肯定含有的溶质是
A.AgNO3、Cu(NO3)2和Mg(NO3)2
B.Cu(NO3)2、Mg(NO3)2和
Fe(NO3)2
C.Fe(NO3)2和Mg(NO3)2
D.Cu(NO3)2和
Fe(NO3)2
10.地质考察人员发现一种矿石,研究时发现它能在氧气中燃烧,主要反应是4X+11O22Fe2O3+8SO2.下列有关说法中不正确的是( )
A.X的化学式是FeS2
B.该反应属于置换反应
C.反应前后氧元素的化合价发生改变
D.Fe2O3中铁元素的质量分数为70%
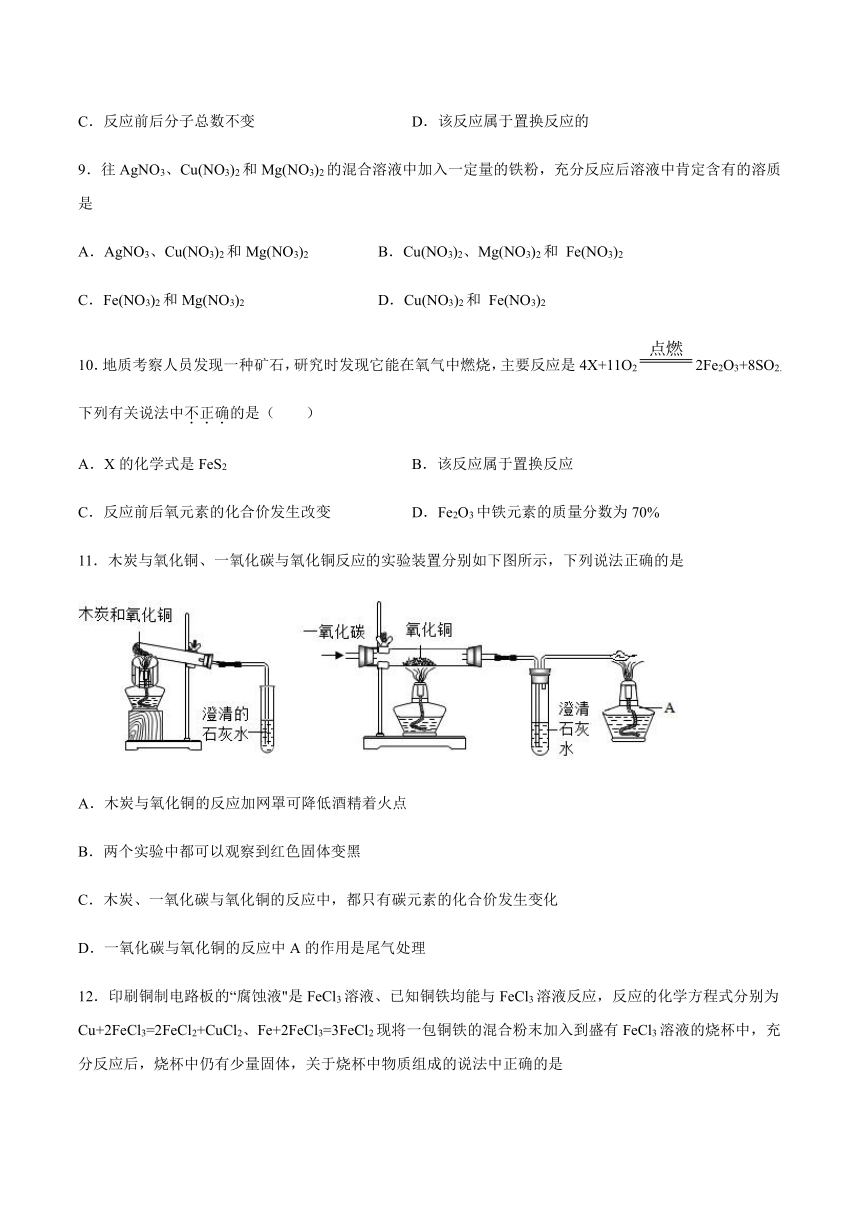
11.木炭与氧化铜、一氧化碳与氧化铜反应的实验装置分别如下图所示,下列说法正确的是
A.木炭与氧化铜的反应加网罩可降低酒精着火点
B.两个实验中都可以观察到红色固体变黑
C.木炭、一氧化碳与氧化铜的反应中,都只有碳元素的化合价发生变化
D.一氧化碳与氧化铜的反应中A的作用是尾气处理
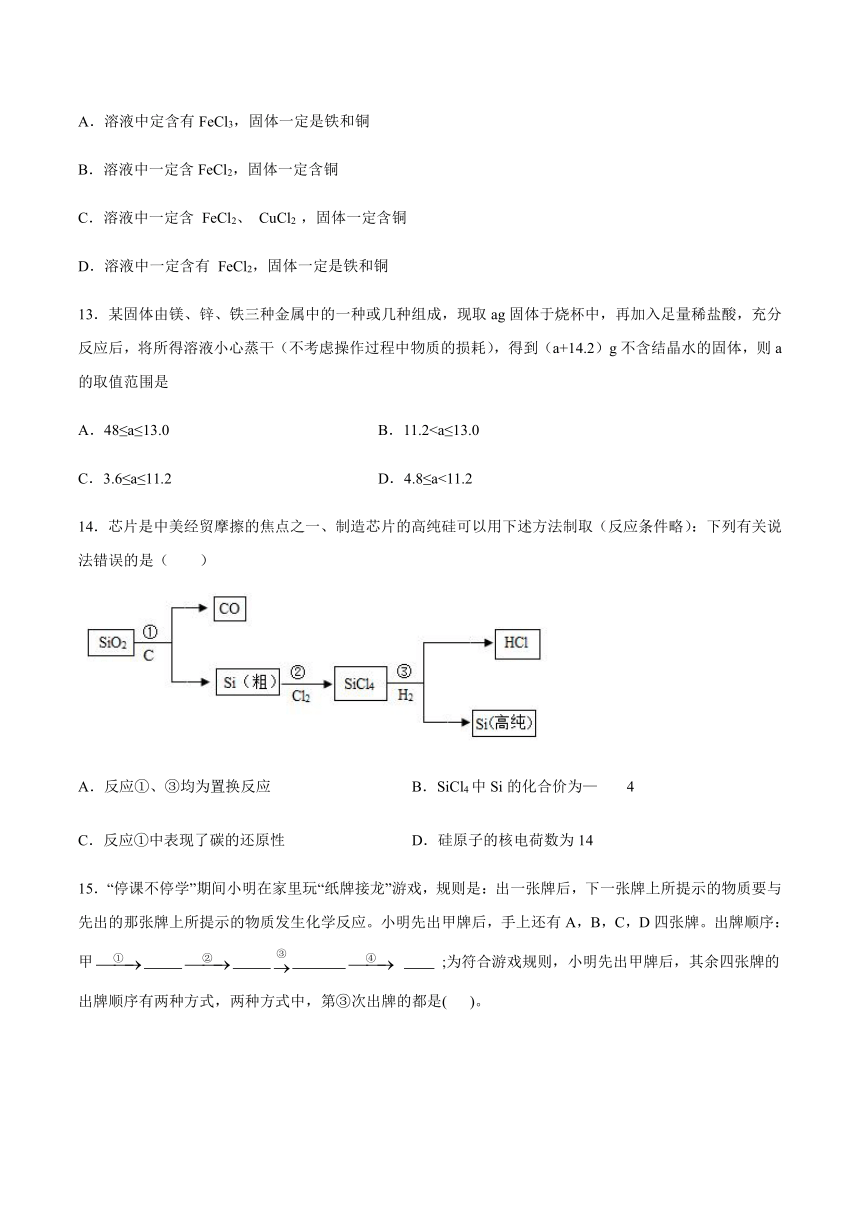
12.印刷铜制电路板的“腐蚀液"是FeCl3溶液、已知铜铁均能与FeCl3溶液反应,反应的化学方程式分别为Cu+2FeCl3=2FeCl2+CuCl2、Fe+2FeCl3=3FeCl2现将一包铜铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后,烧杯中仍有少量固体,关于烧杯中物质组成的说法中正确的是
A.溶液中定含有FeCl3,固体一定是铁和铜
B.溶液中一定含FeCl2,固体一定含铜
C.溶液中一定含
FeCl2、
CuCl2
,固体一定含铜
D.溶液中一定含有
FeCl2,固体一定是铁和铜
13.某固体由镁、锌、铁三种金属中的一种或几种组成,现取ag固体于烧杯中,再加入足量稀盐酸,充分反应后,将所得溶液小心蒸干(不考虑操作过程中物质的损耗),得到(a+14.2)g不含结晶水的固体,则a的取值范围是
A.48≤a≤13.0
B.11.2C.3.6≤a≤11.2
D.4.8≤a<11.2
14.芯片是中美经贸摩擦的焦点之一、制造芯片的高纯硅可以用下述方法制取(反应条件略):下列有关说法错误的是( )
A.反应①、③均为置换反应
B.SiCl4中Si的化合价为—4
C.反应①中表现了碳的还原性
D.硅原子的核电荷数为14
15.“停课不停学”期间小明在家里玩“纸牌接龙”游戏,规则是:出一张牌后,下一张牌上所提示的物质要与先出的那张牌上所提示的物质发生化学反应。小明先出甲牌后,手上还有A,B,C,D四张牌。出牌顺序:甲
;为符合游戏规则,小明先出甲牌后,其余四张牌的出牌顺序有两种方式,两种方式中,第③次出牌的都是(
)。
A.A
B.B
C.C
D.D
16.金属钛(Ti)被誉为21世纪最有前途的金属,被广泛应用于各行各业。已知。为探究钛、银、铜的金属活动性强弱,选取的下列各组试剂中正确的是()
①钛、银、铜、稀盐酸②银、钛、硫酸铜溶液③银、铜、氯化钛溶液④铜、硝酸银溶液、氯化钛溶液
A.①②
B.②③
C.②④
D.③④
二、填空题
17.兴趣小组同学做了“电池+口香糖铝箔纸(铝箔纸是在纸的表面涂上一层铝箔)”的取火实验:用一段两头宽、中间窄的口香糖铝箔纸接在电池的正负极(如图所示),随即铝箔纸燃烧起来,回答下列问题:
(1)电池是将______转化为电能的装置。
(2)该实验说明铝的物理性质有______。
A密度大
B硬度大
C导电性好
(3)铝箔纸接入电路后短路起火,从燃烧条件看“短路”的作用是______。
(4)铝箱纸燃烧时,纸(主要成分为纤维素)完全燃烧的产物是H2O和______。铝发生反应的化学方程式是______。
18.在催化剂并加热的条件下,A与B反应生成C和D,反应前后分子变化的微观示意图如下所示:
①下列说法正确的是______(填字母序号);
A该反应类型为置换反应
B4种物质中只有D属于氧化物
C反应前后,氮元素化合价升高
D化学反应中分子可以再分,而原子不能
②该反应的化学方程式为______。
19.化学与人类生活息息相关,回答下列问题:
(1)自来水厂常利用_____的吸附性除去水中异味;
(2)饮用硬度过大的水不利于人身体键康,在生活中可用_____区分硬水和软水;常用__的方法降低水的硬度,并起到消毒杀的作用。
(3)生活中常用铁锅做饭,主要利用了铁的______性。
(4)厨房中铁锅容易生锈,结合生活实际,写出一种防止铁锅生锈的具体方法:______。
(5)某钢铁厂采用赤铁矿(主要成分为Fe2O3)炼铁,若该厂日产含铁1.4×104t的生铁,至少需要含Fe2O380%的亦铁矿的质量是_____t。
20.金属钨(W)可做灯泡的灯丝,钨合金材料非常坚硬和耐磨、耐热,用黑钨矿(含有FeWO4)与Na2CO3混合在空气中焙烧可以得到Na2WO4,N2WO4与热的浓盐酸反应生成不溶于水的钨酸(H2WO4),H2WO4受热分解生成H2O和WO3。
(1)钨合金材料属于________(填“纯净物”或“混合物”),H2WO4中钨元素的化合价为_________。
(2)Na2WO4与热的浓盐酸反应的化学方程式为________________。
三、综合应用题
21.铝是生活中常见的金属。
(1)金属铝常用做导线是利用它的_____性;
(2)金属铝表面常有一层致密的氧化膜,氧化膜主要成分是______
(填名称或化学式)
(3)19世纪初,铝的发现得益于电解技术的应用。下图为用铝土矿炼制铝的生产流程。
现有含Al2O351%的铝土矿200t,经上述反应后可制得铝_____t(假设上述各步反应中,铝元素一共损失10%。计算结果精确到小数点后一位)。
22.小明和小英要验证一块石头是否含碳酸钙。
(1)小明说:“只要取一小块石头放在烧杯中,再在石块上倒入盐酸,发现有大量气泡产生,就能证明石块含有碳酸钙。”小英说:“在石块上倒盐酸,产生的大量气泡是盐酸挥发而成的。”小英的说法对吗?_______(填“对”或“不对”)。
(2)小明和小英带着问题请教王老师,在王老师的指导下,进行了下列实验探究,其实验过程如下:①取一小块石块置于烧杯中,滴加盐酸后,发现产生了无色无味气体;②在老师的指导下,取①中的溶液检验,石块中含有钙元素;③他们又设计了如图所示的实验装置,在实验中观察到广口瓶中有浑浊现象产生。
在上述实验中,他们进行的是_______实验研究(填“定性”或“定量”)。
(3)假若称取10.0
g石块与足量的稀盐酸反应(杂质不与盐酸反应),并用饱和石灰水吸收,得到的沉淀经适当处理后得干燥固体7.5
g。计算:
①石块中含碳酸钙的质量分数_______________;
②已知CO2在标准状况下的密度为1.98
g/L,则生成标准状况下CO2气体的体积为______________毫升?
参考答案
1.C2.B3.D4.A5.A6.B7.B8.B9.C10.B11.D12.B13.A14.B15.B16.C
17.化学
C
使铝箔纸温度达到着火点
CO2
18.CD
19.活性炭
肥皂水
煮沸
导热
将铁锅洗净擦干(或者涂一层油)
2.5×104t
20.混合物
+6
21.导电性
三氧化二铝(或Al2O3)
设反应后可制得铝的质量为x。
x=60t
答:反应后可制得铝60t。
不对
定性
75%
1667
mL
一、单选题
1.已部分变质的Ca(OH)2固体试样10g,与足量稀盐酸反应,产生2.2gCO2,则该固体试样中Ca(OH)2的质量分数为
A.30%
B.40%
C.50%
D.60%
2.ClO2是一种高效的水处理剂,其制备反应为:2NaClO3+SO2+H2SO4=2ClO2+2X,下列说法错误的是
A.SO2的名称为二氧化硫
B.该反应属于置换反应
C.X的化学式是NaHSO4
D.ClO2中氯、氧元素的质量比为71:64
3.下列关于金属材料的说法中,不正确的是
A.生铁、硬铝、焊锡都属于合金
B.铜有良好的导电性,因而大量用于制作电线
C.铝表面易生成致密氧化铝薄膜,因而具有良好的抗腐蚀性
D.锈蚀后的铁制品没有回收价值
4.84
消毒液(主要成分为次氯酸钠
NaClO)可用于物体表面和环境消毒。用钛、石墨等作电极组装简易装置电解食盐水可制备次氯酸钠,能起到一定的应急作用,化学方程式可表示为:NaCl+H2ONaClO+X,下列说法正确的是
A.X
的化学式为
H2
B.反应前后只有一种元素的化合价发生改变
C.该反应为置换反应
D.84
消毒液无需稀释可直接使用
5.某同学为探究镁、锌、铜、银的活动性顺序,设计如图试验流程:依据流程设计,下面对物质①②的选择合理的是(______)
A.①稀硫酸
②硫酸铜
B.①稀盐酸
②硫酸锌
C.①稀盐酸
②硫酸亚铁
D.①稀硫酸
②氯化镁
6.铜锈蚀时氧气和水一定参与了反应,为了探究二氧化碳是否能参与了反应,需要进行的实验是(
)
A.甲和乙
B.甲和丁
C.乙和丁
D.丙和丁
7.镍(Ni)和锰(Mn)都是重要金属,将Ni丝插入MnCl2溶液中,无明显现象;插入CuCl2溶液中,Ni丝表面有红色固体析出,则这三种金属活动性由强到弱的顺序是
A.Cu、Mn、Ni
B.Mn、Ni、Cu
C.Ni、Mn、Cu
D.Mn、Cu、Ni
8.镓酸锌是一种新型半导体发光材料,其在紫外线或低压电子的激发下能发出很纯的蓝光。镓酸锌也是一种新型光催化材料,能将CO2高效转化为甲醇(CH3OH),其化学反应模型如图所示。下列叙述中正确的是
A.上述反应中镓酸锌的质量和性质都不变
B.反应前后氢原子的种类和数目不变
C.反应前后分子总数不变
D.该反应属于置换反应的
9.往AgNO3、Cu(NO3)2和Mg(NO3)2的混合溶液中加入一定量的铁粉,充分反应后溶液中肯定含有的溶质是
A.AgNO3、Cu(NO3)2和Mg(NO3)2
B.Cu(NO3)2、Mg(NO3)2和
Fe(NO3)2
C.Fe(NO3)2和Mg(NO3)2
D.Cu(NO3)2和
Fe(NO3)2
10.地质考察人员发现一种矿石,研究时发现它能在氧气中燃烧,主要反应是4X+11O22Fe2O3+8SO2.下列有关说法中不正确的是( )
A.X的化学式是FeS2
B.该反应属于置换反应
C.反应前后氧元素的化合价发生改变
D.Fe2O3中铁元素的质量分数为70%
11.木炭与氧化铜、一氧化碳与氧化铜反应的实验装置分别如下图所示,下列说法正确的是
A.木炭与氧化铜的反应加网罩可降低酒精着火点
B.两个实验中都可以观察到红色固体变黑
C.木炭、一氧化碳与氧化铜的反应中,都只有碳元素的化合价发生变化
D.一氧化碳与氧化铜的反应中A的作用是尾气处理
12.印刷铜制电路板的“腐蚀液"是FeCl3溶液、已知铜铁均能与FeCl3溶液反应,反应的化学方程式分别为Cu+2FeCl3=2FeCl2+CuCl2、Fe+2FeCl3=3FeCl2现将一包铜铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后,烧杯中仍有少量固体,关于烧杯中物质组成的说法中正确的是
A.溶液中定含有FeCl3,固体一定是铁和铜
B.溶液中一定含FeCl2,固体一定含铜
C.溶液中一定含
FeCl2、
CuCl2
,固体一定含铜
D.溶液中一定含有
FeCl2,固体一定是铁和铜
13.某固体由镁、锌、铁三种金属中的一种或几种组成,现取ag固体于烧杯中,再加入足量稀盐酸,充分反应后,将所得溶液小心蒸干(不考虑操作过程中物质的损耗),得到(a+14.2)g不含结晶水的固体,则a的取值范围是
A.48≤a≤13.0
B.11.2
D.4.8≤a<11.2
14.芯片是中美经贸摩擦的焦点之一、制造芯片的高纯硅可以用下述方法制取(反应条件略):下列有关说法错误的是( )
A.反应①、③均为置换反应
B.SiCl4中Si的化合价为—4
C.反应①中表现了碳的还原性
D.硅原子的核电荷数为14
15.“停课不停学”期间小明在家里玩“纸牌接龙”游戏,规则是:出一张牌后,下一张牌上所提示的物质要与先出的那张牌上所提示的物质发生化学反应。小明先出甲牌后,手上还有A,B,C,D四张牌。出牌顺序:甲
;为符合游戏规则,小明先出甲牌后,其余四张牌的出牌顺序有两种方式,两种方式中,第③次出牌的都是(
)。
A.A
B.B
C.C
D.D
16.金属钛(Ti)被誉为21世纪最有前途的金属,被广泛应用于各行各业。已知。为探究钛、银、铜的金属活动性强弱,选取的下列各组试剂中正确的是()
①钛、银、铜、稀盐酸②银、钛、硫酸铜溶液③银、铜、氯化钛溶液④铜、硝酸银溶液、氯化钛溶液
A.①②
B.②③
C.②④
D.③④
二、填空题
17.兴趣小组同学做了“电池+口香糖铝箔纸(铝箔纸是在纸的表面涂上一层铝箔)”的取火实验:用一段两头宽、中间窄的口香糖铝箔纸接在电池的正负极(如图所示),随即铝箔纸燃烧起来,回答下列问题:
(1)电池是将______转化为电能的装置。
(2)该实验说明铝的物理性质有______。
A密度大
B硬度大
C导电性好
(3)铝箔纸接入电路后短路起火,从燃烧条件看“短路”的作用是______。
(4)铝箱纸燃烧时,纸(主要成分为纤维素)完全燃烧的产物是H2O和______。铝发生反应的化学方程式是______。
18.在催化剂并加热的条件下,A与B反应生成C和D,反应前后分子变化的微观示意图如下所示:
①下列说法正确的是______(填字母序号);
A该反应类型为置换反应
B4种物质中只有D属于氧化物
C反应前后,氮元素化合价升高
D化学反应中分子可以再分,而原子不能
②该反应的化学方程式为______。
19.化学与人类生活息息相关,回答下列问题:
(1)自来水厂常利用_____的吸附性除去水中异味;
(2)饮用硬度过大的水不利于人身体键康,在生活中可用_____区分硬水和软水;常用__的方法降低水的硬度,并起到消毒杀的作用。
(3)生活中常用铁锅做饭,主要利用了铁的______性。
(4)厨房中铁锅容易生锈,结合生活实际,写出一种防止铁锅生锈的具体方法:______。
(5)某钢铁厂采用赤铁矿(主要成分为Fe2O3)炼铁,若该厂日产含铁1.4×104t的生铁,至少需要含Fe2O380%的亦铁矿的质量是_____t。
20.金属钨(W)可做灯泡的灯丝,钨合金材料非常坚硬和耐磨、耐热,用黑钨矿(含有FeWO4)与Na2CO3混合在空气中焙烧可以得到Na2WO4,N2WO4与热的浓盐酸反应生成不溶于水的钨酸(H2WO4),H2WO4受热分解生成H2O和WO3。
(1)钨合金材料属于________(填“纯净物”或“混合物”),H2WO4中钨元素的化合价为_________。
(2)Na2WO4与热的浓盐酸反应的化学方程式为________________。
三、综合应用题
21.铝是生活中常见的金属。
(1)金属铝常用做导线是利用它的_____性;
(2)金属铝表面常有一层致密的氧化膜,氧化膜主要成分是______
(填名称或化学式)
(3)19世纪初,铝的发现得益于电解技术的应用。下图为用铝土矿炼制铝的生产流程。
现有含Al2O351%的铝土矿200t,经上述反应后可制得铝_____t(假设上述各步反应中,铝元素一共损失10%。计算结果精确到小数点后一位)。
22.小明和小英要验证一块石头是否含碳酸钙。
(1)小明说:“只要取一小块石头放在烧杯中,再在石块上倒入盐酸,发现有大量气泡产生,就能证明石块含有碳酸钙。”小英说:“在石块上倒盐酸,产生的大量气泡是盐酸挥发而成的。”小英的说法对吗?_______(填“对”或“不对”)。
(2)小明和小英带着问题请教王老师,在王老师的指导下,进行了下列实验探究,其实验过程如下:①取一小块石块置于烧杯中,滴加盐酸后,发现产生了无色无味气体;②在老师的指导下,取①中的溶液检验,石块中含有钙元素;③他们又设计了如图所示的实验装置,在实验中观察到广口瓶中有浑浊现象产生。
在上述实验中,他们进行的是_______实验研究(填“定性”或“定量”)。
(3)假若称取10.0
g石块与足量的稀盐酸反应(杂质不与盐酸反应),并用饱和石灰水吸收,得到的沉淀经适当处理后得干燥固体7.5
g。计算:
①石块中含碳酸钙的质量分数_______________;
②已知CO2在标准状况下的密度为1.98
g/L,则生成标准状况下CO2气体的体积为______________毫升?
参考答案
1.C2.B3.D4.A5.A6.B7.B8.B9.C10.B11.D12.B13.A14.B15.B16.C
17.化学
C
使铝箔纸温度达到着火点
CO2
18.CD
19.活性炭
肥皂水
煮沸
导热
将铁锅洗净擦干(或者涂一层油)
2.5×104t
20.混合物
+6
21.导电性
三氧化二铝(或Al2O3)
设反应后可制得铝的质量为x。
x=60t
答:反应后可制得铝60t。
不对
定性
75%
1667
mL
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
