第一节(第3课时——蒸馏和萃取)
文档属性
| 名称 | 第一节(第3课时——蒸馏和萃取) |  | |
| 格式 | zip | ||
| 文件大小 | 414.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-07 08:20:19 | ||
图片预览







文档简介
(共22张PPT)
混合物的分离和提纯
——
蒸馏和萃取
蒸馏
1 原理:
利用互溶的液体混合物中各组分的沸点不同,给液体混合物加热,使其中的某一组分变成蒸气再冷凝成液体,从而达到分离提纯的目的。
蒸馏一般用于分离沸点相差较大的液体混合物。
2 实验仪器:
蒸馏烧瓶,冷凝管,酒精灯,锥形瓶,尾接管,温度计,铁架台(铁圈、铁夹),石棉网等
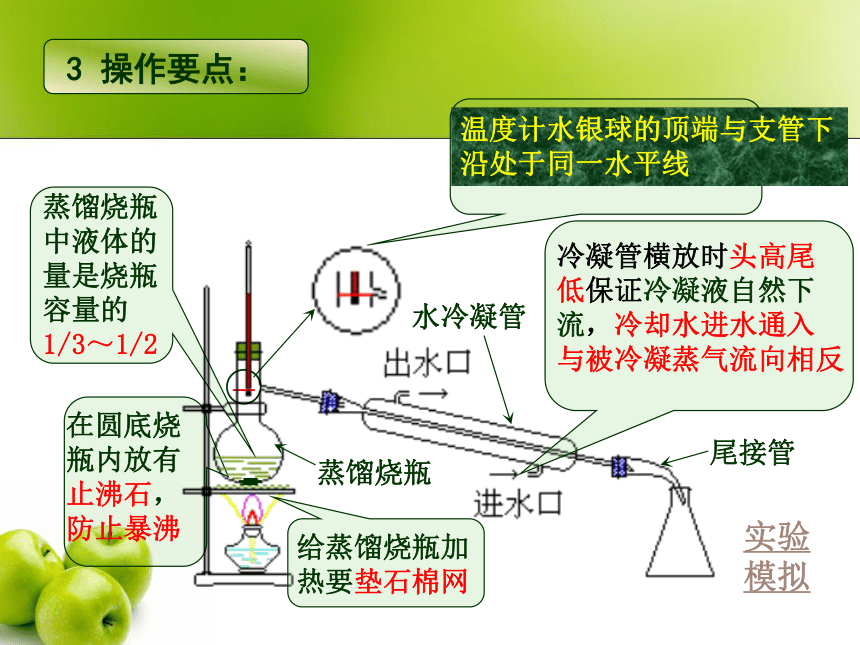
温度计水银球的顶端与支管下沿处于同一水平线
蒸馏烧瓶中液体的量是烧瓶容量的
1/3~1/2
在圆底烧瓶内放有止沸石,防止暴沸
冷凝管横放时头高尾
低保证冷凝液自然下
流,冷却水进水通入
与被冷凝蒸气流向相反
给蒸馏烧瓶加热要垫石棉网
尾接管
蒸馏烧瓶
水冷凝管
3 操作要点:
实验模拟
4 思考:
(1) 为什么冷却水通入方向与被冷凝蒸气流向相反?
(2)为什么温度计水银球顶端要与圆底烧瓶支管下沿处于同一水平线?
为了使蒸馏出的蒸气与冷却水长时间充分接触,带走尽可能多的热量。
对于蒸馏来说,只有精确控制蒸馏的温度才能达到分离提纯的目的,而蒸馏烧瓶支管口的温度正是被蒸馏变为气体某组分的温度,故温度计水银球要与圆底烧瓶支管下沿处于同一水平线
实验步骤 实验现象
(1)在试管中加入少量自来水,滴入几滴稀硝酸和几滴硝酸银溶液
(2) 在烧瓶中加入约1/3体积自来水, 加入几粒沸石, 连接好装置,通入冷凝水。开始加热, 弃去开始馏出的部分液体,用锥形瓶收集约10mL液体,停止加热。
(3)取少量收集到的液体加入试管中,滴入几滴稀硝酸和几滴硝酸银溶液
实验结论:
加入硝酸银后,有不溶
于稀硝酸的沉淀生成
烧瓶中水温升高至
100℃后沸腾,锥形瓶中
收集到蒸馏水.
加稀硝酸和硝酸银溶液后,蒸馏水中无沉淀
自来水中有Cl-,蒸馏水中无Cl-,
通过蒸馏可以除去水中的Cl-
练习
两种液体混合物A和B,已知A、B互溶。且相互不发生化学反应。在常温下,A的沸点为35℃,
B的沸点为200℃。请回答下列问题:
(1)用蒸馏方法分离物质和提纯混合物必不可
少的仪器和用品
(2)当随着温度的升高,哪一种物质先分馏出来
蒸馏烧瓶、温度计、冷凝管、酒精灯、锥形瓶、沸石、尾接管等
A物质
进水
A
B
出水
冷凝管进、出水口颠倒;
蒸馏烧瓶
冷凝管
碎瓷片
防止液体暴沸
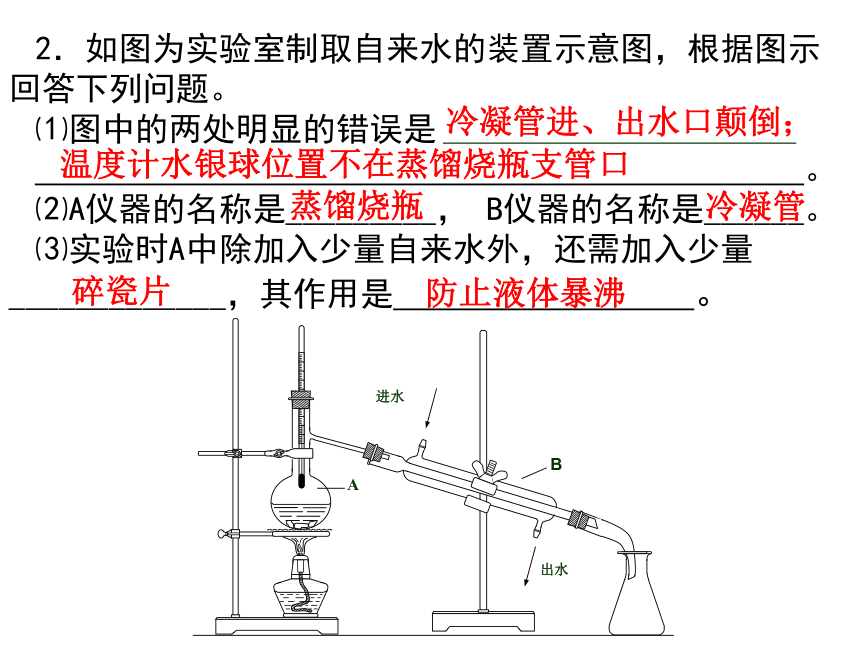
2.如图为实验室制取自来水的装置示意图,根据图示回答下列问题。
⑴图中的两处明显的错误是
。
⑵A仪器的名称是_________, B仪器的名称是______。
⑶实验时A中除加入少量自来水外,还需加入少量_____________,其作用是 。
温度计水银球位置不在蒸馏烧瓶支管口
蒸发是使溶液中的溶剂气化,从而使溶液浓缩或溶质结晶析出的操作,溶质是不具挥发性的(熔、沸点较高的)固体。
蒸馏是利用液体混合物中各组分的沸点不同,给液体混合物加热,使其中的某一组分变成蒸气再冷凝成液体,跟其他组分分离的操作。适用于分离沸点相差较大的液体混合物。
蒸发与蒸馏的区别
萃取:
根据利用混合物中一种溶质在互不相溶的溶剂里溶解性的不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来。
概念分析
混合物
溶质
溶剂
(一种)
(两种)
溶解性不同
两者互不相溶
萃取液
萃取
分液漏斗
分液
两种溶剂互不相溶。如CCl4(比水重)、苯(比水轻)、汽油(比水轻)。
溶质在两种溶剂互不相溶的溶解能力不同。如碘易溶于有机溶剂而不易溶于水。
萃取的要领
碘水的颜色:棕黄色
碘的CCl4溶液的颜色: 紫色
步骤:
检漏
装液
振荡(放气)
静置
分液
仪器:
分液漏斗、
铁架台、
烧杯
使用分液漏斗注意事项
1、使用前检查是否漏水
2、加入萃取液后要先倒转分液漏斗用力振荡,
再静置
3、分液时,上层液体由上口倒出,下层液体由
下端流出且分液漏斗下端紧贴烧杯内壁。
检漏
装液
振荡
分液
静置
实验1-4.萃取
(1)用量筒量取10ml碘的饱和水溶液,倒入分液漏斗,
然后再注入4ml四氯化碳(CCl4),盖好玻璃塞。装液
(2)用右手压住分液漏斗口部,左手握住活塞部分,
分液漏斗转过来用力振荡。振荡
(3)把分液漏斗放在铁架台上,静置。静置
(4)待液体分层后,将分液漏斗上的玻璃塞打开,或使
塞上的凹槽(或小孔)对准漏斗上的小孔,再将分液
漏斗下面的活塞打开,使下层液体漫漫流出。分液
(分液时,下层液体从漏斗管流出,上层液体从上口流)
实验1—4
思考以下问题
观察实验,实验现象说明CCl4的密度比水大还是小
分液结束后,分液漏斗的上层液体应如何取出
分液时,为什么要打开上口塞子,或者是使塞子上的凹槽对准瓶口的小孔呢?
将CCl4换成酒精可以吗?苯、汽油呢?
检漏—装液—振荡—静置—分液
观察实验,实验现象说明CCl4的密度比水大还是小
一部分有机物溶剂 Vs 无机溶剂
汽油
煤油 水
植物油
苯
四氯化碳 水
密度比水小
上层
(密度比水大,下层)
分析讨论
1、上层液体中的溶剂是( ),下层液体
中溶剂是( )
2、碘单质(I2)在哪种溶剂中的溶解度大?
3、 CCl4与H2O比较有何异同?
H2O
CCl4
四氯化碳(CCl4)
都能溶解碘单质( I2);都不与
碘单质( I2)反应。
异:
CCl4与H2O互不相溶;碘单质在CCl4中的溶解度大。
同:
目 的 实 例
过滤 分离液体和固体 除去食盐中的泥沙
蒸发 蒸发溶剂得到固体 海水晒盐
蒸馏 通过液体蒸发和冷凝,分离液体 制蒸馏水、白酒
萃取 提取物质 CCl4萃取碘
分液 分离互不相溶的液体 油水的分离
常见的几种分离方法:
一、阅读下列材料,按要求回答问题:
酒精、苯、CCl4、煤油都是有机溶剂,有机溶剂之间大都能互溶;碘(I2)难溶于水,易溶于有机溶剂,其溶液呈紫色;溴(液溴)的性质与碘相似,其溶液呈橙色。
1、下列能用分液漏斗分离的是( )
A、液溴和CCl4 B、酒精和煤油
C、CaCl2和Na2SO4溶液 D、苯和蒸馏水
D
2、在酒精、苯、CCl4、NaCl溶液、蒸馏水五种试剂中:
(1)能把碘单质从碘水中萃取出来的是 ,
进行分液之后是否已经得到纯净的碘单质?
苯,CCl4
(2)能把溴从溴水中萃取出来,并在分液时溴从分液漏斗上端倒出的是( );萃取时,上层液体呈( )色,下层液体呈 。
苯
橙
无或颜色变浅
3、CCl4能把碘酒中的碘萃取出来吗?
不能,还要进一步分离
不能,酒精与CCl4混溶
4. 用于分离或提纯物质的已学方法有:
A.萃取 B.分液 C.过滤
D.加热分解 E.蒸发 F.蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法最合适 (把选用方法的标号填入括号内)
(1)除去Ca(OH)2溶液中悬浮的Ca(OH)2 颗粒( )
(2)把饱和食盐水中的食盐提取出来( )
(3)除去酒精中溶解的微量食盐( )
(4)把溴水中的溴提取出来 ( )
(5)用自来水制取医用蒸馏水 ( )
(6)除去氧化钙中的碳酸钙 ( )
(7)分离柴油和水的混合物 ( )
B
D
A
C
E
F
F
5、现有三组溶液(1)汽油和氯化钠溶液(2)酒精和水的混合溶液 (3)氯化钠和单质溴的溶液,以上混合溶液分离的正确方法依次是( )
A、分液、萃取、蒸馏 B、萃取、蒸馏、分液
C、分液、蒸馏、萃取 D、蒸馏、萃取、分液
C
混合物的分离和提纯
——
蒸馏和萃取
蒸馏
1 原理:
利用互溶的液体混合物中各组分的沸点不同,给液体混合物加热,使其中的某一组分变成蒸气再冷凝成液体,从而达到分离提纯的目的。
蒸馏一般用于分离沸点相差较大的液体混合物。
2 实验仪器:
蒸馏烧瓶,冷凝管,酒精灯,锥形瓶,尾接管,温度计,铁架台(铁圈、铁夹),石棉网等
温度计水银球的顶端与支管下沿处于同一水平线
蒸馏烧瓶中液体的量是烧瓶容量的
1/3~1/2
在圆底烧瓶内放有止沸石,防止暴沸
冷凝管横放时头高尾
低保证冷凝液自然下
流,冷却水进水通入
与被冷凝蒸气流向相反
给蒸馏烧瓶加热要垫石棉网
尾接管
蒸馏烧瓶
水冷凝管
3 操作要点:
实验模拟
4 思考:
(1) 为什么冷却水通入方向与被冷凝蒸气流向相反?
(2)为什么温度计水银球顶端要与圆底烧瓶支管下沿处于同一水平线?
为了使蒸馏出的蒸气与冷却水长时间充分接触,带走尽可能多的热量。
对于蒸馏来说,只有精确控制蒸馏的温度才能达到分离提纯的目的,而蒸馏烧瓶支管口的温度正是被蒸馏变为气体某组分的温度,故温度计水银球要与圆底烧瓶支管下沿处于同一水平线
实验步骤 实验现象
(1)在试管中加入少量自来水,滴入几滴稀硝酸和几滴硝酸银溶液
(2) 在烧瓶中加入约1/3体积自来水, 加入几粒沸石, 连接好装置,通入冷凝水。开始加热, 弃去开始馏出的部分液体,用锥形瓶收集约10mL液体,停止加热。
(3)取少量收集到的液体加入试管中,滴入几滴稀硝酸和几滴硝酸银溶液
实验结论:
加入硝酸银后,有不溶
于稀硝酸的沉淀生成
烧瓶中水温升高至
100℃后沸腾,锥形瓶中
收集到蒸馏水.
加稀硝酸和硝酸银溶液后,蒸馏水中无沉淀
自来水中有Cl-,蒸馏水中无Cl-,
通过蒸馏可以除去水中的Cl-
练习
两种液体混合物A和B,已知A、B互溶。且相互不发生化学反应。在常温下,A的沸点为35℃,
B的沸点为200℃。请回答下列问题:
(1)用蒸馏方法分离物质和提纯混合物必不可
少的仪器和用品
(2)当随着温度的升高,哪一种物质先分馏出来
蒸馏烧瓶、温度计、冷凝管、酒精灯、锥形瓶、沸石、尾接管等
A物质
进水
A
B
出水
冷凝管进、出水口颠倒;
蒸馏烧瓶
冷凝管
碎瓷片
防止液体暴沸
2.如图为实验室制取自来水的装置示意图,根据图示回答下列问题。
⑴图中的两处明显的错误是
。
⑵A仪器的名称是_________, B仪器的名称是______。
⑶实验时A中除加入少量自来水外,还需加入少量_____________,其作用是 。
温度计水银球位置不在蒸馏烧瓶支管口
蒸发是使溶液中的溶剂气化,从而使溶液浓缩或溶质结晶析出的操作,溶质是不具挥发性的(熔、沸点较高的)固体。
蒸馏是利用液体混合物中各组分的沸点不同,给液体混合物加热,使其中的某一组分变成蒸气再冷凝成液体,跟其他组分分离的操作。适用于分离沸点相差较大的液体混合物。
蒸发与蒸馏的区别
萃取:
根据利用混合物中一种溶质在互不相溶的溶剂里溶解性的不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来。
概念分析
混合物
溶质
溶剂
(一种)
(两种)
溶解性不同
两者互不相溶
萃取液
萃取
分液漏斗
分液
两种溶剂互不相溶。如CCl4(比水重)、苯(比水轻)、汽油(比水轻)。
溶质在两种溶剂互不相溶的溶解能力不同。如碘易溶于有机溶剂而不易溶于水。
萃取的要领
碘水的颜色:棕黄色
碘的CCl4溶液的颜色: 紫色
步骤:
检漏
装液
振荡(放气)
静置
分液
仪器:
分液漏斗、
铁架台、
烧杯
使用分液漏斗注意事项
1、使用前检查是否漏水
2、加入萃取液后要先倒转分液漏斗用力振荡,
再静置
3、分液时,上层液体由上口倒出,下层液体由
下端流出且分液漏斗下端紧贴烧杯内壁。
检漏
装液
振荡
分液
静置
实验1-4.萃取
(1)用量筒量取10ml碘的饱和水溶液,倒入分液漏斗,
然后再注入4ml四氯化碳(CCl4),盖好玻璃塞。装液
(2)用右手压住分液漏斗口部,左手握住活塞部分,
分液漏斗转过来用力振荡。振荡
(3)把分液漏斗放在铁架台上,静置。静置
(4)待液体分层后,将分液漏斗上的玻璃塞打开,或使
塞上的凹槽(或小孔)对准漏斗上的小孔,再将分液
漏斗下面的活塞打开,使下层液体漫漫流出。分液
(分液时,下层液体从漏斗管流出,上层液体从上口流)
实验1—4
思考以下问题
观察实验,实验现象说明CCl4的密度比水大还是小
分液结束后,分液漏斗的上层液体应如何取出
分液时,为什么要打开上口塞子,或者是使塞子上的凹槽对准瓶口的小孔呢?
将CCl4换成酒精可以吗?苯、汽油呢?
检漏—装液—振荡—静置—分液
观察实验,实验现象说明CCl4的密度比水大还是小
一部分有机物溶剂 Vs 无机溶剂
汽油
煤油 水
植物油
苯
四氯化碳 水
密度比水小
上层
(密度比水大,下层)
分析讨论
1、上层液体中的溶剂是( ),下层液体
中溶剂是( )
2、碘单质(I2)在哪种溶剂中的溶解度大?
3、 CCl4与H2O比较有何异同?
H2O
CCl4
四氯化碳(CCl4)
都能溶解碘单质( I2);都不与
碘单质( I2)反应。
异:
CCl4与H2O互不相溶;碘单质在CCl4中的溶解度大。
同:
目 的 实 例
过滤 分离液体和固体 除去食盐中的泥沙
蒸发 蒸发溶剂得到固体 海水晒盐
蒸馏 通过液体蒸发和冷凝,分离液体 制蒸馏水、白酒
萃取 提取物质 CCl4萃取碘
分液 分离互不相溶的液体 油水的分离
常见的几种分离方法:
一、阅读下列材料,按要求回答问题:
酒精、苯、CCl4、煤油都是有机溶剂,有机溶剂之间大都能互溶;碘(I2)难溶于水,易溶于有机溶剂,其溶液呈紫色;溴(液溴)的性质与碘相似,其溶液呈橙色。
1、下列能用分液漏斗分离的是( )
A、液溴和CCl4 B、酒精和煤油
C、CaCl2和Na2SO4溶液 D、苯和蒸馏水
D
2、在酒精、苯、CCl4、NaCl溶液、蒸馏水五种试剂中:
(1)能把碘单质从碘水中萃取出来的是 ,
进行分液之后是否已经得到纯净的碘单质?
苯,CCl4
(2)能把溴从溴水中萃取出来,并在分液时溴从分液漏斗上端倒出的是( );萃取时,上层液体呈( )色,下层液体呈 。
苯
橙
无或颜色变浅
3、CCl4能把碘酒中的碘萃取出来吗?
不能,还要进一步分离
不能,酒精与CCl4混溶
4. 用于分离或提纯物质的已学方法有:
A.萃取 B.分液 C.过滤
D.加热分解 E.蒸发 F.蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法最合适 (把选用方法的标号填入括号内)
(1)除去Ca(OH)2溶液中悬浮的Ca(OH)2 颗粒( )
(2)把饱和食盐水中的食盐提取出来( )
(3)除去酒精中溶解的微量食盐( )
(4)把溴水中的溴提取出来 ( )
(5)用自来水制取医用蒸馏水 ( )
(6)除去氧化钙中的碳酸钙 ( )
(7)分离柴油和水的混合物 ( )
B
D
A
C
E
F
F
5、现有三组溶液(1)汽油和氯化钠溶液(2)酒精和水的混合溶液 (3)氯化钠和单质溴的溶液,以上混合溶液分离的正确方法依次是( )
A、分液、萃取、蒸馏 B、萃取、蒸馏、分液
C、分液、蒸馏、萃取 D、蒸馏、萃取、分液
C
