金属的化学性质(全)
图片预览










文档简介
(共36张PPT)
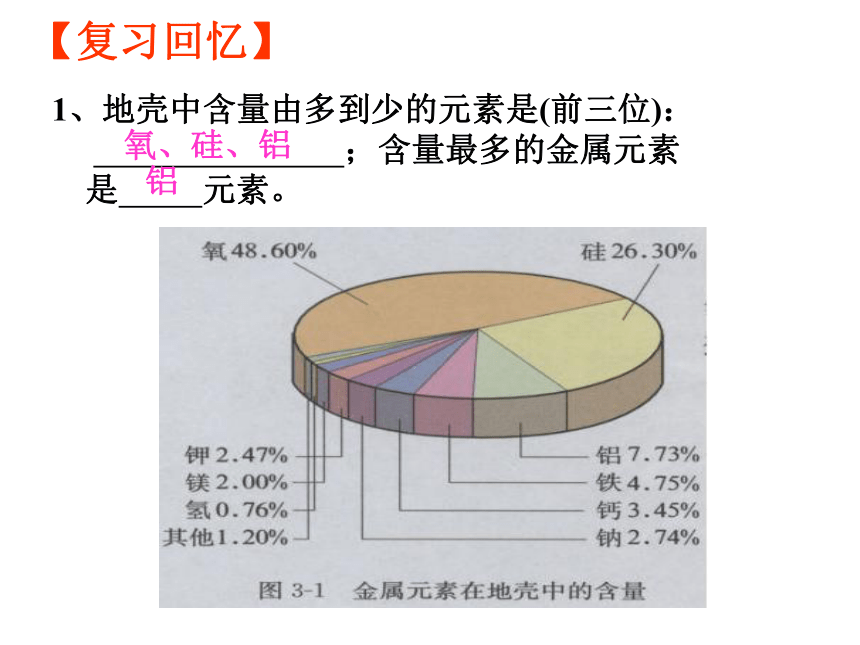
1、地壳中含量由多到少的元素是(前三位): ;含量最多的金属元素 是 元素。
【复习回忆】
氧、硅、铝
铝
*
2、金属有哪些共同的物理性质和化学性质?
(1) 物理性质
有金属光泽、
有导电性、
有导热性、
延展性
大多数是固体、
(2)化学性质
A、与氧气反应
B、金属与酸的反应
排在H前面的金属能置换出酸里的氢
金属活动性顺序表:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
C、与盐反应(金属之间的置换反应)
排在前面的金属能把排在后面的金属从其盐溶液中置换出来
Na
一、金属与非金属反应
1、钠与氧气反应
(1)常温下反应
钠必须保存在隔绝空气(和水)环境中,实验室将钠保存在煤油或石蜡中
4Na+O2=2Na2O(白色固体)
物理性质:
质软(硬度小)、密度比煤油大、银白色有金属光泽的固体。
化学性质:
很活泼,常温被空气中的氧气氧化
现象:先熔化成小球,后燃烧产生黄色火焰,生成淡黄色固体
2Na+O2===Na2O2
△
1、钠与氧气反应
特殊的氧化物——过氧化钠:Na2O2
+1 -1
(2)加热后反应
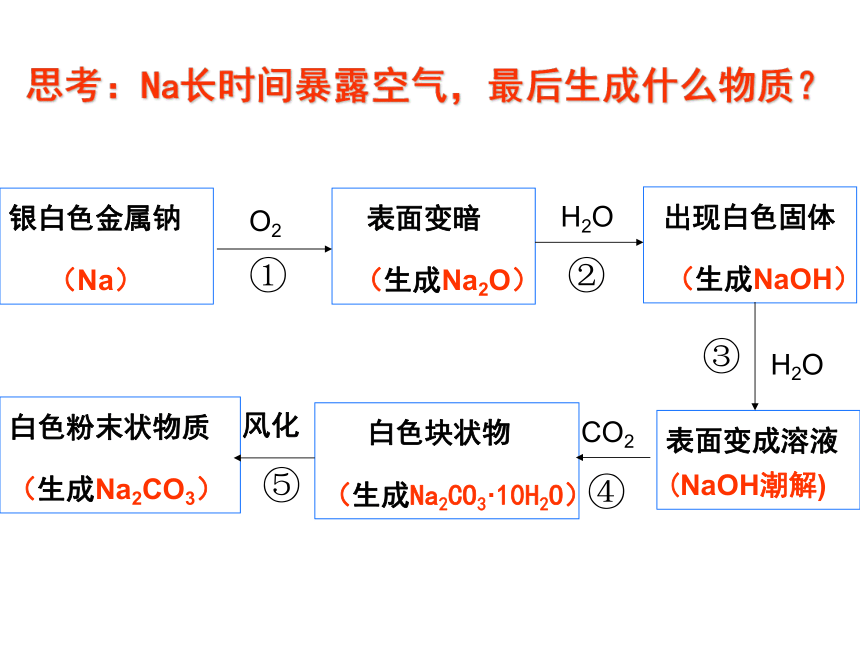
银白色金属钠
(Na)
表面变暗
(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(生成Na2CO3)
白色块状物
(生成Na2CO3·10H2O)
O2
风化
CO2
H2O
H2O
思考:Na长时间暴露空气,最后生成什么物质?
①
⑤
④
③
②
科学探究:
现象:铝箔熔化,表面失去光泽,熔化的铝并不滴落
因为铝表面有一层氧化膜保护了铝。即使打磨过的铝箔,在空气中也会很快生成新的氧化膜。构有薄膜的Al2O3的熔点(2050℃)高于Al(660 ℃ ),没有熔化,包在铝的外面使熔化的液态铝不会滴落下来。
加热铝箔
2、铝与氧气反应
现象解释:
资料卡片:铝的氧化膜----采用化学方法对铝表面的氧化膜进行处理,得到应有更广泛的金属材料。
3、镁、铝和铁分别与氧气反应
(2)铁与氧气在常温下缓慢反应,生成疏松氧化层—氧化铁(红褐色Fe2O3)
4Fe + 3O2 == 2Fe2O3
(1)镁和铝与氧气在常温下能反应,生成致密氧化膜,保护内层金属不被继续氧化
2Mg + O2 == 2MgO
4Al + 3O2 == 2Al2O3
铁丝在氧气中点燃,生成四氧化三铁(黑色)
点燃
3Fe + 2O2 == Fe3O4
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
讨论:金属与氧气反应的规律
常温下易被氧化
常温下能被氧化
加热时能被氧化
不能被氧化
小结:
一、 金属于非金属的反应
1、钠与氧气的反应
常温
加热
4Na + O2 == 2Na2O
2Na + O2 == Na2O2
2、铝与氧气的反应
3、金属与Cl2或 S 的反应
如:2Na +Cl2 = 2NaCl
Fe + S = FeS
4Al + 3O2 == 2Al2O3
常温或加热
珠江水面惊现神秘“水雷”
2001年7月7日,在珠江石溪附近,若干神秘“水雷”惊现珠江。前前后后共漂着七个白色的来历不明的铁桶。突然,从漂在水面上的一个铁桶内冒起一股白烟,窜起亮黄色火苗,紧接着一声巨响,蘑菇状的水柱冲天而起。爆炸腾起的白色烟雾有近十米高,还有许多未燃尽的白烟飘进旁边的公司内,这些灰白色的物体一遇到水就不停地冒泡,有时甚至还突然着火。
据悉,其中另有一铁桶被过往船只发现,并将其打捞上船,打算清洗后使用,但当船员把盖子打开后,桶内立刻冒起浓浓的白烟,一接触桶内物质,双手立即感到剧烈疼痛。于是,船员又将其推到江里,一遇水,这个桶又爆炸了,所幸该船逃离迅速,伤害不大。
消防队员、民警及广州化工集团的化学品专家赶来凑在一起,紧张地调查“水雷”的性质。
根据鉴定,铁桶中装的是金属钠。
思考交流:从上述新闻,可以推测钠有哪些性质呢?
在烧杯中加一些水,滴入几滴酚酞溶液,然后把一小块钠放入水中,你看到什么现象?
注意观察:① 浮还是沉?② 钠的状态③运动还是静止?④ 有何声响?⑤ 溶液颜色变化?
注意钠的取用:①镊子(不能用手接触) ②煤油要用滤纸吸干③钠块要绿豆粒大小④ 剩余的钠放回原瓶。
二、金属与酸和水反应
1、钠与水反应
演示实验,观察现象
概括 现象 性质
2Na+2H2O=2NaOH+H2↑
浮
熔
游、响
红
钠浮在水面上
立刻熔成一个小球
在水面上四处游动,发出“嘶嘶声”
反应后溶液变红
密度比水小
反应放热,熔点低
产生气体
生成碱性物质
现象:产生轻微的爆鸣声
如何检验金属钠与水反应生成的气体是H2
氢气
结论: 2Na+H2O === 2NaOH+H2
课堂思考
1、将钠放入盐酸中会反应吗,生成什么物质?
2、在溶液中,铁能置换出铜,铜能置换银,将钠放入硫酸铜溶液中,能否置换出铜单质?
2Na+CuSO4=Cu+Na2SO4
×
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
2Na+2H2O=2NaOH+H2↑
2Na+2HCl=2NaCl+H2↑
2、钠与酸的反应
2Na+ 2HCl= 2NaCl +H2↑
2Na +H2SO4 =Na 2SO4+ H2↑
钠无论是跟水还是跟酸反应,实际上都是与H+反应
钠与酸反应时,若酸过量则钠只与酸反应,
若酸不足量则钠先与酸反应再与水反应
注意
一般规律:
钠与酸溶液反应时,钠直接与溶液中的酸反应,但当钠与其它溶液反应时,一般是钠先与水反应生成氢氧化钠和氢气,然后再看生成的氢氧化钠是否与原溶液中的溶质反应!
3、钠的保存、在自然界的存在、用途、制法
保存在煤油里。
易与空气中的氧气反应
易与水反应
钠着火的处理?
性质:
用干燥的砂土扑灭
1、保存:
决
定
练习:
2、将一小块钠投入到下列物质的溶液中,既能放出氢气,又有沉淀析出的是——
A.BaCl2 B.MgCl2 C.CuCl2.D.Na2CO3
BC
1、将金属钠投入煤油和水的混合物中,会有何现象?
钠在煤油中逐渐下沉,至水面时与水发生反应,融化成银白色的小球,在煤油与水的界面处上下跳动,最后完全消失。
4、铁与水反应
二、金属与酸和水反应
观看视频,描述现象
装置设计:试管底部塞有一团潮湿的棉花,在湿棉花左边放有铁粉,蒸发皿中放肥皂水(或在水中加几滴洗涤剂)。
注意事项:整套装置试管口应低于试管底;酒精灯应先在放湿棉花的位置上加热一会儿,待试管底部温度略高,且有部分水形成蒸气时,再将酒精灯移至放铁粉的位置加热;加热一会儿后再将导管插入到肥皂水中,用燃着的火柴去点燃肥皂泡,可发出爆鸣声;肥皂水不宜太稀,否则吹起的氢气泡太小,点燃时难以有较大的爆鸣声;实验结束时,应先从肥皂水中撤出导管,再移去燃着的酒精灯。
现象:加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声。
二、金属与酸和水反应
铁粉与水蒸气反应,应从水蒸气的产生、铁粉与水蒸气反应、反应产物的检验收集等环节讨论反应装置的设计
3Fe+4H2O(g)===Fe3O4+4H2
高温
3Fe+4H2O(g)===Fe3O4+4H2↑
高温
4、金属与水反应小结
Mg+2H2O===Mg(OH)2+H2↑
100℃
2Na+2H2O=2NaOH+H2↑
2K+2H2O=2KOH+H2↑
(剧烈,氢气易爆炸)
2Al+6H20===2Al(OH)3+3H2 ↑
金属性越强,越容易与水反应
讨论:金属与水反应的规律
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
与冷水反应生成碱和氢气
与热水反应生成碱和氢气
高温下与水蒸气反应生成氧化物和氢气
不与水反应
小结
金属性越强,常温下与酸反应越剧烈;
金属性越强,常温下与水反应越强烈;
我得意的笑,又得意的笑…
无所谓, 我无所谓…
God !Save me!!
为什么受伤的总是我!
思考:观察此图,你有何看法?
结论:金属活动性顺序表中(H)前面的金属与酸反应产生H2。金属越活泼,与酸反应越剧烈。
能与酸反应是活泼和较活泼金属的通性,那么能不能与碱反应呢?
实验3—4:取2支试管,分别加入几片(用砂纸去掉氧化膜)铝片,然后再分别加入5mL 盐酸和5mL NaOH溶液,观察实验现象。过一段时间后,将点燃的木条分别放在两支加铝的试管口,你看到什么现象?
活动探究:
三、铝与氢氧化钠溶液的反应
2Al+6HCl=2AlCl3+ 3H2 ↑
2Al+2NaOH+2H2O=2NaAlO2+ 3H2 ↑
铝既能与强酸反应,又能与强碱反应,是两性金属
探究:
相同质量的铝,分别与足量的强酸、强碱反应,产生氢气体积比为:________
足量的铝,分别与同物质的量的盐酸、强碱反应,产生氢气体积比为:________
1 : 1
3 : 1
四、物质的量在化学方程式计算中的应用
2Na + 2H2O = 2NaOH + H2↑
化学计量数之比 2NA个 :2NA个 :2NA个 : 2NA个
物质的量之比 2mol :2mol :2mol :1mol
质量之比 46g : 36g : 80g : 2g
气体体积之比 2mol :2mol :2mol :22.4L
横(量)相当,竖(单位)相同
多单位混合比 2mol :2NA个 : 80g : 22.4L
例题1:
6.5g Zn与500mL盐酸恰好完全反应,能生成氢气___L(标准状况)。盐酸的物质的量浓度为___。
Zn + 2HCl = ZnCl2 + H2↑
65g 2mol 22.4L
当有65g锌参加反应时,需要2molHCl与之反应,同时生成22.4L氢气
6.5g amol bL
a=0.2mol
b=2.24L
C(HCl)=0.2mol/0.5L=0.4mol/L
实际有6.5g锌参加反应,假设未知数a、b
方程式:Zn + 2HCl = ZnCl2 + H2↑
理论值:65g 2mol 22.4L
实际值:6.5g amol bL
方程式计算“三段式”
成比例:—— = —— = ——
强调:
(1)横(量)相当,竖(单位)相同;
(2)带单位运算,结果单位要合理。
将8.1g铝与足量的氢氧化钠反应,计算生成氢气 ___ L,需要氢氧化钠 __ mol,有__ mol电子发生转移。
例题2:
2Al+2NaOH+2H2O=2NaAlO2+ 3H2 ↑ ~ 6e-
54g 2mol 22.4L 6mol
8.1g xmol yL zmol
X=0.3mol
Y=3.36L
Z=0.9mol
∴生成氢气3.36 L,需要氢氧化钠 0.3 mol,有0.9 mol电子发生转移。
3、与酸溶液反应
2Na + 2H2O = 2Na+ + 2OH- +H2↑
钠与水反应,实质上是钠与水电离出的H+
离子发生了反应。
2Na + 2H+ = 2Na+ + H2↑
当钠与酸溶液反应时,首先钠与H+
反应,其剧烈程度比钠与水反应剧烈得
多,甚至引起爆炸!若钠过量,当H+反
应完毕,钠再与水反应。
4、钠与盐溶液反应
演示实验:钠与硫酸铜溶液反应
现象:钠逐渐消失,产生无色气体,
生成了蓝色深沉。
2Na + 2H2O = 2NaOH + H2↑
2NaOH+CuSO4=Cu(OH)2 +Na2SO4
2Na + 2H2O +CuSO4=Cu(OH)2 +Na2SO4 + H2↑
2Na + 2H2O +Cu2+=Cu(OH)2 +2Na+ + H2↑
总化学方程式和离子方程式如下:
思考:在FeCl3溶液中加入钠单质有何现象?
2Na + 2H2O = 2NaOH + H2↑
FeCl3+3NaOH = Fe(OH)3↓+3NaCl
Fe3++3Cl-+3Na++3OH- =
Fe(OH)3↓+3Na++3Cl-
Fe3++ 3OH- = Fe(OH)3↓
溶液中有气泡产生,同时生成红棕色沉淀
2Na + 2H2O = 2Na+ + 2OH- +H2↑
1、地壳中含量由多到少的元素是(前三位): ;含量最多的金属元素 是 元素。
【复习回忆】
氧、硅、铝
铝
*
2、金属有哪些共同的物理性质和化学性质?
(1) 物理性质
有金属光泽、
有导电性、
有导热性、
延展性
大多数是固体、
(2)化学性质
A、与氧气反应
B、金属与酸的反应
排在H前面的金属能置换出酸里的氢
金属活动性顺序表:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
C、与盐反应(金属之间的置换反应)
排在前面的金属能把排在后面的金属从其盐溶液中置换出来
Na
一、金属与非金属反应
1、钠与氧气反应
(1)常温下反应
钠必须保存在隔绝空气(和水)环境中,实验室将钠保存在煤油或石蜡中
4Na+O2=2Na2O(白色固体)
物理性质:
质软(硬度小)、密度比煤油大、银白色有金属光泽的固体。
化学性质:
很活泼,常温被空气中的氧气氧化
现象:先熔化成小球,后燃烧产生黄色火焰,生成淡黄色固体
2Na+O2===Na2O2
△
1、钠与氧气反应
特殊的氧化物——过氧化钠:Na2O2
+1 -1
(2)加热后反应
银白色金属钠
(Na)
表面变暗
(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(生成Na2CO3)
白色块状物
(生成Na2CO3·10H2O)
O2
风化
CO2
H2O
H2O
思考:Na长时间暴露空气,最后生成什么物质?
①
⑤
④
③
②
科学探究:
现象:铝箔熔化,表面失去光泽,熔化的铝并不滴落
因为铝表面有一层氧化膜保护了铝。即使打磨过的铝箔,在空气中也会很快生成新的氧化膜。构有薄膜的Al2O3的熔点(2050℃)高于Al(660 ℃ ),没有熔化,包在铝的外面使熔化的液态铝不会滴落下来。
加热铝箔
2、铝与氧气反应
现象解释:
资料卡片:铝的氧化膜----采用化学方法对铝表面的氧化膜进行处理,得到应有更广泛的金属材料。
3、镁、铝和铁分别与氧气反应
(2)铁与氧气在常温下缓慢反应,生成疏松氧化层—氧化铁(红褐色Fe2O3)
4Fe + 3O2 == 2Fe2O3
(1)镁和铝与氧气在常温下能反应,生成致密氧化膜,保护内层金属不被继续氧化
2Mg + O2 == 2MgO
4Al + 3O2 == 2Al2O3
铁丝在氧气中点燃,生成四氧化三铁(黑色)
点燃
3Fe + 2O2 == Fe3O4
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
讨论:金属与氧气反应的规律
常温下易被氧化
常温下能被氧化
加热时能被氧化
不能被氧化
小结:
一、 金属于非金属的反应
1、钠与氧气的反应
常温
加热
4Na + O2 == 2Na2O
2Na + O2 == Na2O2
2、铝与氧气的反应
3、金属与Cl2或 S 的反应
如:2Na +Cl2 = 2NaCl
Fe + S = FeS
4Al + 3O2 == 2Al2O3
常温或加热
珠江水面惊现神秘“水雷”
2001年7月7日,在珠江石溪附近,若干神秘“水雷”惊现珠江。前前后后共漂着七个白色的来历不明的铁桶。突然,从漂在水面上的一个铁桶内冒起一股白烟,窜起亮黄色火苗,紧接着一声巨响,蘑菇状的水柱冲天而起。爆炸腾起的白色烟雾有近十米高,还有许多未燃尽的白烟飘进旁边的公司内,这些灰白色的物体一遇到水就不停地冒泡,有时甚至还突然着火。
据悉,其中另有一铁桶被过往船只发现,并将其打捞上船,打算清洗后使用,但当船员把盖子打开后,桶内立刻冒起浓浓的白烟,一接触桶内物质,双手立即感到剧烈疼痛。于是,船员又将其推到江里,一遇水,这个桶又爆炸了,所幸该船逃离迅速,伤害不大。
消防队员、民警及广州化工集团的化学品专家赶来凑在一起,紧张地调查“水雷”的性质。
根据鉴定,铁桶中装的是金属钠。
思考交流:从上述新闻,可以推测钠有哪些性质呢?
在烧杯中加一些水,滴入几滴酚酞溶液,然后把一小块钠放入水中,你看到什么现象?
注意观察:① 浮还是沉?② 钠的状态③运动还是静止?④ 有何声响?⑤ 溶液颜色变化?
注意钠的取用:①镊子(不能用手接触) ②煤油要用滤纸吸干③钠块要绿豆粒大小④ 剩余的钠放回原瓶。
二、金属与酸和水反应
1、钠与水反应
演示实验,观察现象
概括 现象 性质
2Na+2H2O=2NaOH+H2↑
浮
熔
游、响
红
钠浮在水面上
立刻熔成一个小球
在水面上四处游动,发出“嘶嘶声”
反应后溶液变红
密度比水小
反应放热,熔点低
产生气体
生成碱性物质
现象:产生轻微的爆鸣声
如何检验金属钠与水反应生成的气体是H2
氢气
结论: 2Na+H2O === 2NaOH+H2
课堂思考
1、将钠放入盐酸中会反应吗,生成什么物质?
2、在溶液中,铁能置换出铜,铜能置换银,将钠放入硫酸铜溶液中,能否置换出铜单质?
2Na+CuSO4=Cu+Na2SO4
×
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
2Na+2H2O=2NaOH+H2↑
2Na+2HCl=2NaCl+H2↑
2、钠与酸的反应
2Na+ 2HCl= 2NaCl +H2↑
2Na +H2SO4 =Na 2SO4+ H2↑
钠无论是跟水还是跟酸反应,实际上都是与H+反应
钠与酸反应时,若酸过量则钠只与酸反应,
若酸不足量则钠先与酸反应再与水反应
注意
一般规律:
钠与酸溶液反应时,钠直接与溶液中的酸反应,但当钠与其它溶液反应时,一般是钠先与水反应生成氢氧化钠和氢气,然后再看生成的氢氧化钠是否与原溶液中的溶质反应!
3、钠的保存、在自然界的存在、用途、制法
保存在煤油里。
易与空气中的氧气反应
易与水反应
钠着火的处理?
性质:
用干燥的砂土扑灭
1、保存:
决
定
练习:
2、将一小块钠投入到下列物质的溶液中,既能放出氢气,又有沉淀析出的是——
A.BaCl2 B.MgCl2 C.CuCl2.D.Na2CO3
BC
1、将金属钠投入煤油和水的混合物中,会有何现象?
钠在煤油中逐渐下沉,至水面时与水发生反应,融化成银白色的小球,在煤油与水的界面处上下跳动,最后完全消失。
4、铁与水反应
二、金属与酸和水反应
观看视频,描述现象
装置设计:试管底部塞有一团潮湿的棉花,在湿棉花左边放有铁粉,蒸发皿中放肥皂水(或在水中加几滴洗涤剂)。
注意事项:整套装置试管口应低于试管底;酒精灯应先在放湿棉花的位置上加热一会儿,待试管底部温度略高,且有部分水形成蒸气时,再将酒精灯移至放铁粉的位置加热;加热一会儿后再将导管插入到肥皂水中,用燃着的火柴去点燃肥皂泡,可发出爆鸣声;肥皂水不宜太稀,否则吹起的氢气泡太小,点燃时难以有较大的爆鸣声;实验结束时,应先从肥皂水中撤出导管,再移去燃着的酒精灯。
现象:加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声。
二、金属与酸和水反应
铁粉与水蒸气反应,应从水蒸气的产生、铁粉与水蒸气反应、反应产物的检验收集等环节讨论反应装置的设计
3Fe+4H2O(g)===Fe3O4+4H2
高温
3Fe+4H2O(g)===Fe3O4+4H2↑
高温
4、金属与水反应小结
Mg+2H2O===Mg(OH)2+H2↑
100℃
2Na+2H2O=2NaOH+H2↑
2K+2H2O=2KOH+H2↑
(剧烈,氢气易爆炸)
2Al+6H20===2Al(OH)3+3H2 ↑
金属性越强,越容易与水反应
讨论:金属与水反应的规律
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
与冷水反应生成碱和氢气
与热水反应生成碱和氢气
高温下与水蒸气反应生成氧化物和氢气
不与水反应
小结
金属性越强,常温下与酸反应越剧烈;
金属性越强,常温下与水反应越强烈;
我得意的笑,又得意的笑…
无所谓, 我无所谓…
God !Save me!!
为什么受伤的总是我!
思考:观察此图,你有何看法?
结论:金属活动性顺序表中(H)前面的金属与酸反应产生H2。金属越活泼,与酸反应越剧烈。
能与酸反应是活泼和较活泼金属的通性,那么能不能与碱反应呢?
实验3—4:取2支试管,分别加入几片(用砂纸去掉氧化膜)铝片,然后再分别加入5mL 盐酸和5mL NaOH溶液,观察实验现象。过一段时间后,将点燃的木条分别放在两支加铝的试管口,你看到什么现象?
活动探究:
三、铝与氢氧化钠溶液的反应
2Al+6HCl=2AlCl3+ 3H2 ↑
2Al+2NaOH+2H2O=2NaAlO2+ 3H2 ↑
铝既能与强酸反应,又能与强碱反应,是两性金属
探究:
相同质量的铝,分别与足量的强酸、强碱反应,产生氢气体积比为:________
足量的铝,分别与同物质的量的盐酸、强碱反应,产生氢气体积比为:________
1 : 1
3 : 1
四、物质的量在化学方程式计算中的应用
2Na + 2H2O = 2NaOH + H2↑
化学计量数之比 2NA个 :2NA个 :2NA个 : 2NA个
物质的量之比 2mol :2mol :2mol :1mol
质量之比 46g : 36g : 80g : 2g
气体体积之比 2mol :2mol :2mol :22.4L
横(量)相当,竖(单位)相同
多单位混合比 2mol :2NA个 : 80g : 22.4L
例题1:
6.5g Zn与500mL盐酸恰好完全反应,能生成氢气___L(标准状况)。盐酸的物质的量浓度为___。
Zn + 2HCl = ZnCl2 + H2↑
65g 2mol 22.4L
当有65g锌参加反应时,需要2molHCl与之反应,同时生成22.4L氢气
6.5g amol bL
a=0.2mol
b=2.24L
C(HCl)=0.2mol/0.5L=0.4mol/L
实际有6.5g锌参加反应,假设未知数a、b
方程式:Zn + 2HCl = ZnCl2 + H2↑
理论值:65g 2mol 22.4L
实际值:6.5g amol bL
方程式计算“三段式”
成比例:—— = —— = ——
强调:
(1)横(量)相当,竖(单位)相同;
(2)带单位运算,结果单位要合理。
将8.1g铝与足量的氢氧化钠反应,计算生成氢气 ___ L,需要氢氧化钠 __ mol,有__ mol电子发生转移。
例题2:
2Al+2NaOH+2H2O=2NaAlO2+ 3H2 ↑ ~ 6e-
54g 2mol 22.4L 6mol
8.1g xmol yL zmol
X=0.3mol
Y=3.36L
Z=0.9mol
∴生成氢气3.36 L,需要氢氧化钠 0.3 mol,有0.9 mol电子发生转移。
3、与酸溶液反应
2Na + 2H2O = 2Na+ + 2OH- +H2↑
钠与水反应,实质上是钠与水电离出的H+
离子发生了反应。
2Na + 2H+ = 2Na+ + H2↑
当钠与酸溶液反应时,首先钠与H+
反应,其剧烈程度比钠与水反应剧烈得
多,甚至引起爆炸!若钠过量,当H+反
应完毕,钠再与水反应。
4、钠与盐溶液反应
演示实验:钠与硫酸铜溶液反应
现象:钠逐渐消失,产生无色气体,
生成了蓝色深沉。
2Na + 2H2O = 2NaOH + H2↑
2NaOH+CuSO4=Cu(OH)2 +Na2SO4
2Na + 2H2O +CuSO4=Cu(OH)2 +Na2SO4 + H2↑
2Na + 2H2O +Cu2+=Cu(OH)2 +2Na+ + H2↑
总化学方程式和离子方程式如下:
思考:在FeCl3溶液中加入钠单质有何现象?
2Na + 2H2O = 2NaOH + H2↑
FeCl3+3NaOH = Fe(OH)3↓+3NaCl
Fe3++3Cl-+3Na++3OH- =
Fe(OH)3↓+3Na++3Cl-
Fe3++ 3OH- = Fe(OH)3↓
溶液中有气泡产生,同时生成红棕色沉淀
2Na + 2H2O = 2Na+ + 2OH- +H2↑
