高中化学人教版必修一 2019版本 第一章 第一节 第二课时 物质的转化(共29张PPT)
文档属性
| 名称 | 高中化学人教版必修一 2019版本 第一章 第一节 第二课时 物质的转化(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 813.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-27 19:15:15 | ||
图片预览






文档简介
主讲老师:刘老师
第一章 物质及其变化
第一节 物质的分类及转化
1.1.2 物质的转化
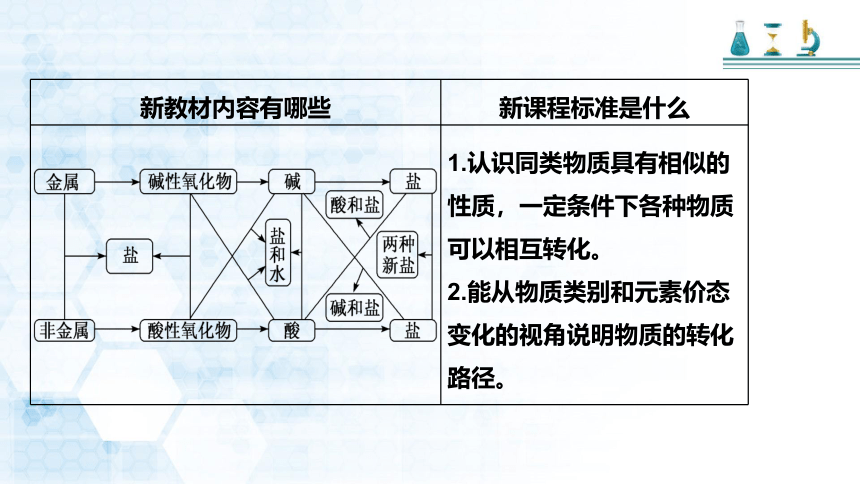
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A} 新教材内容有哪些
新课程标准是什么
1.认识同类物质具有相似的性质,一定条件下各种物质可以相互转化。
2.能从物质类别和元素价态变化的视角说明物质的转化路径。
物质的分类是高中化学学习的重要方法,通过上节课的学习,你是不是知道下面的问题:
如何对化学物质进行分类?
分类的优点是什么?
建立科学的分类标准
便于对未知物质的研究分析
在高中化学的学习中我们应该如何应用分类来促进自己的学习?
物质的转化
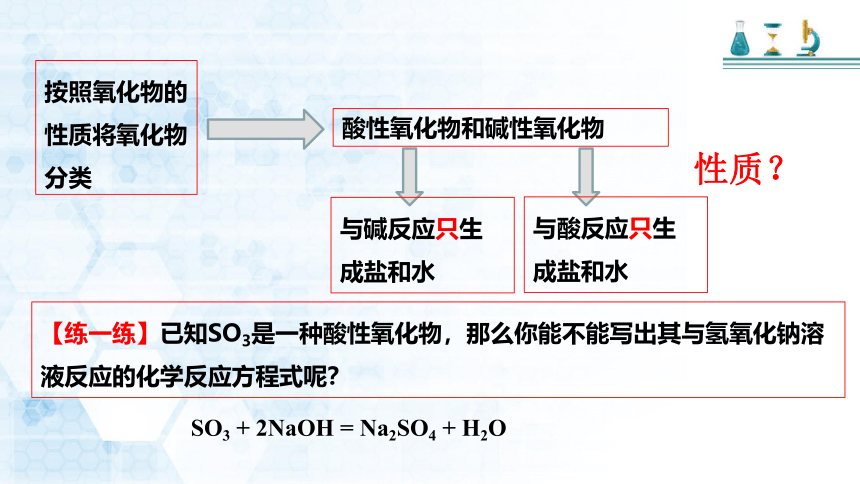
按照氧化物的性质将氧化物分类
酸性氧化物和碱性氧化物
性质?
与碱反应只生成盐和水
与酸反应只生成盐和水
【练一练】已知SO3是一种酸性氧化物,那么你能不能写出其与氢氧化钠溶液反应的化学反应方程式呢?
SO3 + 2NaOH = Na2SO4 + H2O
探究、单质、氧化物、酸、碱、盐之间的相互转化规律
一.各类物质的化学通性
(1)金属单质(以Fe为例)
金属
O2
金属氧化物(Fe3O4)
酸(如H2SO4)
盐+H2↑ (FeSO4+H2)
盐(如CuCl2)
盐+金属(FeCl2+Cu)
探究、单质、氧化物、酸、碱、盐之间的相互转化规律
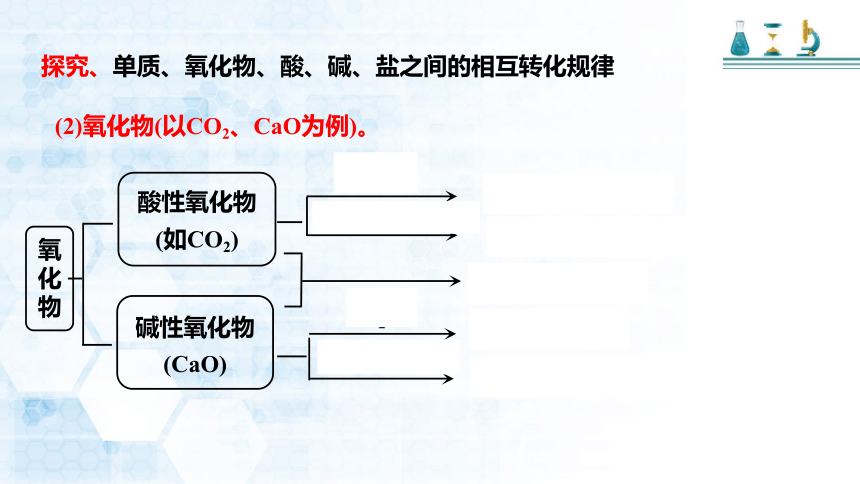
(2)氧化物(以CO2、CaO为例)。
H2O
碱(如NaOH)
H2O
酸(如HCl)
含氧酸(H2CO3)
盐+H2O(Na2CO3+H2O)
盐(CaCO3)
碱[Ca(OH)2]
盐+H2O(CaCl2+H2O)
氧
化
物
酸性氧化物
(如CO2)
碱性氧化物
(CaO)
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}酸的通性
列举实例(写出反应方程式)
反应类型
指示剂
使紫色石蕊试液变红色,无色酚酞试液不变色
?
活泼金属
Fe + H2SO4 =FeSO4 + H2↑
置换反应
碱性氧化物
Fe2O3 + 3H2SO4 =Fe2(SO4)3 +3H2O
复分解反应
碱
Cu(OH)2 +H2SO4 =CuSO4 +2H2O
复分解反应
某些盐
BaCl2 +H2SO4 =BaSO4 ↓+2HCl
复分解反应
探究、单质、氧化物、酸、碱、盐之间的相互转化规律
(3)酸(以稀硫酸为例)。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}碱的通性
列举实例(写出反应方程式)
反应类型
指示剂
使紫色石蕊试液变蓝色,无色酚酞试液变红色
?
酸
NaOH+HCl=NaCl+H2O
复分解反应
酸性氧化物
CO2+2NaOH =Na2CO3+H2O
复分解反应
某些盐
2NaOH+CuSO4 =Cu(OH)2 ↓+Na2SO4
复分解反应
探究、单质、氧化物、酸、碱、盐之间的相互转化规律
(4)碱(以氢氧化钠为例)。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}盐的主要化学性质
列举实例(写出反应方程式)
反应类型
金属
Fe +CuSO4 =Cu+FeSO4
置换反应
酸
CaCO3+2HCl=CaCl2+H2O+CO2↑
复分解反应
碱
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
复分解反应
盐
NaCl+AgNO3=AgCl↓+NaNO3
复分解反应
探究、单质、氧化物、酸、碱、盐之间的相互转化规律
(5)盐
为什么酸、碱或者盐具有相似的化学性质呢?
具有相似的化学组成
结构决定性质
HCl
H2SO4
HNO3
H+
NaOH
KOH
Ba(OH)2
OH-
Na2CO3
K2CO3
(NH4)2CO3
CO32-
总结、单质、氧化物、酸、碱、盐之间的相互转化规律
转换关系图
盐和
金属
金属
盐
盐和
氢气
碱性氧化物
酸性氧化物
酸
碱
酸和盐
盐
碱和盐
盐和水
两种新盐
盐
非金属
二、物质的转化
将金属单质钙转化为盐(硫酸钙),应该经过怎样的流程呢?
请同学们互相讨论交流,分组提出自己的转化流程。
将非金属单质碳转化为盐(碳酸钙)呢?
2Ca+O2= 2CaO
CO2+ H2O =H2CO3
CaO+H2O=Ca(OH)2
Ca(OH)2+H2SO4=CaSO4+ 2H2O
C + O2 = CO2
H2CO3+ Ca(OH)2= CaCO3↓+ 2H2O
二、物质的转化
以钙、氧化钙、氢氧化钙、硫酸钙为例认识金属元素的相关类型物质转化关系:
以碳、二氧化碳、碳酸、碳酸钠为例认识非金属元素的相关类型物质转化关系:
【练一练】根据上面的转化过程,写出非金属单质S到对应盐Na2SO3的转化过程。
单质到盐的转化
小结
1,在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在如图所示的相互关系,选择①~⑤中适当的物质,使有连线的两物质能发生反应。
(1)请推断它们的化学式分别为①________;②________;③________;④________;⑤________。
Fe
H2SO4
CO2
CaO
Na2CO3
练习
(2)写出下列序号之间的化学方程式:
①和②:_________________________________;
②和④:_________________________________;
②和⑤:________________________________ _;
③和④:_________________________________。
Fe+H2SO4===FeSO4+H2↑
CaO+H2SO4===CaSO4+H2O
Na2CO3+H2SO4===Na2SO4+CO2↑+H2O
CO2+CaO===CaCO3
解析 据单质①能和酸②发生化学反应,推知①应为活泼金属单质即为铁,而酸只有稀H2SO4,即②为稀H2SO4,则氧化物④应为金属氧化物CaO,从而氧化物③为酸性氧化物,即CO2,⑤属于盐且其溶液既能与H2SO4反应,又能与CaO反应,则⑤应为Na2CO3。
2,A、B、C、D、E中都含有同一种元素,它们之间的相互转化关系如图所示,其中所含的相同元素是( )
A.铜 B.碳 C.铁 D.钙
D
解析 A为CaO,B为Ca(OH)2,C为Ca(NO3)2,D为CaCl2,E为CaCO3。
3.氢氧化钠、氢氧化钙的溶液都具有相似的化学性质,其原因是
A.都能解离出金属离子
B.都能与酸反应生成盐和水
C.都能使无色酚酞溶液变成红色
D.溶液中都含有OH-
√
4.下列四组实验中,不能体现酸的通性的是
√
5.碱溶液中都含有OH-,因此不同的碱表现出一些共同的性质。下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是
A.能使紫色石蕊溶液变蓝色
B.能与盐酸反应生成水
C.能与Na2SO4溶液反应生成BaSO4沉淀
D.能与CO2反应生成水
√
解析 Ba(OH)2与Na2SO4反应的实质是Ba2+与 的反应,不属于OH-的性质。
6.类推是化学学习中常用的思维方法。下列类推正确的是
A.某些金属与酸反应有气体产生,则与酸反应产生气体的一定是金属
B.酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.单质一定是由同种元素组成的物质,则由同种元素组成的物质一定是单质
D.碱性溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱性溶液
√
7.在一定条件下,跟酸、碱、盐都能反应的物质是
A.CaO B.Na2CO3
C.CaCO3 D.CO2
√
解析 CaO是碱性氧化物,与碱不发生反应;CO2是酸性氧化物,与酸不发生反应;Na2CO3和CaCO3都是盐,但CaCO3难溶于水,不与碱、盐发生反应,Na2CO3可分别与盐酸、氢氧化钙、氯化钙等发生反应。
8.一同学设计了两种由CuO→Cu的实验方案:
大家认为方案二优于方案一,理由是:①节约能源;②Cu产率高;③产品纯净;④操作安全。其中,评价正确的是
A.①②③ B.①②④
C.①③④ D.②③
√
总结
单质、氧化物、酸、碱、盐之间的转化关系
化学课堂欢迎你
其他内容 且听下回分解
第一章 物质及其变化
第一节 物质的分类及转化
1.1.2 物质的转化
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A} 新教材内容有哪些
新课程标准是什么
1.认识同类物质具有相似的性质,一定条件下各种物质可以相互转化。
2.能从物质类别和元素价态变化的视角说明物质的转化路径。
物质的分类是高中化学学习的重要方法,通过上节课的学习,你是不是知道下面的问题:
如何对化学物质进行分类?
分类的优点是什么?
建立科学的分类标准
便于对未知物质的研究分析
在高中化学的学习中我们应该如何应用分类来促进自己的学习?
物质的转化
按照氧化物的性质将氧化物分类
酸性氧化物和碱性氧化物
性质?
与碱反应只生成盐和水
与酸反应只生成盐和水
【练一练】已知SO3是一种酸性氧化物,那么你能不能写出其与氢氧化钠溶液反应的化学反应方程式呢?
SO3 + 2NaOH = Na2SO4 + H2O
探究、单质、氧化物、酸、碱、盐之间的相互转化规律
一.各类物质的化学通性
(1)金属单质(以Fe为例)
金属
O2
金属氧化物(Fe3O4)
酸(如H2SO4)
盐+H2↑ (FeSO4+H2)
盐(如CuCl2)
盐+金属(FeCl2+Cu)
探究、单质、氧化物、酸、碱、盐之间的相互转化规律
(2)氧化物(以CO2、CaO为例)。
H2O
碱(如NaOH)
H2O
酸(如HCl)
含氧酸(H2CO3)
盐+H2O(Na2CO3+H2O)
盐(CaCO3)
碱[Ca(OH)2]
盐+H2O(CaCl2+H2O)
氧
化
物
酸性氧化物
(如CO2)
碱性氧化物
(CaO)
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}酸的通性
列举实例(写出反应方程式)
反应类型
指示剂
使紫色石蕊试液变红色,无色酚酞试液不变色
?
活泼金属
Fe + H2SO4 =FeSO4 + H2↑
置换反应
碱性氧化物
Fe2O3 + 3H2SO4 =Fe2(SO4)3 +3H2O
复分解反应
碱
Cu(OH)2 +H2SO4 =CuSO4 +2H2O
复分解反应
某些盐
BaCl2 +H2SO4 =BaSO4 ↓+2HCl
复分解反应
探究、单质、氧化物、酸、碱、盐之间的相互转化规律
(3)酸(以稀硫酸为例)。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}碱的通性
列举实例(写出反应方程式)
反应类型
指示剂
使紫色石蕊试液变蓝色,无色酚酞试液变红色
?
酸
NaOH+HCl=NaCl+H2O
复分解反应
酸性氧化物
CO2+2NaOH =Na2CO3+H2O
复分解反应
某些盐
2NaOH+CuSO4 =Cu(OH)2 ↓+Na2SO4
复分解反应
探究、单质、氧化物、酸、碱、盐之间的相互转化规律
(4)碱(以氢氧化钠为例)。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}盐的主要化学性质
列举实例(写出反应方程式)
反应类型
金属
Fe +CuSO4 =Cu+FeSO4
置换反应
酸
CaCO3+2HCl=CaCl2+H2O+CO2↑
复分解反应
碱
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
复分解反应
盐
NaCl+AgNO3=AgCl↓+NaNO3
复分解反应
探究、单质、氧化物、酸、碱、盐之间的相互转化规律
(5)盐
为什么酸、碱或者盐具有相似的化学性质呢?
具有相似的化学组成
结构决定性质
HCl
H2SO4
HNO3
H+
NaOH
KOH
Ba(OH)2
OH-
Na2CO3
K2CO3
(NH4)2CO3
CO32-
总结、单质、氧化物、酸、碱、盐之间的相互转化规律
转换关系图
盐和
金属
金属
盐
盐和
氢气
碱性氧化物
酸性氧化物
酸
碱
酸和盐
盐
碱和盐
盐和水
两种新盐
盐
非金属
二、物质的转化
将金属单质钙转化为盐(硫酸钙),应该经过怎样的流程呢?
请同学们互相讨论交流,分组提出自己的转化流程。
将非金属单质碳转化为盐(碳酸钙)呢?
2Ca+O2= 2CaO
CO2+ H2O =H2CO3
CaO+H2O=Ca(OH)2
Ca(OH)2+H2SO4=CaSO4+ 2H2O
C + O2 = CO2
H2CO3+ Ca(OH)2= CaCO3↓+ 2H2O
二、物质的转化
以钙、氧化钙、氢氧化钙、硫酸钙为例认识金属元素的相关类型物质转化关系:
以碳、二氧化碳、碳酸、碳酸钠为例认识非金属元素的相关类型物质转化关系:
【练一练】根据上面的转化过程,写出非金属单质S到对应盐Na2SO3的转化过程。
单质到盐的转化
小结
1,在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在如图所示的相互关系,选择①~⑤中适当的物质,使有连线的两物质能发生反应。
(1)请推断它们的化学式分别为①________;②________;③________;④________;⑤________。
Fe
H2SO4
CO2
CaO
Na2CO3
练习
(2)写出下列序号之间的化学方程式:
①和②:_________________________________;
②和④:_________________________________;
②和⑤:________________________________ _;
③和④:_________________________________。
Fe+H2SO4===FeSO4+H2↑
CaO+H2SO4===CaSO4+H2O
Na2CO3+H2SO4===Na2SO4+CO2↑+H2O
CO2+CaO===CaCO3
解析 据单质①能和酸②发生化学反应,推知①应为活泼金属单质即为铁,而酸只有稀H2SO4,即②为稀H2SO4,则氧化物④应为金属氧化物CaO,从而氧化物③为酸性氧化物,即CO2,⑤属于盐且其溶液既能与H2SO4反应,又能与CaO反应,则⑤应为Na2CO3。
2,A、B、C、D、E中都含有同一种元素,它们之间的相互转化关系如图所示,其中所含的相同元素是( )
A.铜 B.碳 C.铁 D.钙
D
解析 A为CaO,B为Ca(OH)2,C为Ca(NO3)2,D为CaCl2,E为CaCO3。
3.氢氧化钠、氢氧化钙的溶液都具有相似的化学性质,其原因是
A.都能解离出金属离子
B.都能与酸反应生成盐和水
C.都能使无色酚酞溶液变成红色
D.溶液中都含有OH-
√
4.下列四组实验中,不能体现酸的通性的是
√
5.碱溶液中都含有OH-,因此不同的碱表现出一些共同的性质。下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是
A.能使紫色石蕊溶液变蓝色
B.能与盐酸反应生成水
C.能与Na2SO4溶液反应生成BaSO4沉淀
D.能与CO2反应生成水
√
解析 Ba(OH)2与Na2SO4反应的实质是Ba2+与 的反应,不属于OH-的性质。
6.类推是化学学习中常用的思维方法。下列类推正确的是
A.某些金属与酸反应有气体产生,则与酸反应产生气体的一定是金属
B.酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.单质一定是由同种元素组成的物质,则由同种元素组成的物质一定是单质
D.碱性溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱性溶液
√
7.在一定条件下,跟酸、碱、盐都能反应的物质是
A.CaO B.Na2CO3
C.CaCO3 D.CO2
√
解析 CaO是碱性氧化物,与碱不发生反应;CO2是酸性氧化物,与酸不发生反应;Na2CO3和CaCO3都是盐,但CaCO3难溶于水,不与碱、盐发生反应,Na2CO3可分别与盐酸、氢氧化钙、氯化钙等发生反应。
8.一同学设计了两种由CuO→Cu的实验方案:
大家认为方案二优于方案一,理由是:①节约能源;②Cu产率高;③产品纯净;④操作安全。其中,评价正确的是
A.①②③ B.①②④
C.①③④ D.②③
√
总结
单质、氧化物、酸、碱、盐之间的转化关系
化学课堂欢迎你
其他内容 且听下回分解
