人教版化学第一册 第一章第一节 物质的分类及其转化 第1、2课时38ppt
文档属性
| 名称 | 人教版化学第一册 第一章第一节 物质的分类及其转化 第1、2课时38ppt |  | |
| 格式 | pptx | ||
| 文件大小 | 16.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-27 19:25:28 | ||
图片预览








文档简介
目录
物质的分类
物质的转化
1、根据物质的组成和性质分类
2、分散系及其分类
1、酸碱盐的性质
2、物质的转化
第一节
物质的分类及转化
一、物质的分类
分类法是把某些特征相似的物体归类到一起的方法。
物以类聚
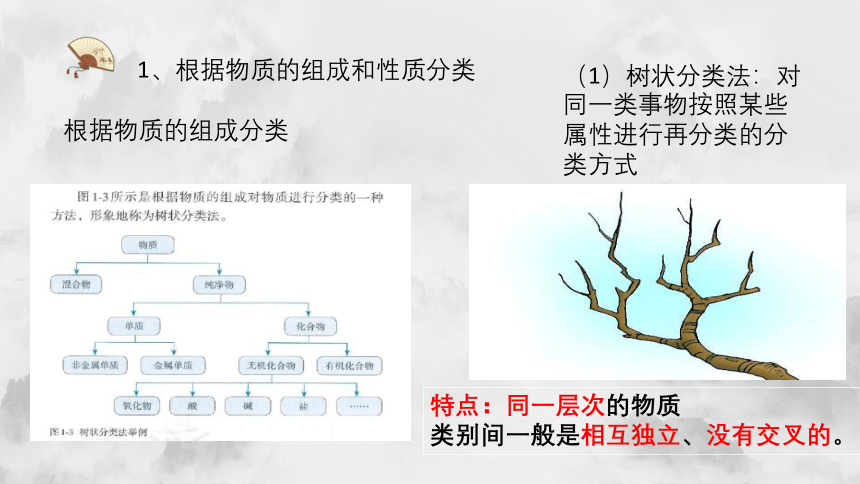
1、根据物质的组成和性质分类
根据物质的组成分类
(1)树状分类法:对同一类事物按照某些属性进行再分类的分类方式
特点:同一层次的物质 类别间一般是相互独立、没有交叉的。
单一分类标准有一定的局限,所能提供的信息少,对同一事物,我们可以从不同的角度,按不同的标准来分类。
如交叉分类法:
分类并没有唯一性,它会根据分类的标准不同而不同。
特点:物质类别间有相交叉的部分
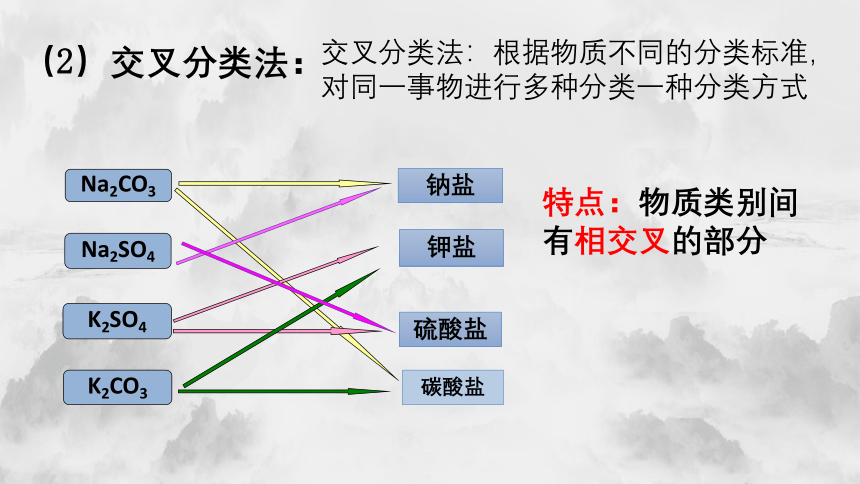
(2)交叉分类法:
钠盐
钾盐
硫酸盐
碳酸盐
Na2CO3
Na2SO4
K2SO4
K2CO3
交叉分类法:根据物质不同的分类标准,对同一事物进行多种分类一种分类方式
根据物质的组成和性质对物质进行
根据物质组成是否单一
根据组成元素的异同
根据性质的差异
根据组成的差异
(3)
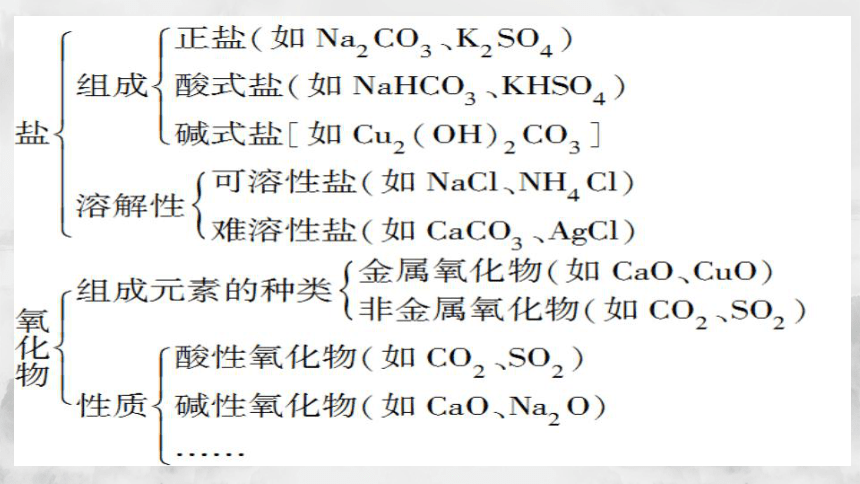
酸、碱、盐、氧化物还可以再分类
① 单质:单质是由同种元素组成的纯净物,元素在单质中存在时称为元素的游离态 。 如金刚石、石墨、C60、O2、O3、H2等
同素异形体:同一种元素形成的几种性质不同的单质
②化合物:化合物由两种或两种以上的元素组成的纯净物,元素在化合物中存在时称为元素的化合态
(4)几个概念
由一种元素组成的物质一定是单质
判断对错
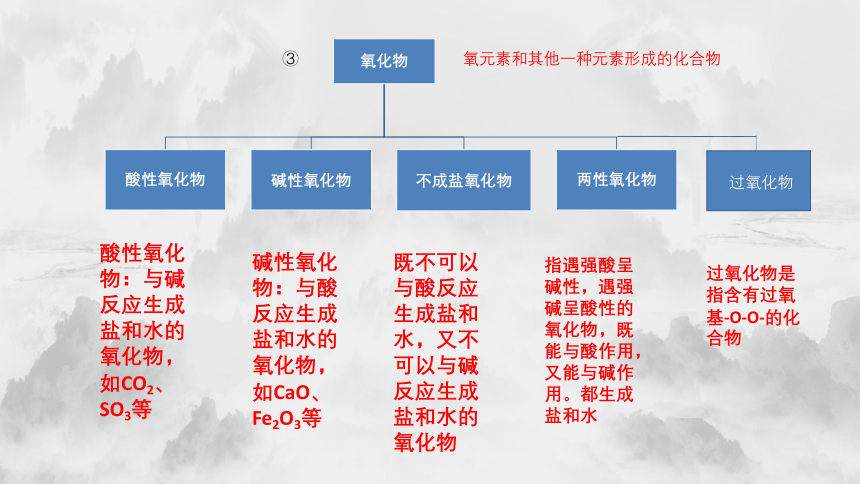
酸性氧化物:与碱反应生成盐和水的氧化物,如CO2、SO3等
碱性氧化物:与酸反应生成盐和水的氧化物,如CaO、Fe2O3等
氧元素和其他一种元素形成的化合物
过氧化物
既不可以与酸反应生成盐和水,又不可以与碱反应生成盐和水的氧化物
指遇强酸呈碱性,遇强碱呈酸性的氧化物,既能与酸作用,又能与碱作用。都生成盐和水
过氧化物是指含有过氧基-O-O-的化合物
③
判断对错
非金属氧化物一定是酸性氧化物,酸性氧化物一定是非金属氧化物
Mn2O7
P2O5
CO、NO
SO3,CO2
金属氧化物一定是碱性氧化物,碱性氧化物一定是金属氧化物
Na2O、CaO
BeO、Al2O3、Cr2O3、ZnO
下列物质分类的正确组合是( )
碱
酸
盐
酸性氧化物
A
纯碱
盐酸
烧碱
二氧化硫
B
烧碱
硫酸
食盐
一氧化碳
C
苛性钠
醋酸
石灰石
水
D
苛性钾
碳酸
苏打
三氧化硫
下列有关氧化物的叙述,正确的是( )
A.金属氧化物都是碱性氧化物 B.酸性氧化物在常温、 常压下都是气态
C.酸性氧化物都是非金属氧化物 D.碱性氧化物都是金属氧化物
D
D
2、分散系及其分类
(1)分散系的定义:把 物质分散在 物质中所得到的体系。
一种(或多种)
另一种(或多种)
(2)分散系的组成
分散质:分散系中被分散的物质
分散剂:分散系中被容纳的物质
(3)分散系的分类
按照分散质或分散剂所处状态的不同可将分散系分为9类。
分散系
胶 体
浊 液
溶 液
悬浊液
乳浊液
当分散剂是水或其他液体时,按照分散质粒子的大小来分:
按照分散质粒子的直径大小,可以把分散系分为溶液、胶体、浊液。
①溶液:分散质粒子直径小于1 nm。
② :分散质粒子直径介于1~100 nm之间。
③浊液:分散质粒子直径大于100 nm。
胶体
三者本质特征比较:
浊液
溶液
100nm
1nm
分散质粒子直径
可以通过滤纸
胶体是以粒子直径的大小为本质特征的
(4)胶体的分类及其性质
①分类:
液溶胶: Fe(OH)3胶体
气溶胶: 云、雾
固溶胶:有色玻璃
雾
白云
有色玻璃
固溶胶
气溶胶
液溶胶
②胶体的性质
胶体:分散质粒子的直径大小在1―100nm 之间的分散系(即胶体区别于其他分散系的本质特征)
溶液 、胶体、浊液的稳定性:
介稳性:胶体的稳定性介于 和 之间,在一定条件下能稳定存在,属于介稳体系。
溶液
浊液
Fe(OH)3胶体
红褐色,澄清透明
CuSO4 溶 液
蓝 色,澄清透明
泥 水
浑 浊,不 透 明
CuSO4 溶液
Fe(OH)3 胶体
光束照射时的现象
Fe(OH)3胶体
形成一条光亮的通路
CuSO4溶液
没有光亮的通路现象产生
丁达尔而效应
现象:当光束通过胶体时,可以看到 。
形成原因:胶体粒子对光线的散射作用。
应用:鉴别 。
一条光亮的“通路”
胶体与溶液
的分散质粒子不能通过半透膜,能通过滤纸孔隙, 的分散质粒子不能通过滤纸孔隙。溶液的分散质粒子能通过半透膜,
讨论:如何分离胶体和溶液的混合物
电泳:胶体粒子带有电荷,在电场的作用下,胶体粒子在分散剂里作 的现象叫做电泳。
定向移动
浊液
胶体
聚沉
概念:胶体的 被破坏,胶体粒子聚集成为较大的颗粒(悬浮粒子)而以沉淀形式从分散剂中析出,这称为胶体的聚沉。
使胶体聚沉的方法
中和胶体粒子的电性,消除胶体粒子间的相互排斥,从而使胶体粒子聚集成较大颗粒沉淀析出,可加入 电解质或与 的胶体。
或 :可加快胶体粒子运动的速率,增大胶体粒子之间的碰撞机会,从而使胶体粒子凝聚成较大颗粒而沉淀。
介稳性
少量
加热
搅拌
胶体粒子带相反电荷
③胶体的制备
Fe(OH)3胶体的制备
实验操作
实验现象:烧杯中液体呈红褐色。
Fe(OH)3胶体的制取
小烧杯中加入25 mL蒸馏水,加热煮沸,向沸水中逐滴加入5~6滴 溶液,继续煮沸至溶液呈 色,停止加热,即得Fe(OH)3胶体。
FeCl3饱和
红褐
④胶体的应用
改进材料的机械性能和光学性能:如制作有色玻璃。
医学上的应用:如疾病的治疗。
农业上的应用:如土壤的保肥作用。
日常生活中的应用:如明矾净水的原理、制豆腐的原理。
解释一些自然现象:如江河入海口形成三角洲。
下列属于分散系的是( )
A.Cl2 B.NaCl C.KClO3 D.盐酸
食盐分散到酒精中形成直径在1 nm~100 nm之间的超细粒子,这样的分散系是( )
A.悬浊液 B.溶液 C.胶体 D.乳浊液
现有如下各实验:①将1 g KNO3加入99 g水中 ②将1 g可溶性淀粉加入100 g水中,搅拌均匀后煮沸 ③将1 g Cu(OH)2粉末加入100 g水中,充分振荡 ④将0.1 g花生油加入10 g水中,充分振荡混匀 ⑤将96 mL酒精与5 mL水充分混合。(注:淀粉分子的直径在1 nm~100 nm之间)
其中所得到的分散系,属于溶液的有________(填序号,下同),属于胶体的有______,属于浊液的有________。
D
C
①⑤
②__
③④
二、物质的转化
一定条件下,不同类别的物质可以相互转化。研究物质的转化,不仅可以揭示物质转化所遵循的规律,更重要的是可以利用物质的转化制备新物质。
1、酸碱盐的性质
①酸及其性质
酸:电离时产生的阳离子全部都是氢离子。例如:H?SO?(硫酸),HCl(盐酸),HNO?(硝酸),H?CO?(碳酸)
②碱及其性质
碱:电离时产生的阴离子全部都是氢氧根离子。例如 :NaOH(氢氧化钠),KOH(氢氧化钾),Ca(OH)?(氢氧化钙),NH?·H?O,(氨水)
③盐及其性质
盐:电离时生成含有金属阳离子(或NH?+铵根)和酸根离子的化合物。例如:Na?CO?(碳酸钠),CuSO?(硫酸铜) ,NH?NO?(硝酸铵)
?
④酸碱盐涉及的化学反应类型、转化关系
2、物质的转化
根据物质的组成和性质,以及物质之间的转化关系,确定制取某类物质的可能方法
制取氢氧化钠
CaO?+?H?O?====?Ca(OH)??
Ca(OH)?+Na?CO??====CaCO?↓+2NaOH
NaHCO?+?Ca(OH)?====?CaCO?↓+?NaOH?+?H?O
2Na+2H?O====2NaOH+H?↑
2NaCl+2H?O[电解]?→2NaOH+Cl?↑+H?↑
下列物质间的转化不可能通过一步反应实现的是( D )
A.CuSO4―→Cu B.CaCO3―→Ca(NO3)2
C.Ca(OH)2―→NaOH D.碳单质―→K2CO3
谢谢观看
物质的分类
物质的转化
1、根据物质的组成和性质分类
2、分散系及其分类
1、酸碱盐的性质
2、物质的转化
第一节
物质的分类及转化
一、物质的分类
分类法是把某些特征相似的物体归类到一起的方法。
物以类聚
1、根据物质的组成和性质分类
根据物质的组成分类
(1)树状分类法:对同一类事物按照某些属性进行再分类的分类方式
特点:同一层次的物质 类别间一般是相互独立、没有交叉的。
单一分类标准有一定的局限,所能提供的信息少,对同一事物,我们可以从不同的角度,按不同的标准来分类。
如交叉分类法:
分类并没有唯一性,它会根据分类的标准不同而不同。
特点:物质类别间有相交叉的部分
(2)交叉分类法:
钠盐
钾盐
硫酸盐
碳酸盐
Na2CO3
Na2SO4
K2SO4
K2CO3
交叉分类法:根据物质不同的分类标准,对同一事物进行多种分类一种分类方式
根据物质的组成和性质对物质进行
根据物质组成是否单一
根据组成元素的异同
根据性质的差异
根据组成的差异
(3)
酸、碱、盐、氧化物还可以再分类
① 单质:单质是由同种元素组成的纯净物,元素在单质中存在时称为元素的游离态 。 如金刚石、石墨、C60、O2、O3、H2等
同素异形体:同一种元素形成的几种性质不同的单质
②化合物:化合物由两种或两种以上的元素组成的纯净物,元素在化合物中存在时称为元素的化合态
(4)几个概念
由一种元素组成的物质一定是单质
判断对错
酸性氧化物:与碱反应生成盐和水的氧化物,如CO2、SO3等
碱性氧化物:与酸反应生成盐和水的氧化物,如CaO、Fe2O3等
氧元素和其他一种元素形成的化合物
过氧化物
既不可以与酸反应生成盐和水,又不可以与碱反应生成盐和水的氧化物
指遇强酸呈碱性,遇强碱呈酸性的氧化物,既能与酸作用,又能与碱作用。都生成盐和水
过氧化物是指含有过氧基-O-O-的化合物
③
判断对错
非金属氧化物一定是酸性氧化物,酸性氧化物一定是非金属氧化物
Mn2O7
P2O5
CO、NO
SO3,CO2
金属氧化物一定是碱性氧化物,碱性氧化物一定是金属氧化物
Na2O、CaO
BeO、Al2O3、Cr2O3、ZnO
下列物质分类的正确组合是( )
碱
酸
盐
酸性氧化物
A
纯碱
盐酸
烧碱
二氧化硫
B
烧碱
硫酸
食盐
一氧化碳
C
苛性钠
醋酸
石灰石
水
D
苛性钾
碳酸
苏打
三氧化硫
下列有关氧化物的叙述,正确的是( )
A.金属氧化物都是碱性氧化物 B.酸性氧化物在常温、 常压下都是气态
C.酸性氧化物都是非金属氧化物 D.碱性氧化物都是金属氧化物
D
D
2、分散系及其分类
(1)分散系的定义:把 物质分散在 物质中所得到的体系。
一种(或多种)
另一种(或多种)
(2)分散系的组成
分散质:分散系中被分散的物质
分散剂:分散系中被容纳的物质
(3)分散系的分类
按照分散质或分散剂所处状态的不同可将分散系分为9类。
分散系
胶 体
浊 液
溶 液
悬浊液
乳浊液
当分散剂是水或其他液体时,按照分散质粒子的大小来分:
按照分散质粒子的直径大小,可以把分散系分为溶液、胶体、浊液。
①溶液:分散质粒子直径小于1 nm。
② :分散质粒子直径介于1~100 nm之间。
③浊液:分散质粒子直径大于100 nm。
胶体
三者本质特征比较:
浊液
溶液
100nm
1nm
分散质粒子直径
可以通过滤纸
胶体是以粒子直径的大小为本质特征的
(4)胶体的分类及其性质
①分类:
液溶胶: Fe(OH)3胶体
气溶胶: 云、雾
固溶胶:有色玻璃
雾
白云
有色玻璃
固溶胶
气溶胶
液溶胶
②胶体的性质
胶体:分散质粒子的直径大小在1―100nm 之间的分散系(即胶体区别于其他分散系的本质特征)
溶液 、胶体、浊液的稳定性:
介稳性:胶体的稳定性介于 和 之间,在一定条件下能稳定存在,属于介稳体系。
溶液
浊液
Fe(OH)3胶体
红褐色,澄清透明
CuSO4 溶 液
蓝 色,澄清透明
泥 水
浑 浊,不 透 明
CuSO4 溶液
Fe(OH)3 胶体
光束照射时的现象
Fe(OH)3胶体
形成一条光亮的通路
CuSO4溶液
没有光亮的通路现象产生
丁达尔而效应
现象:当光束通过胶体时,可以看到 。
形成原因:胶体粒子对光线的散射作用。
应用:鉴别 。
一条光亮的“通路”
胶体与溶液
的分散质粒子不能通过半透膜,能通过滤纸孔隙, 的分散质粒子不能通过滤纸孔隙。溶液的分散质粒子能通过半透膜,
讨论:如何分离胶体和溶液的混合物
电泳:胶体粒子带有电荷,在电场的作用下,胶体粒子在分散剂里作 的现象叫做电泳。
定向移动
浊液
胶体
聚沉
概念:胶体的 被破坏,胶体粒子聚集成为较大的颗粒(悬浮粒子)而以沉淀形式从分散剂中析出,这称为胶体的聚沉。
使胶体聚沉的方法
中和胶体粒子的电性,消除胶体粒子间的相互排斥,从而使胶体粒子聚集成较大颗粒沉淀析出,可加入 电解质或与 的胶体。
或 :可加快胶体粒子运动的速率,增大胶体粒子之间的碰撞机会,从而使胶体粒子凝聚成较大颗粒而沉淀。
介稳性
少量
加热
搅拌
胶体粒子带相反电荷
③胶体的制备
Fe(OH)3胶体的制备
实验操作
实验现象:烧杯中液体呈红褐色。
Fe(OH)3胶体的制取
小烧杯中加入25 mL蒸馏水,加热煮沸,向沸水中逐滴加入5~6滴 溶液,继续煮沸至溶液呈 色,停止加热,即得Fe(OH)3胶体。
FeCl3饱和
红褐
④胶体的应用
改进材料的机械性能和光学性能:如制作有色玻璃。
医学上的应用:如疾病的治疗。
农业上的应用:如土壤的保肥作用。
日常生活中的应用:如明矾净水的原理、制豆腐的原理。
解释一些自然现象:如江河入海口形成三角洲。
下列属于分散系的是( )
A.Cl2 B.NaCl C.KClO3 D.盐酸
食盐分散到酒精中形成直径在1 nm~100 nm之间的超细粒子,这样的分散系是( )
A.悬浊液 B.溶液 C.胶体 D.乳浊液
现有如下各实验:①将1 g KNO3加入99 g水中 ②将1 g可溶性淀粉加入100 g水中,搅拌均匀后煮沸 ③将1 g Cu(OH)2粉末加入100 g水中,充分振荡 ④将0.1 g花生油加入10 g水中,充分振荡混匀 ⑤将96 mL酒精与5 mL水充分混合。(注:淀粉分子的直径在1 nm~100 nm之间)
其中所得到的分散系,属于溶液的有________(填序号,下同),属于胶体的有______,属于浊液的有________。
D
C
①⑤
②__
③④
二、物质的转化
一定条件下,不同类别的物质可以相互转化。研究物质的转化,不仅可以揭示物质转化所遵循的规律,更重要的是可以利用物质的转化制备新物质。
1、酸碱盐的性质
①酸及其性质
酸:电离时产生的阳离子全部都是氢离子。例如:H?SO?(硫酸),HCl(盐酸),HNO?(硝酸),H?CO?(碳酸)
②碱及其性质
碱:电离时产生的阴离子全部都是氢氧根离子。例如 :NaOH(氢氧化钠),KOH(氢氧化钾),Ca(OH)?(氢氧化钙),NH?·H?O,(氨水)
③盐及其性质
盐:电离时生成含有金属阳离子(或NH?+铵根)和酸根离子的化合物。例如:Na?CO?(碳酸钠),CuSO?(硫酸铜) ,NH?NO?(硝酸铵)
?
④酸碱盐涉及的化学反应类型、转化关系
2、物质的转化
根据物质的组成和性质,以及物质之间的转化关系,确定制取某类物质的可能方法
制取氢氧化钠
CaO?+?H?O?====?Ca(OH)??
Ca(OH)?+Na?CO??====CaCO?↓+2NaOH
NaHCO?+?Ca(OH)?====?CaCO?↓+?NaOH?+?H?O
2Na+2H?O====2NaOH+H?↑
2NaCl+2H?O[电解]?→2NaOH+Cl?↑+H?↑
下列物质间的转化不可能通过一步反应实现的是( D )
A.CuSO4―→Cu B.CaCO3―→Ca(NO3)2
C.Ca(OH)2―→NaOH D.碳单质―→K2CO3
谢谢观看
