湖北省黄冈市2020-2021学年高二上学期期末考试化学试题 Word版含答案
文档属性
| 名称 | 湖北省黄冈市2020-2021学年高二上学期期末考试化学试题 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-27 21:34:19 | ||
图片预览



文档简介
黄冈市2020年秋季高二年级期末调研考试
化学试题
注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。卷面总分100分。考试时间90分钟。
2.请将试题的答案填写在“答题卷”中,否则作零分处理。
可能用到的相对原子质量:-1 -16 -23 -31 -32 -55 -64
第Ⅰ卷(选择题,共40分)
一、选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求)
1. 2020年为防止新冠肺炎疫情蔓延,防疫人员使用了多种消毒剂进行环境消毒。下列关于常见消毒剂的说法中不正确的是()
A. 次氯酸HClO分子空间构型为直线形
B. 浓度为75%的医用酒精消毒效果比95%的好
C. 1mol过氧乙酸()分子中σ键数目为8NA
D. 饱和氯水既有酸性又有漂白性,向其中加入NaHCO3固体后漂白性增强
2. 下列说法中正确的是()
A. 甲烷燃烧时只有化学能转化为热能
B. 轮船在海水中发生的腐蚀主要是析氢腐蚀
C. 反应能自发进行,则该反应为放热反应
D. 常温下,pH=2的醋酸溶液与pH=12的NaOH溶液混合后溶液呈酸性
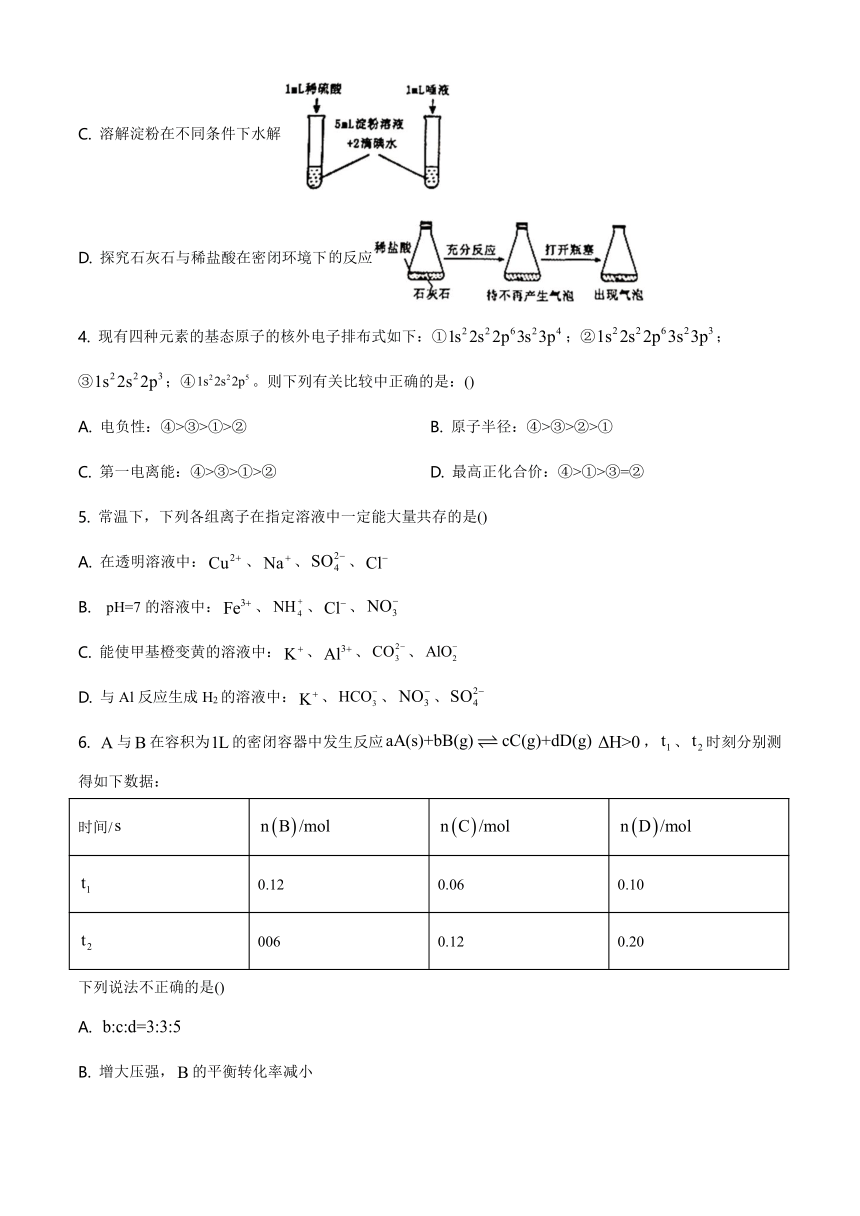
3. 下列实验操作或现象不能用平衡移动原理解释的是()
A. 卤化银沉淀的转化
B. 配制溶液
C. 溶解淀粉在不同条件下水解
D. 探究石灰石与稀盐酸在密闭环境下反应
4. 现有四种元素的基态原子的核外电子排布式如下:①;②;③;④。则下列有关比较中正确的是:()
A. 电负性:④>③>①>② B. 原子半径:④>③>②>①
C. 第一电离能:④>③>①>② D. 最高正化合价:④>①>③=②
5. 常温下,下列各组离子在指定溶液中一定能大量共存的是()
A. 在透明溶液中:、、、
B. pH=7的溶液中:、、、
C. 能使甲基橙变黄的溶液中:、、、
D. 与Al反应生成H2的溶液中:、、、
6. 与在容积为的密闭容器中发生反应,、时刻分别测得如下数据:
时间/
0.12 0.06 0.10
006 0.12 0.20
下列说法不正确的是()
A.
B. 增大压强,的平衡转化率减小
C. 某时刻反应达到平衡,升高体系温度平衡正向移动
D. 若起始只投入了和,则在时刻
7. 室温下,氨水用盐酸滴定,滴定曲线如图,下列说法正确的是
A. 该中和滴定最好选用酚酞作指示剂
B. 两者恰好中和时,溶液的
C. 当滴入盐酸达时,溶液中:
D. 当滴入盐酸达时,溶液中
8. 下表列出了前20号元素中的某些元素性质的有关数据
元素编号 元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
原子半径(10-10m) 1.52 2.27 0.74 1.43 0.77 1.1 0.99 1.86 0.75 0.71
最高价态 +1 +1 —— +3 +4 +5 +7 +1 +5 ——
最低价态 —— —— -2 —— -4 -3 -1 —— -3 -1
第三周期元素R的原子半径为1.02×10-10m,下列有关叙述不正确的是()
A. 元素R的最高正价为+6
B. 以上10种元素的原子中,失去核外第一个电子所需能量最少的是②
C. 若物质Na2R4是一种含有非极性共价键的离子化合物,则其化合物的电子式
D. 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4
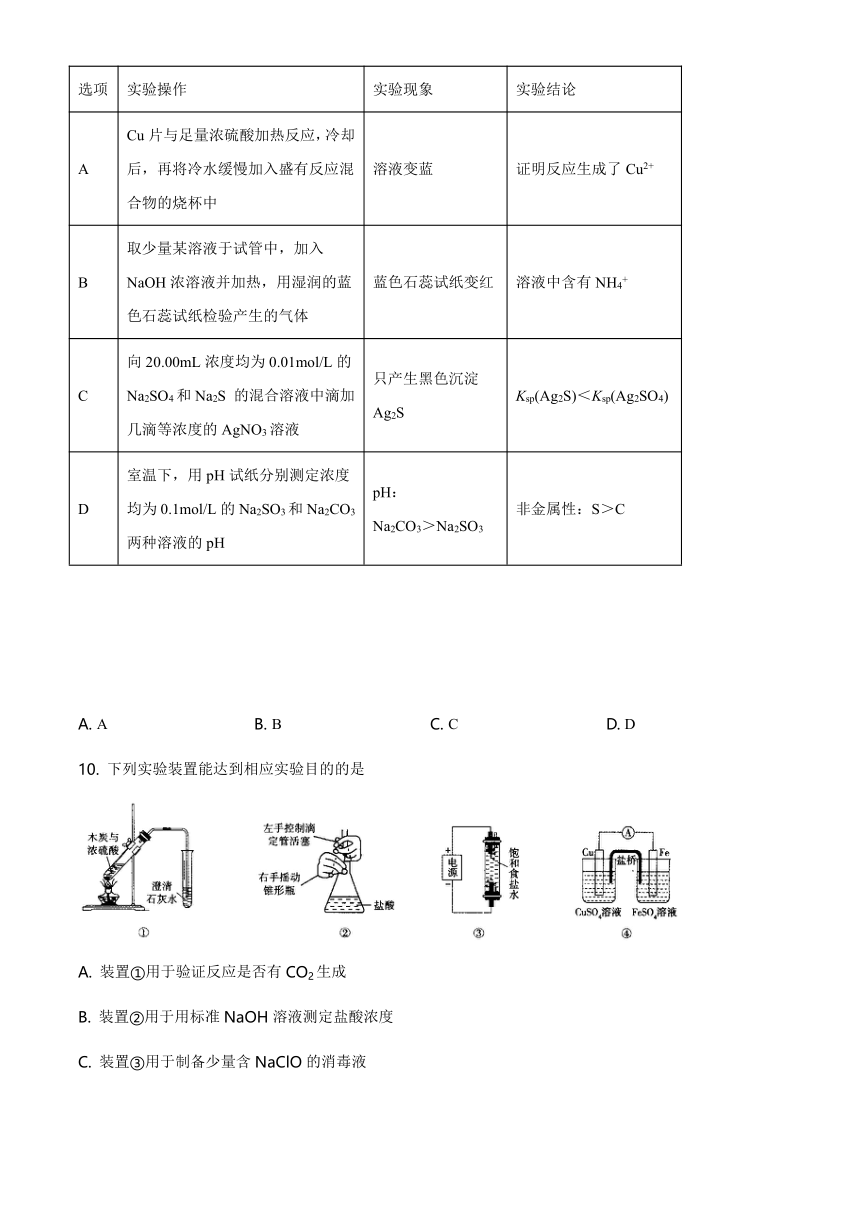
9. 下列实验操作、现象及得出的结论均正确的是
选项 实验操作 实验现象 实验结论
A Cu片与足量浓硫酸加热反应,冷却后,再将冷水缓慢加入盛有反应混合物的烧杯中 溶液变蓝 证明反应生成了Cu2+
B 取少量某溶液于试管中,加入NaOH浓溶液并加热,用湿润的蓝色石蕊试纸检验产生的气体 蓝色石蕊试纸变红 溶液中含有NH4+
C 向20.00mL浓度均为0.01mol/L的Na2SO4和Na2S 的混合溶液中滴加几滴等浓度的AgNO3溶液 只产生黑色沉淀Ag2S Ksp(Ag2S)<Ksp(Ag2SO4)
D 室温下,用pH试纸分别测定浓度均为0.1mol/L的Na2SO3和Na2CO3两种溶液的pH pH:
Na2CO3>Na2SO3 非金属性:S>C
A. A B. B C. C D. D
10. 下列实验装置能达到相应实验目的的是
A. 装置①用于验证反应是否有CO2生成
B. 装置②用于用标准NaOH溶液测定盐酸浓度
C. 装置③用于制备少量含NaClO的消毒液
D. 装置④用于比较铜、铁活泼性强弱
二、选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对的得4分,选对但不全的得2分,有错选的得0分)
11. 下列叙述正确的是()
A. 和分子都是含极性键的极性分子
B. 分子稳定性低于分子,因为键键能高
C. 为正四面体结构,可推测出也为正四面体结构
D. 汽化成水蒸气、分解为和都需要破坏共价键
12. 室温下,下列溶液中有关微粒的物质的量浓度关系正确的是()
A. 与盐酸等体积混合后,溶液呈碱性,则有
B. 的和混合溶液:
C. 相等的①溶液、②溶液、③溶液、④溶液,其物质的量浓度由大到小的顺序为②>④>③>①
D. 浓度比为的、混合溶液:
13. 常温下,用溶液分别滴定浓度均为0.01 mol?L?1的、溶液,所得的沉淀溶解平衡图像如图所示(不考虑的水解)。下列叙述正确的是()
A. 点表示的不饱和溶液
B. 的数量级等于
C. 的平衡常数为
D. 向的混合液中滴入溶液时,先生成沉淀
14. 在一定条件下,取一定量的A和B在恒容密闭容器中发生反应:aA(g)+bB(s)mM(g)+nN(g) ?H=QkJ/mol,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断正确的是( )
A. a+b<m+n
B. E点的平衡常数小于F点的平衡常数
C. 容器内混合气体的密度不变可证明反应达到平衡
D. 达到平衡后,加入B将会提高A的转化率
15. 最近,科学家报道了一种新型可充电钠电池,其工作原理如图所示,下列说法正确的是()
A. 放电时,极为负极
B. 充电时,向极迁移
C. 电极材料中,单位质量金属放出的电能:
D. 放电时,极反应为
第Ⅱ卷(非选择题 共60分)
三、非选择题(本题共5小题,共60分)
16. 请按要求填空:
(1)已知25℃时,测得浓度为0.1mol/L的BOH溶液中,c(OH-)=1×10-3mol/L。写出BOH的电离方程式:___________。
(2) 25℃时,amol/L NH3?H2O溶液的pH=b,用含a和b的代数式表示NH3?H2O的电离平衡常数Kb=___________(要求精确计算)。
(3)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3,反应结束后溶液中离子浓度由大到小的顺序是___________;在通入NH3的过程中溶液的导电能力___________(选填“变大”、“变小”、“几乎不变”)。
(4)室温下,将物质的量浓度相同的CH3COOH和NaOH溶液混合后,溶液中CH3COO-和Na+浓度相等,则混合后溶液的pH___________7(选填“>”、“<”或“=”,下同),所用醋酸体积___________氢氧化钠溶液体积。
17. 在催化剂条件下利用反应进行脱硫具有广阔的工业化前景。请回答下列问题:
(1)在恒温恒压的容器中模拟回收硫,加入起始量均为,测得的平衡体积分数随和的投料比变化如图1:
①当投料比为2时,时测得转化率为,则用的生成速率表示的反应速率___________。
②当投料比为3时,的平衡体积分数对应的点是___________。
(2)恒温向体积均为的密闭容器通入和。反应体系总压强随时间的变化如图2:
①相对于Ⅰ,Ⅱ改变的外界条件是___________。
②的平衡转化率为___________,平衡常数___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)若采用电解法处理尾气可制备保险粉()电解装置如图,则___________(填“”“”或“”),生成的电极反应式为___________。
18. 已知、、、、、是原子序数依次增大的前30号元素,其中、、、、均为短周期主族元素,元素是宇宙中含量最高的元素,元素基态原子的核外有3个能级,每个能级上的电子数都相同;的最外层电子数与能层数之比为;和元素同主族;是第四周期元素,最外层只有一个电子,其余各层电子均充满。回答下列问题(用元素符号或化学式表示):
(1)在元素周期表中的位置为___________。
(2)分别与、、能形成10电子的化合物,它们的沸点由高到低的顺序是___________(填化学式)。
(3)分子中的杂化方式是___________,其空间立体构型为___________。
(4)气态分子结构如图所示,已知断裂吸收的热量,生成放出热量。试写出由气态分子变成态分子的热化学方程式___________。
(5)已知可溶于稀硫酸,可以获得单质和蓝色溶液,请写出离子方程式___________。
19. 工业上利用软锰矿为原料来制备锰的化合物,相关流程概述如下。请根据信息回答下列问题。
(1)软锰矿的酸浸处理
①过程中可以提高锰元素浸出速率的方法有:___________,___________(写出两种)。
②酸浸过程中的主要反应(将方程式补充完整):___________
(2)过程Ⅰ:工业上采用电解溶液的方法制备二氧化锰,则二氧化锰在___________(填“阳”或“阴”)极生成,该电极反应式为:___________。
(3)过程Ⅱ:制备
难溶于水、能溶于强酸,可用溶液和溶液混合制备。每制得,至少消耗的体积为___________。
20. 已知:硫酸、硒酸、亚磷酸等是二元酸。请根据所给信息完成下列问题。
(1)硒酸(H2SeO4)在水溶液中电离如下:,,。
①向溶液中滴加少量氨水,该反应的离子方程式为___________。
②已知的电离平衡常数,,则和两溶液混合反应的离子方程式为:___________。
(2)亚磷酸()是二元弱酸,已知常温下的电离常数的值:,。则溶液显___________性。(选填“酸”、“碱”或“中”)
(3)某化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸()具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为:。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:___________。
②已知三次滴定的测量数据如下表,该亚磷酸溶液的物质的量浓度为______。(保留小数点后两位)
试验编号 滴定前读数(mL) 滴定后读数(mL)
1 0.00 22.00
2 0.50 22.50
3 0.50 25.50
(4)某研究性学习小组在实验室中配制的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是___________。
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
黄冈市2020年秋季高二年级期末调研考试
化学试题(答案)
注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。卷面总分100分。考试时间90分钟。
2.请将试题的答案填写在“答题卷”中,否则作零分处理。
可能用到的相对原子质量:-1 -16 -23 -31 -32 -55 -64
第Ⅰ卷(选择题,共40分)
一、选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求)
1. 2020年为防止新冠肺炎疫情蔓延,防疫人员使用了多种消毒剂进行环境消毒。下列关于常见消毒剂的说法中不正确的是()
A. 次氯酸HClO分子空间构型为直线形
B. 浓度为75%的医用酒精消毒效果比95%的好
C. 1mol过氧乙酸()分子中σ键数目为8NA
D. 饱和氯水既有酸性又有漂白性,向其中加入NaHCO3固体后漂白性增强
【答案】A
2. 下列说法中正确的是()
A. 甲烷燃烧时只有化学能转化为热能
B. 轮船在海水中发生的腐蚀主要是析氢腐蚀
C. 反应能自发进行,则该反应为放热反应
D. 常温下,pH=2的醋酸溶液与pH=12的NaOH溶液混合后溶液呈酸性
【答案】C
3. 下列实验操作或现象不能用平衡移动原理解释的是()
A. 卤化银沉淀的转化
B. 配制溶液
C. 溶解淀粉在不同条件下水解
D. 探究石灰石与稀盐酸在密闭环境下反应
【答案】C
4. 现有四种元素的基态原子的核外电子排布式如下:①;②;③;④。则下列有关比较中正确的是:()
A. 电负性:④>③>①>② B. 原子半径:④>③>②>①
C. 第一电离能:④>③>①>② D. 最高正化合价:④>①>③=②
【答案】A
5. 常温下,下列各组离子在指定溶液中一定能大量共存的是()
A. 在透明溶液中:、、、
B. pH=7的溶液中:、、、
C. 能使甲基橙变黄的溶液中:、、、
D. 与Al反应生成H2的溶液中:、、、
【答案】A
6. 与在容积为的密闭容器中发生反应,、时刻分别测得如下数据:
时间/
0.12 0.06 0.10
006 0.12 0.20
下列说法不正确的是()
A.
B. 增大压强,的平衡转化率减小
C. 某时刻反应达到平衡,升高体系温度平衡正向移动
D. 若起始只投入了和,则在时刻
【答案】D
7. 室温下,氨水用盐酸滴定,滴定曲线如图,下列说法正确的是
A. 该中和滴定最好选用酚酞作指示剂
B. 两者恰好中和时,溶液的
C. 当滴入盐酸达时,溶液中:
D. 当滴入盐酸达时,溶液中
【答案】C
8. 下表列出了前20号元素中的某些元素性质的有关数据
元素编号 元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
原子半径(10-10m) 1.52 2.27 0.74 1.43 0.77 1.1 0.99 1.86 0.75 0.71
最高价态 +1 +1 —— +3 +4 +5 +7 +1 +5 ——
最低价态 —— —— -2 —— -4 -3 -1 —— -3 -1
第三周期元素R的原子半径为1.02×10-10m,下列有关叙述不正确的是()
A. 元素R的最高正价为+6
B. 以上10种元素的原子中,失去核外第一个电子所需能量最少的是②
C. 若物质Na2R4是一种含有非极性共价键的离子化合物,则其化合物的电子式
D. 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4
【答案】D
9. 下列实验操作、现象及得出的结论均正确的是
选项 实验操作 实验现象 实验结论
A Cu片与足量浓硫酸加热反应,冷却后,再将冷水缓慢加入盛有反应混合物的烧杯中 溶液变蓝 证明反应生成了Cu2+
B 取少量某溶液于试管中,加入NaOH浓溶液并加热,用湿润的蓝色石蕊试纸检验产生的气体 蓝色石蕊试纸变红 溶液中含有NH4+
C 向20.00mL浓度均为0.01mol/L的Na2SO4和Na2S 的混合溶液中滴加几滴等浓度的AgNO3溶液 只产生黑色沉淀Ag2S Ksp(Ag2S)<Ksp(Ag2SO4)
D 室温下,用pH试纸分别测定浓度均为0.1mol/L的Na2SO3和Na2CO3两种溶液的pH pH:
Na2CO3>Na2SO3 非金属性:S>C
A. A B. B C. C D. D
【答案】C
10. 下列实验装置能达到相应实验目的的是
A. 装置①用于验证反应是否有CO2生成
B. 装置②用于用标准NaOH溶液测定盐酸浓度
C. 装置③用于制备少量含NaClO的消毒液
D. 装置④用于比较铜、铁活泼性强弱
【答案】D
二、选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对的得4分,选对但不全的得2分,有错选的得0分)
11. 下列叙述正确的是()
A. 和分子都是含极性键的极性分子
B. 分子稳定性低于分子,因为键键能高
C. 为正四面体结构,可推测出也为正四面体结构
D. 汽化成水蒸气、分解为和都需要破坏共价键
【答案】BC
12. 室温下,下列溶液中有关微粒的物质的量浓度关系正确的是()
A. 与盐酸等体积混合后,溶液呈碱性,则有
B. 的和混合溶液:
C. 相等的①溶液、②溶液、③溶液、④溶液,其物质的量浓度由大到小的顺序为②>④>③>①
D. 浓度比为的、混合溶液:
【答案】B
13. 常温下,用溶液分别滴定浓度均为0.01 mol?L?1的、溶液,所得的沉淀溶解平衡图像如图所示(不考虑的水解)。下列叙述正确的是()
A. 点表示的不饱和溶液
B. 的数量级等于
C. 的平衡常数为
D. 向的混合液中滴入溶液时,先生成沉淀
【答案】BC
14. 在一定条件下,取一定量的A和B在恒容密闭容器中发生反应:aA(g)+bB(s)mM(g)+nN(g) ?H=QkJ/mol,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断正确的是( )
A. a+b<m+n
B. E点的平衡常数小于F点的平衡常数
C. 容器内混合气体的密度不变可证明反应达到平衡
D. 达到平衡后,加入B将会提高A的转化率
【答案】BC
15. 最近,科学家报道了一种新型可充电钠电池,其工作原理如图所示,下列说法正确的是()
A. 放电时,极为负极
B. 充电时,向极迁移
C. 电极材料中,单位质量金属放出的电能:
D. 放电时,极反应为
【答案】AC
第Ⅱ卷(非选择题 共60分)
三、非选择题(本题共5小题,共60分)
16. 请按要求填空:
(1)已知25℃时,测得浓度为0.1mol/L的BOH溶液中,c(OH-)=1×10-3mol/L。写出BOH的电离方程式:___________。
(2) 25℃时,amol/L NH3?H2O溶液的pH=b,用含a和b的代数式表示NH3?H2O的电离平衡常数Kb=___________(要求精确计算)。
(3)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3,反应结束后溶液中离子浓度由大到小的顺序是___________;在通入NH3的过程中溶液的导电能力___________(选填“变大”、“变小”、“几乎不变”)。
(4)室温下,将物质的量浓度相同的CH3COOH和NaOH溶液混合后,溶液中CH3COO-和Na+浓度相等,则混合后溶液的pH___________7(选填“>”、“<”或“=”,下同),所用醋酸体积___________氢氧化钠溶液体积。
【答案】 (1). BOH?B++OH- (2). (3). c(Cl-)>c(NH)>c(H+)>c(OH-) (4). 几乎不变 (5). (6).
17. 在催化剂条件下利用反应进行脱硫具有广阔的工业化前景。请回答下列问题:
(1)在恒温恒压的容器中模拟回收硫,加入起始量均为,测得的平衡体积分数随和的投料比变化如图1:
①当投料比为2时,时测得转化率为,则用的生成速率表示的反应速率___________。
②当投料比为3时,的平衡体积分数对应的点是___________。
(2)恒温向体积均为的密闭容器通入和。反应体系总压强随时间的变化如图2:
①相对于Ⅰ,Ⅱ改变的外界条件是___________。
②的平衡转化率为___________,平衡常数___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)若采用电解法处理尾气可制备保险粉()电解装置如图,则___________(填“”“”或“”),生成的电极反应式为___________。
【答案】 (1). (2). C (3). 使用(或使用更高效)催化剂 (4). (5). 0.675 (6). (7).
18. 已知、、、、、是原子序数依次增大的前30号元素,其中、、、、均为短周期主族元素,元素是宇宙中含量最高的元素,元素基态原子的核外有3个能级,每个能级上的电子数都相同;的最外层电子数与能层数之比为;和元素同主族;是第四周期元素,最外层只有一个电子,其余各层电子均充满。回答下列问题(用元素符号或化学式表示):
(1)在元素周期表中的位置为___________。
(2)分别与、、能形成10电子的化合物,它们的沸点由高到低的顺序是___________(填化学式)。
(3)分子中的杂化方式是___________,其空间立体构型为___________。
(4)气态分子结构如图所示,已知断裂吸收的热量,生成放出热量。试写出由气态分子变成态分子的热化学方程式___________。
(5)已知可溶于稀硫酸,可以获得单质和蓝色溶液,请写出离子方程式___________。
【答案】 (1). 第四周期ⅠB族 (2). H2O>NH3>CH4 (3). sp2 (4). V形 (5). N4(g)=2N2(g) ΔH=-882kJ/mol (6).
19. 工业上利用软锰矿为原料来制备锰的化合物,相关流程概述如下。请根据信息回答下列问题。
(1)软锰矿的酸浸处理
①过程中可以提高锰元素浸出速率的方法有:___________,___________(写出两种)。
②酸浸过程中的主要反应(将方程式补充完整):___________
(2)过程Ⅰ:工业上采用电解溶液的方法制备二氧化锰,则二氧化锰在___________(填“阳”或“阴”)极生成,该电极反应式为:___________。
(3)过程Ⅱ:制备
难溶于水、能溶于强酸,可用溶液和溶液混合制备。每制得,至少消耗的体积为___________。
【答案】 (1). 加热 (2). 将矿石磨成粉 (3). 2FeS2+3MnO2+12H+=3Mn2++2Fe3++4S+6H2O
(4). 阳 (5). (6).
20. 已知:硫酸、硒酸、亚磷酸等是二元酸。请根据所给信息完成下列问题。
(1)硒酸(H2SeO4)在水溶液中电离如下:,,。
①向溶液中滴加少量氨水,该反应的离子方程式为___________。
②已知的电离平衡常数,,则和两溶液混合反应的离子方程式为:___________。
(2)亚磷酸()是二元弱酸,已知常温下的电离常数的值:,。则溶液显___________性。(选填“酸”、“碱”或“中”)
(3)某化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸()具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为:。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:___________。
②已知三次滴定的测量数据如下表,该亚磷酸溶液的物质的量浓度为______。(保留小数点后两位)
试验编号 滴定前读数(mL) 滴定后读数(mL)
1 0.00 22.00
2 0.50 22.50
3 0.50 25.50
(4)某研究性学习小组在实验室中配制的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是___________。
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
【答案】 (1). (2). (3). 酸 (4). 滴入最后一滴KMnO4标准溶液,锥形瓶内液体由无色变为红色,且半分钟内不褪色 (5). 0.22mol/L (6). ABD
化学试题
注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。卷面总分100分。考试时间90分钟。
2.请将试题的答案填写在“答题卷”中,否则作零分处理。
可能用到的相对原子质量:-1 -16 -23 -31 -32 -55 -64
第Ⅰ卷(选择题,共40分)
一、选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求)
1. 2020年为防止新冠肺炎疫情蔓延,防疫人员使用了多种消毒剂进行环境消毒。下列关于常见消毒剂的说法中不正确的是()
A. 次氯酸HClO分子空间构型为直线形
B. 浓度为75%的医用酒精消毒效果比95%的好
C. 1mol过氧乙酸()分子中σ键数目为8NA
D. 饱和氯水既有酸性又有漂白性,向其中加入NaHCO3固体后漂白性增强
2. 下列说法中正确的是()
A. 甲烷燃烧时只有化学能转化为热能
B. 轮船在海水中发生的腐蚀主要是析氢腐蚀
C. 反应能自发进行,则该反应为放热反应
D. 常温下,pH=2的醋酸溶液与pH=12的NaOH溶液混合后溶液呈酸性
3. 下列实验操作或现象不能用平衡移动原理解释的是()
A. 卤化银沉淀的转化
B. 配制溶液
C. 溶解淀粉在不同条件下水解
D. 探究石灰石与稀盐酸在密闭环境下反应
4. 现有四种元素的基态原子的核外电子排布式如下:①;②;③;④。则下列有关比较中正确的是:()
A. 电负性:④>③>①>② B. 原子半径:④>③>②>①
C. 第一电离能:④>③>①>② D. 最高正化合价:④>①>③=②
5. 常温下,下列各组离子在指定溶液中一定能大量共存的是()
A. 在透明溶液中:、、、
B. pH=7的溶液中:、、、
C. 能使甲基橙变黄的溶液中:、、、
D. 与Al反应生成H2的溶液中:、、、
6. 与在容积为的密闭容器中发生反应,、时刻分别测得如下数据:
时间/
0.12 0.06 0.10
006 0.12 0.20
下列说法不正确的是()
A.
B. 增大压强,的平衡转化率减小
C. 某时刻反应达到平衡,升高体系温度平衡正向移动
D. 若起始只投入了和,则在时刻
7. 室温下,氨水用盐酸滴定,滴定曲线如图,下列说法正确的是
A. 该中和滴定最好选用酚酞作指示剂
B. 两者恰好中和时,溶液的
C. 当滴入盐酸达时,溶液中:
D. 当滴入盐酸达时,溶液中
8. 下表列出了前20号元素中的某些元素性质的有关数据
元素编号 元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
原子半径(10-10m) 1.52 2.27 0.74 1.43 0.77 1.1 0.99 1.86 0.75 0.71
最高价态 +1 +1 —— +3 +4 +5 +7 +1 +5 ——
最低价态 —— —— -2 —— -4 -3 -1 —— -3 -1
第三周期元素R的原子半径为1.02×10-10m,下列有关叙述不正确的是()
A. 元素R的最高正价为+6
B. 以上10种元素的原子中,失去核外第一个电子所需能量最少的是②
C. 若物质Na2R4是一种含有非极性共价键的离子化合物,则其化合物的电子式
D. 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4
9. 下列实验操作、现象及得出的结论均正确的是
选项 实验操作 实验现象 实验结论
A Cu片与足量浓硫酸加热反应,冷却后,再将冷水缓慢加入盛有反应混合物的烧杯中 溶液变蓝 证明反应生成了Cu2+
B 取少量某溶液于试管中,加入NaOH浓溶液并加热,用湿润的蓝色石蕊试纸检验产生的气体 蓝色石蕊试纸变红 溶液中含有NH4+
C 向20.00mL浓度均为0.01mol/L的Na2SO4和Na2S 的混合溶液中滴加几滴等浓度的AgNO3溶液 只产生黑色沉淀Ag2S Ksp(Ag2S)<Ksp(Ag2SO4)
D 室温下,用pH试纸分别测定浓度均为0.1mol/L的Na2SO3和Na2CO3两种溶液的pH pH:
Na2CO3>Na2SO3 非金属性:S>C
A. A B. B C. C D. D
10. 下列实验装置能达到相应实验目的的是
A. 装置①用于验证反应是否有CO2生成
B. 装置②用于用标准NaOH溶液测定盐酸浓度
C. 装置③用于制备少量含NaClO的消毒液
D. 装置④用于比较铜、铁活泼性强弱
二、选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对的得4分,选对但不全的得2分,有错选的得0分)
11. 下列叙述正确的是()
A. 和分子都是含极性键的极性分子
B. 分子稳定性低于分子,因为键键能高
C. 为正四面体结构,可推测出也为正四面体结构
D. 汽化成水蒸气、分解为和都需要破坏共价键
12. 室温下,下列溶液中有关微粒的物质的量浓度关系正确的是()
A. 与盐酸等体积混合后,溶液呈碱性,则有
B. 的和混合溶液:
C. 相等的①溶液、②溶液、③溶液、④溶液,其物质的量浓度由大到小的顺序为②>④>③>①
D. 浓度比为的、混合溶液:
13. 常温下,用溶液分别滴定浓度均为0.01 mol?L?1的、溶液,所得的沉淀溶解平衡图像如图所示(不考虑的水解)。下列叙述正确的是()
A. 点表示的不饱和溶液
B. 的数量级等于
C. 的平衡常数为
D. 向的混合液中滴入溶液时,先生成沉淀
14. 在一定条件下,取一定量的A和B在恒容密闭容器中发生反应:aA(g)+bB(s)mM(g)+nN(g) ?H=QkJ/mol,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断正确的是( )
A. a+b<m+n
B. E点的平衡常数小于F点的平衡常数
C. 容器内混合气体的密度不变可证明反应达到平衡
D. 达到平衡后,加入B将会提高A的转化率
15. 最近,科学家报道了一种新型可充电钠电池,其工作原理如图所示,下列说法正确的是()
A. 放电时,极为负极
B. 充电时,向极迁移
C. 电极材料中,单位质量金属放出的电能:
D. 放电时,极反应为
第Ⅱ卷(非选择题 共60分)
三、非选择题(本题共5小题,共60分)
16. 请按要求填空:
(1)已知25℃时,测得浓度为0.1mol/L的BOH溶液中,c(OH-)=1×10-3mol/L。写出BOH的电离方程式:___________。
(2) 25℃时,amol/L NH3?H2O溶液的pH=b,用含a和b的代数式表示NH3?H2O的电离平衡常数Kb=___________(要求精确计算)。
(3)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3,反应结束后溶液中离子浓度由大到小的顺序是___________;在通入NH3的过程中溶液的导电能力___________(选填“变大”、“变小”、“几乎不变”)。
(4)室温下,将物质的量浓度相同的CH3COOH和NaOH溶液混合后,溶液中CH3COO-和Na+浓度相等,则混合后溶液的pH___________7(选填“>”、“<”或“=”,下同),所用醋酸体积___________氢氧化钠溶液体积。
17. 在催化剂条件下利用反应进行脱硫具有广阔的工业化前景。请回答下列问题:
(1)在恒温恒压的容器中模拟回收硫,加入起始量均为,测得的平衡体积分数随和的投料比变化如图1:
①当投料比为2时,时测得转化率为,则用的生成速率表示的反应速率___________。
②当投料比为3时,的平衡体积分数对应的点是___________。
(2)恒温向体积均为的密闭容器通入和。反应体系总压强随时间的变化如图2:
①相对于Ⅰ,Ⅱ改变的外界条件是___________。
②的平衡转化率为___________,平衡常数___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)若采用电解法处理尾气可制备保险粉()电解装置如图,则___________(填“”“”或“”),生成的电极反应式为___________。
18. 已知、、、、、是原子序数依次增大的前30号元素,其中、、、、均为短周期主族元素,元素是宇宙中含量最高的元素,元素基态原子的核外有3个能级,每个能级上的电子数都相同;的最外层电子数与能层数之比为;和元素同主族;是第四周期元素,最外层只有一个电子,其余各层电子均充满。回答下列问题(用元素符号或化学式表示):
(1)在元素周期表中的位置为___________。
(2)分别与、、能形成10电子的化合物,它们的沸点由高到低的顺序是___________(填化学式)。
(3)分子中的杂化方式是___________,其空间立体构型为___________。
(4)气态分子结构如图所示,已知断裂吸收的热量,生成放出热量。试写出由气态分子变成态分子的热化学方程式___________。
(5)已知可溶于稀硫酸,可以获得单质和蓝色溶液,请写出离子方程式___________。
19. 工业上利用软锰矿为原料来制备锰的化合物,相关流程概述如下。请根据信息回答下列问题。
(1)软锰矿的酸浸处理
①过程中可以提高锰元素浸出速率的方法有:___________,___________(写出两种)。
②酸浸过程中的主要反应(将方程式补充完整):___________
(2)过程Ⅰ:工业上采用电解溶液的方法制备二氧化锰,则二氧化锰在___________(填“阳”或“阴”)极生成,该电极反应式为:___________。
(3)过程Ⅱ:制备
难溶于水、能溶于强酸,可用溶液和溶液混合制备。每制得,至少消耗的体积为___________。
20. 已知:硫酸、硒酸、亚磷酸等是二元酸。请根据所给信息完成下列问题。
(1)硒酸(H2SeO4)在水溶液中电离如下:,,。
①向溶液中滴加少量氨水,该反应的离子方程式为___________。
②已知的电离平衡常数,,则和两溶液混合反应的离子方程式为:___________。
(2)亚磷酸()是二元弱酸,已知常温下的电离常数的值:,。则溶液显___________性。(选填“酸”、“碱”或“中”)
(3)某化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸()具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为:。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:___________。
②已知三次滴定的测量数据如下表,该亚磷酸溶液的物质的量浓度为______。(保留小数点后两位)
试验编号 滴定前读数(mL) 滴定后读数(mL)
1 0.00 22.00
2 0.50 22.50
3 0.50 25.50
(4)某研究性学习小组在实验室中配制的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是___________。
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
黄冈市2020年秋季高二年级期末调研考试
化学试题(答案)
注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。卷面总分100分。考试时间90分钟。
2.请将试题的答案填写在“答题卷”中,否则作零分处理。
可能用到的相对原子质量:-1 -16 -23 -31 -32 -55 -64
第Ⅰ卷(选择题,共40分)
一、选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求)
1. 2020年为防止新冠肺炎疫情蔓延,防疫人员使用了多种消毒剂进行环境消毒。下列关于常见消毒剂的说法中不正确的是()
A. 次氯酸HClO分子空间构型为直线形
B. 浓度为75%的医用酒精消毒效果比95%的好
C. 1mol过氧乙酸()分子中σ键数目为8NA
D. 饱和氯水既有酸性又有漂白性,向其中加入NaHCO3固体后漂白性增强
【答案】A
2. 下列说法中正确的是()
A. 甲烷燃烧时只有化学能转化为热能
B. 轮船在海水中发生的腐蚀主要是析氢腐蚀
C. 反应能自发进行,则该反应为放热反应
D. 常温下,pH=2的醋酸溶液与pH=12的NaOH溶液混合后溶液呈酸性
【答案】C
3. 下列实验操作或现象不能用平衡移动原理解释的是()
A. 卤化银沉淀的转化
B. 配制溶液
C. 溶解淀粉在不同条件下水解
D. 探究石灰石与稀盐酸在密闭环境下反应
【答案】C
4. 现有四种元素的基态原子的核外电子排布式如下:①;②;③;④。则下列有关比较中正确的是:()
A. 电负性:④>③>①>② B. 原子半径:④>③>②>①
C. 第一电离能:④>③>①>② D. 最高正化合价:④>①>③=②
【答案】A
5. 常温下,下列各组离子在指定溶液中一定能大量共存的是()
A. 在透明溶液中:、、、
B. pH=7的溶液中:、、、
C. 能使甲基橙变黄的溶液中:、、、
D. 与Al反应生成H2的溶液中:、、、
【答案】A
6. 与在容积为的密闭容器中发生反应,、时刻分别测得如下数据:
时间/
0.12 0.06 0.10
006 0.12 0.20
下列说法不正确的是()
A.
B. 增大压强,的平衡转化率减小
C. 某时刻反应达到平衡,升高体系温度平衡正向移动
D. 若起始只投入了和,则在时刻
【答案】D
7. 室温下,氨水用盐酸滴定,滴定曲线如图,下列说法正确的是
A. 该中和滴定最好选用酚酞作指示剂
B. 两者恰好中和时,溶液的
C. 当滴入盐酸达时,溶液中:
D. 当滴入盐酸达时,溶液中
【答案】C
8. 下表列出了前20号元素中的某些元素性质的有关数据
元素编号 元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
原子半径(10-10m) 1.52 2.27 0.74 1.43 0.77 1.1 0.99 1.86 0.75 0.71
最高价态 +1 +1 —— +3 +4 +5 +7 +1 +5 ——
最低价态 —— —— -2 —— -4 -3 -1 —— -3 -1
第三周期元素R的原子半径为1.02×10-10m,下列有关叙述不正确的是()
A. 元素R的最高正价为+6
B. 以上10种元素的原子中,失去核外第一个电子所需能量最少的是②
C. 若物质Na2R4是一种含有非极性共价键的离子化合物,则其化合物的电子式
D. 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4
【答案】D
9. 下列实验操作、现象及得出的结论均正确的是
选项 实验操作 实验现象 实验结论
A Cu片与足量浓硫酸加热反应,冷却后,再将冷水缓慢加入盛有反应混合物的烧杯中 溶液变蓝 证明反应生成了Cu2+
B 取少量某溶液于试管中,加入NaOH浓溶液并加热,用湿润的蓝色石蕊试纸检验产生的气体 蓝色石蕊试纸变红 溶液中含有NH4+
C 向20.00mL浓度均为0.01mol/L的Na2SO4和Na2S 的混合溶液中滴加几滴等浓度的AgNO3溶液 只产生黑色沉淀Ag2S Ksp(Ag2S)<Ksp(Ag2SO4)
D 室温下,用pH试纸分别测定浓度均为0.1mol/L的Na2SO3和Na2CO3两种溶液的pH pH:
Na2CO3>Na2SO3 非金属性:S>C
A. A B. B C. C D. D
【答案】C
10. 下列实验装置能达到相应实验目的的是
A. 装置①用于验证反应是否有CO2生成
B. 装置②用于用标准NaOH溶液测定盐酸浓度
C. 装置③用于制备少量含NaClO的消毒液
D. 装置④用于比较铜、铁活泼性强弱
【答案】D
二、选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对的得4分,选对但不全的得2分,有错选的得0分)
11. 下列叙述正确的是()
A. 和分子都是含极性键的极性分子
B. 分子稳定性低于分子,因为键键能高
C. 为正四面体结构,可推测出也为正四面体结构
D. 汽化成水蒸气、分解为和都需要破坏共价键
【答案】BC
12. 室温下,下列溶液中有关微粒的物质的量浓度关系正确的是()
A. 与盐酸等体积混合后,溶液呈碱性,则有
B. 的和混合溶液:
C. 相等的①溶液、②溶液、③溶液、④溶液,其物质的量浓度由大到小的顺序为②>④>③>①
D. 浓度比为的、混合溶液:
【答案】B
13. 常温下,用溶液分别滴定浓度均为0.01 mol?L?1的、溶液,所得的沉淀溶解平衡图像如图所示(不考虑的水解)。下列叙述正确的是()
A. 点表示的不饱和溶液
B. 的数量级等于
C. 的平衡常数为
D. 向的混合液中滴入溶液时,先生成沉淀
【答案】BC
14. 在一定条件下,取一定量的A和B在恒容密闭容器中发生反应:aA(g)+bB(s)mM(g)+nN(g) ?H=QkJ/mol,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断正确的是( )
A. a+b<m+n
B. E点的平衡常数小于F点的平衡常数
C. 容器内混合气体的密度不变可证明反应达到平衡
D. 达到平衡后,加入B将会提高A的转化率
【答案】BC
15. 最近,科学家报道了一种新型可充电钠电池,其工作原理如图所示,下列说法正确的是()
A. 放电时,极为负极
B. 充电时,向极迁移
C. 电极材料中,单位质量金属放出的电能:
D. 放电时,极反应为
【答案】AC
第Ⅱ卷(非选择题 共60分)
三、非选择题(本题共5小题,共60分)
16. 请按要求填空:
(1)已知25℃时,测得浓度为0.1mol/L的BOH溶液中,c(OH-)=1×10-3mol/L。写出BOH的电离方程式:___________。
(2) 25℃时,amol/L NH3?H2O溶液的pH=b,用含a和b的代数式表示NH3?H2O的电离平衡常数Kb=___________(要求精确计算)。
(3)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3,反应结束后溶液中离子浓度由大到小的顺序是___________;在通入NH3的过程中溶液的导电能力___________(选填“变大”、“变小”、“几乎不变”)。
(4)室温下,将物质的量浓度相同的CH3COOH和NaOH溶液混合后,溶液中CH3COO-和Na+浓度相等,则混合后溶液的pH___________7(选填“>”、“<”或“=”,下同),所用醋酸体积___________氢氧化钠溶液体积。
【答案】 (1). BOH?B++OH- (2). (3). c(Cl-)>c(NH)>c(H+)>c(OH-) (4). 几乎不变 (5). (6).
17. 在催化剂条件下利用反应进行脱硫具有广阔的工业化前景。请回答下列问题:
(1)在恒温恒压的容器中模拟回收硫,加入起始量均为,测得的平衡体积分数随和的投料比变化如图1:
①当投料比为2时,时测得转化率为,则用的生成速率表示的反应速率___________。
②当投料比为3时,的平衡体积分数对应的点是___________。
(2)恒温向体积均为的密闭容器通入和。反应体系总压强随时间的变化如图2:
①相对于Ⅰ,Ⅱ改变的外界条件是___________。
②的平衡转化率为___________,平衡常数___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)若采用电解法处理尾气可制备保险粉()电解装置如图,则___________(填“”“”或“”),生成的电极反应式为___________。
【答案】 (1). (2). C (3). 使用(或使用更高效)催化剂 (4). (5). 0.675 (6). (7).
18. 已知、、、、、是原子序数依次增大的前30号元素,其中、、、、均为短周期主族元素,元素是宇宙中含量最高的元素,元素基态原子的核外有3个能级,每个能级上的电子数都相同;的最外层电子数与能层数之比为;和元素同主族;是第四周期元素,最外层只有一个电子,其余各层电子均充满。回答下列问题(用元素符号或化学式表示):
(1)在元素周期表中的位置为___________。
(2)分别与、、能形成10电子的化合物,它们的沸点由高到低的顺序是___________(填化学式)。
(3)分子中的杂化方式是___________,其空间立体构型为___________。
(4)气态分子结构如图所示,已知断裂吸收的热量,生成放出热量。试写出由气态分子变成态分子的热化学方程式___________。
(5)已知可溶于稀硫酸,可以获得单质和蓝色溶液,请写出离子方程式___________。
【答案】 (1). 第四周期ⅠB族 (2). H2O>NH3>CH4 (3). sp2 (4). V形 (5). N4(g)=2N2(g) ΔH=-882kJ/mol (6).
19. 工业上利用软锰矿为原料来制备锰的化合物,相关流程概述如下。请根据信息回答下列问题。
(1)软锰矿的酸浸处理
①过程中可以提高锰元素浸出速率的方法有:___________,___________(写出两种)。
②酸浸过程中的主要反应(将方程式补充完整):___________
(2)过程Ⅰ:工业上采用电解溶液的方法制备二氧化锰,则二氧化锰在___________(填“阳”或“阴”)极生成,该电极反应式为:___________。
(3)过程Ⅱ:制备
难溶于水、能溶于强酸,可用溶液和溶液混合制备。每制得,至少消耗的体积为___________。
【答案】 (1). 加热 (2). 将矿石磨成粉 (3). 2FeS2+3MnO2+12H+=3Mn2++2Fe3++4S+6H2O
(4). 阳 (5). (6).
20. 已知:硫酸、硒酸、亚磷酸等是二元酸。请根据所给信息完成下列问题。
(1)硒酸(H2SeO4)在水溶液中电离如下:,,。
①向溶液中滴加少量氨水,该反应的离子方程式为___________。
②已知的电离平衡常数,,则和两溶液混合反应的离子方程式为:___________。
(2)亚磷酸()是二元弱酸,已知常温下的电离常数的值:,。则溶液显___________性。(选填“酸”、“碱”或“中”)
(3)某化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸()具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为:。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:___________。
②已知三次滴定的测量数据如下表,该亚磷酸溶液的物质的量浓度为______。(保留小数点后两位)
试验编号 滴定前读数(mL) 滴定后读数(mL)
1 0.00 22.00
2 0.50 22.50
3 0.50 25.50
(4)某研究性学习小组在实验室中配制的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是___________。
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
【答案】 (1). (2). (3). 酸 (4). 滴入最后一滴KMnO4标准溶液,锥形瓶内液体由无色变为红色,且半分钟内不褪色 (5). 0.22mol/L (6). ABD
同课章节目录
