北京市顺义区2020-2021学年九年级上学期期末化学试卷(word版有答案)
文档属性
| 名称 | 北京市顺义区2020-2021学年九年级上学期期末化学试卷(word版有答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 656.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-27 00:00:00 | ||
图片预览


文档简介
北京市顺义区2020-2021学年九年级上学期期末化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.空气成分中,体积分数最大的是( )
A.氮气
B.二氧化碳
C.氧气
D.稀有气体
2.垃圾分类投放是每个公民应尽的义务。下列废弃物,不能投入可回收垃圾箱的是
A.废报纸
B.橘子皮
C.矿泉水瓶
D.铝质易拉罐
3.下列物质溶于水能形成溶液的是
A.蔗糖
B.花生油
C.面粉
D.奶粉
4.硬水给生活带来诸多不便。下列离子中,与水硬度有关的是
A.Na+
B.Ca2+
C.Cl-
D.H+
5.下列物质在氧气中燃烧,火星四射、生成黑色固体的是
A.木炭
B.镁条
C.红磷
D.铁丝
6.下列符号表示2个氢原子的是
A.2H
B.2H+
C.H2
D.2H2
7.下列不属于二氧化碳用途的是
A.灭火
B.人工降雨
C.火箭燃料
D.气体肥料
8.金被加工成金箔,说明金具有良好的
A.延展性
B.导电性
C.导热性
D.抗腐蚀性
9.下列金属不能与稀盐酸发生反应的是
A.镁
B.锌
C.铜
D.铁
10.下列有关物质性质的描述,属于化学性质的是
A.浓盐酸易挥发
B.干冰易升华
C.一氧化碳有毒
D.食盐有咸味
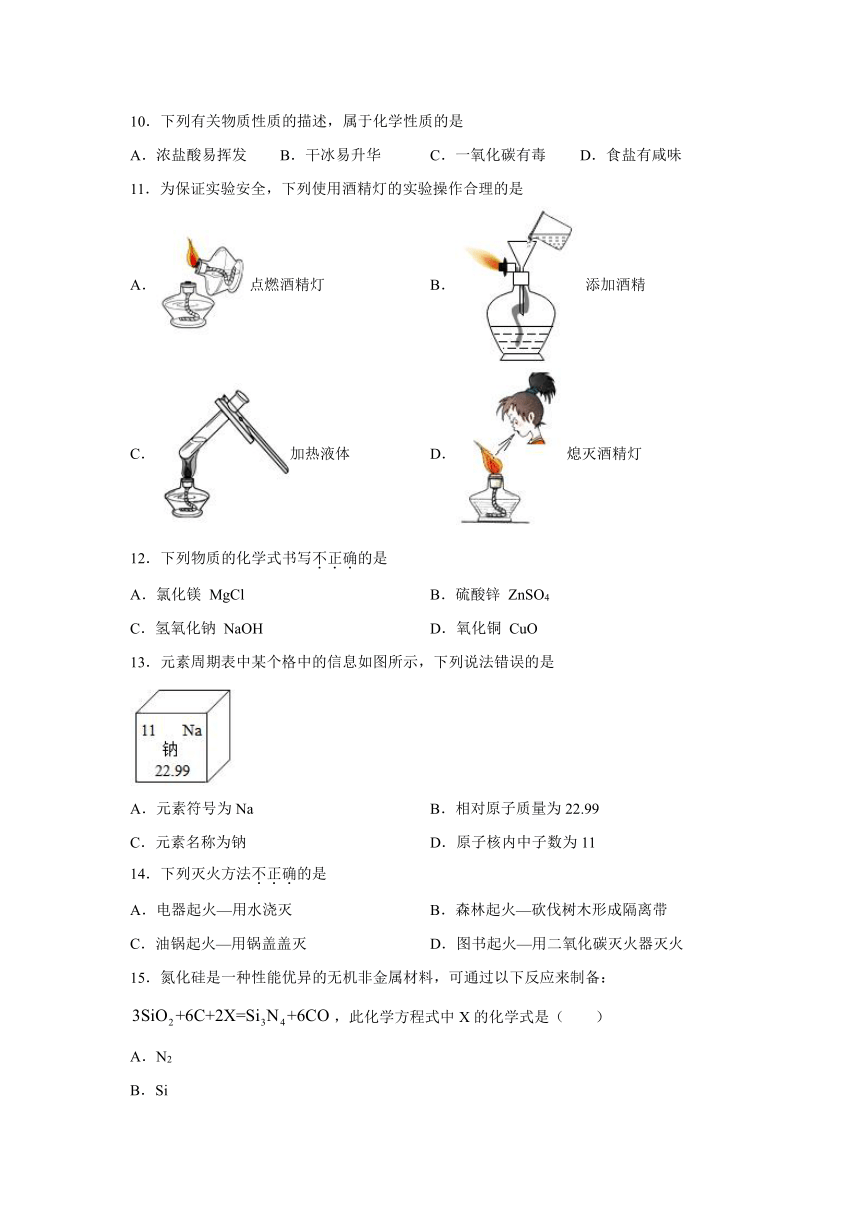
11.为保证实验安全,下列使用酒精灯的实验操作合理的是
A.点燃酒精灯
B.添加酒精C.加热液体
D.熄灭酒精灯
12.下列物质的化学式书写不正确的是
A.氯化镁
MgCl
B.硫酸锌
ZnSO4
C.氢氧化钠
NaOH
D.氧化铜
CuO
13.元素周期表中某个格中的信息如图所示,下列说法错误的是
A.元素符号为Na
B.相对原子质量为22.99
C.元素名称为钠
D.原子核内中子数为11
14.下列灭火方法不正确的是
A.电器起火—用水浇灭
B.森林起火—砍伐树木形成隔离带
C.油锅起火—用锅盖盖灭
D.图书起火—用二氧化碳灭火器灭火
15.氮化硅是一种性能优异的无机非金属材料,可通过以下反应来制备:,此化学方程式中X的化学式是( )
A.N2
B.Si
C.NO
D.CO2
16.用图所示装置进行电解水实验,下列说法正确的是
A.b中气体能燃烧
B.a中气体是氧气
C.水分子由氢原子和氧原子构成
D.水由氢气和氧气组成
17.下列有关金属或合金的说法正确的是
A.合金属于单质
B.铁在潮湿的空气中不易生锈
C.铝的金属活动性强,在空气中易被腐蚀
D.铜的导电性好,常用于电线电缆
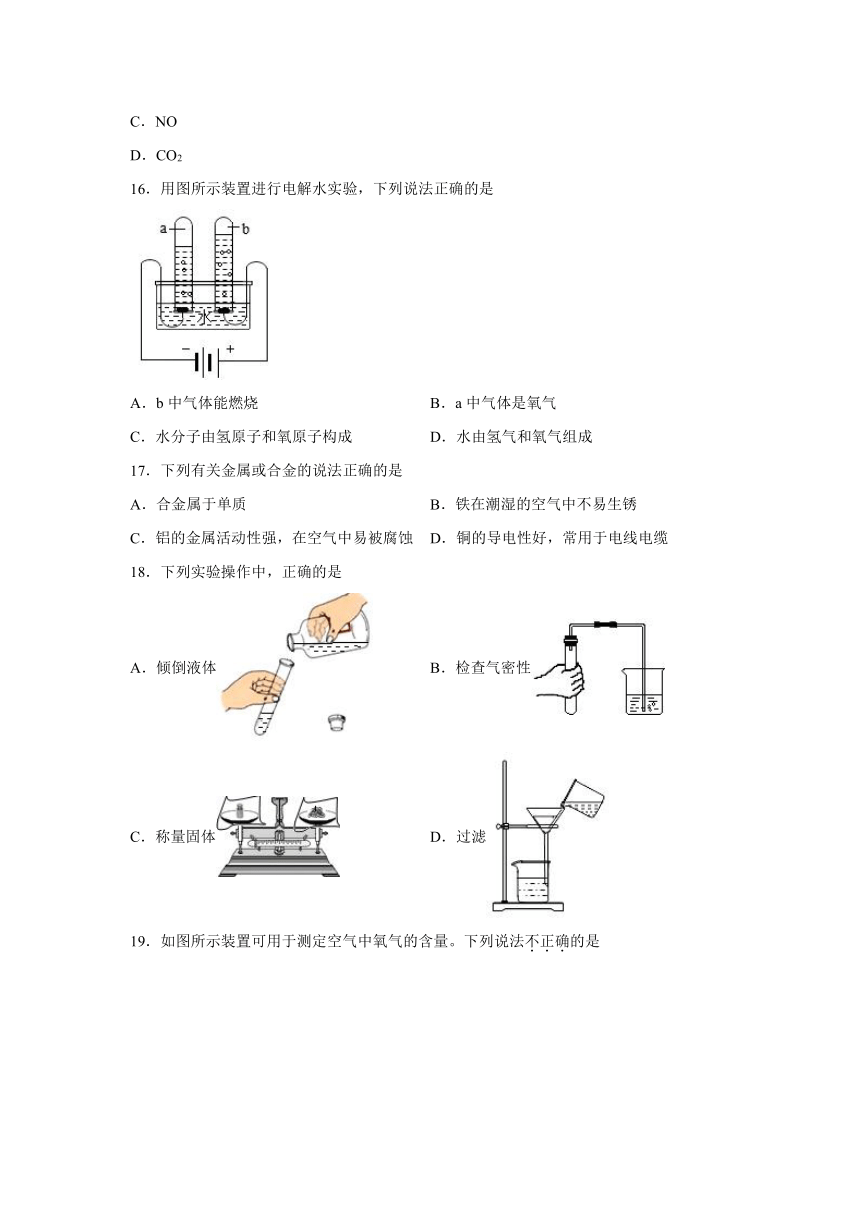
18.下列实验操作中,正确的是
A.倾倒液体
B.检查气密性
C.称量固体
D.过滤
19.如图所示装置可用于测定空气中氧气的含量。下列说法不正确的是
A.实验装置的气密性要好
B.红磷足量是实验成功的关键之一
C.如果没冷却就打开弹簧夹,测量结果将偏大
D.进入集气瓶内水的体积等于消耗掉氧气的体积
20.下列化学方程式书写正确的是
A.H2CO3=H2O
+CO2
B.P+O2PO2
C.C+O2=CO2
D.H2O
+CO2=H2CO3
21.配制100
g质量分数为16%的食盐水,下列说法不正确的是
A.实验步骤是计算、称量、溶解
B.量取水的体积为100mL
C.实验中要用到胶头滴管
D.溶解不能在量筒中进行
22.有关空气中成分的说法中,不正确的是
A.氮气用于制作霓虹灯
B.CO2过多会造成温室效应
C.氧气用于急救病人
D.稀有气体化学性质稳定
23.不同温度时,NaCl固体的溶解度如下表所示:
温度/℃
20
40
60
80
100
溶解度/g
36.0
36.6
37.3
38.4
39.8
20℃时,将50g
NaCl固体加入到盛有100g水的烧杯中,充分溶解得到溶液。下列说法错误的是
A.烧杯中溶液的质量为150g
B.所得溶液为饱和溶液
C.烧杯中剩余固体的质量为14g
D.所得溶液中溶质质量分数的为26.5%
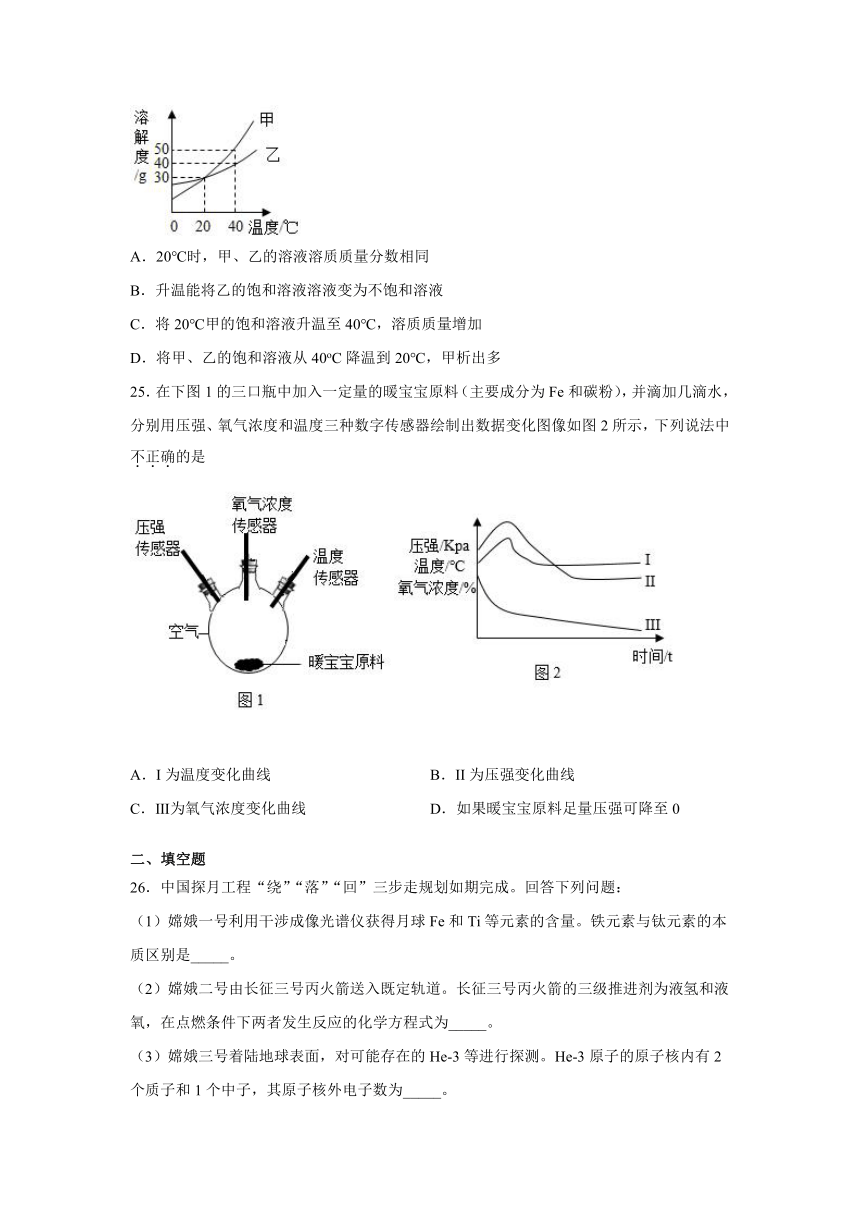
24.甲、乙两种固体的溶解度曲线如下图所示。下列说法中,正确的是
A.20℃时,甲、乙的溶液溶质质量分数相同
B.升温能将乙的饱和溶液溶液变为不饱和溶液
C.将20℃甲的饱和溶液升温至40℃,溶质质量增加
D.将甲、乙的饱和溶液从40oC降温到20℃,甲析出多
25.在下图1的三口瓶中加入一定量的暖宝宝原料(主要成分为Fe和碳粉),并滴加几滴水,分别用压强、氧气浓度和温度三种数字传感器绘制出数据变化图像如图2所示,下列说法中不正确的是
A.I为温度变化曲线
B.II为压强变化曲线
C.Ⅲ为氧气浓度变化曲线
D.如果暖宝宝原料足量压强可降至0
二、填空题
26.中国探月工程“绕”“落”“回”三步走规划如期完成。回答下列问题:
(1)嫦娥一号利用干涉成像光谱仪获得月球Fe和Ti等元素的含量。铁元素与钛元素的本质区别是_____。
(2)嫦娥二号由长征三号丙火箭送入既定轨道。长征三号丙火箭的三级推进剂为液氢和液氧,在点燃条件下两者发生反应的化学方程式为_____。
(3)嫦娥三号着陆地球表面,对可能存在的He-3等进行探测。He-3原子的原子核内有2个质子和1个中子,其原子核外电子数为_____。
(4)嫦娥四号的月球车靠太阳能从月夜中唤醒,已完成25个月昼的探测工作。下列能源中,与太阳能一样属于新能源的是_____。
A
风能
B
潮汐能
C
化石燃料
(5)2020年12月17日,嫦娥五号携带月壤样品成功返回地球。月球岩石中的长石以钙长石(CaO·
Al2O3·2SiO2)
为主,钙长石由_____种元素组成。
27.《2050年世界与中国能源展望-2019版》预测,未来30年,世界能源结构将发生如图所示的变化。回答下列问题:
(1)化石燃料是指天然气、煤和_____。
(2)天然气燃烧的化学方程式为_____。
(3)未来30年,能源发展的总趋势是_____。
28.小明网购金鱼时,暖心的商家附赠了一包增氧颗粒(如图),其有效成分为过碳酸钠(2Na2CO3·3H2O2)。
(1)过碳酸钠溶于水时分解为过氧化氢和碳酸钠,过氧化氢分解生成氧气的化学方程式为_____。
(2)向增氧颗粒上滴加稀盐酸,有大量气泡产生,检验该气体为二氧化碳的操作是_____。
29.自来水生产过程如图所示。
回答下列问题:
(1)明矾[KAl(SO4)2·12H2O]中含有的金属元素是_____。
(2)清水池中盛放的清水属于_____。
A
纯净物
B
单质
C
混合物
D
氧化物
(3)上述流程中起过滤作用的是_____。
三、简答题
30.钢铁有工业的骨骼之称。工业上用赤铁矿(主要成分为Fe2O3)炼铁的化学方程式为_____。
31.依据下图所示实验回答问题。
(1)A实验中观察到的现象是_____。
(2)B实验中观察到天平的指针_____(填“向左”“不”或“向右”)偏转。
(3)C实验的目的是_____。
四、科普阅读题
32.臭氧层位于距地面20-50公里的上空,其作用之一是保护地球上的人类和动植物免遭短波紫外线的伤害。在紫外线照射下,氧气和臭氧之间转化关系为3O22O3。臭氧(O3)是一种淡蓝色、有刺激气味的氧化性气体,空气中臭氧浓度太高会刺激人的呼吸道,引发支气管炎和肺气肿等。
城市空气中的臭氧主要是由汽车、石油化工等排放的氮氧化物(NOX)和挥发性有机物(VOCs)在大气中进行复杂的光化学反应而产生。
研究臭氧浓度的日变化规律与空气中NO2浓度、气温的关系,结果如下图所示。
回答下列问题:
(1)氧气在紫外线照射下转化为臭氧的过程属于_____变化。
(2)臭氧与氧气性质的不同点有_____(写出两点)。
(3)臭氧的日间(7:00-19:00)变化与气温的关系是_____。
(4)下列说法正确的是_____。
A臭氧层对人类有保护作用
B二氧化氮也是空气污染物之一
C晴朗的夏天,更有可能形成臭氧污染
D湿度与臭氧浓度的关系跟气温与臭氧浓度的关系相似
五、流程题
33.海水是一个巨大的化学资源宝库。海水综合利用可获取很多物质,其部分工业流程如下:
回答下列问题:
(1)使海水淡化的方法有_____(写出一种即可)。
(2)反应②有NaCl生成,其化学方程式为_____。
(3)上述流程中,与反应②类型相同的反应是_____。
六、计算题
34.使用氢能可实现如图所示的绿色循环。我国科学家研究用BiVO4提高光催化分解水的转化率取得重大进展。用该方法分解18克水,可得到氢气多少克?(请分别依据化学式和化学方程式计算)
七、实验题
35.结合下图所示装置回答问题:
(1)仪器a的名称是_____。
(2)实验室制取并收集一瓶CO2,选择的装置是_____。
(3)能用E装置收集的气体具有的性质是_____。
(4)用AC连接制取O2,发生反应的化学方程式为_____。检验氧气是否收集满的方法是_____。
36.为了探究相关金属的活动性,设计了如下图所示的实验。
(1)实验①的目的是_____。
(2)实验②中发生反应的反应方程式为_____。
(3)该探究得到的实验结论是_____。
37.用下图所示实验探究CO2的性质。
(1)证明二氧化碳能与水反应,依据的实验现象为_____。
(2)c处发生反应的化学方程式为_____。
(3)d处观察到燃烧的蜡烛自下而上依次熄灭,说明二氧化碳具有的性质是_____。
八、科学探究题
38.84消毒液是生活中常用的一种消毒液,实验小组对其进行研究。
(查阅资料)
Ⅰ、
84消毒液的有效成分为次氯酸钠(NaClO)。
Ⅱ、消毒原理是使菌体蛋白质变性,变性程度越大,消毒效果越好。鸡蛋清中的蛋白质变性时变为白色固体。
Ⅲ、ORP指漂白能力,ORP数值越大,漂白能力越强。
(进行实验)
实验1:在鸡蛋清中加入不同浓度的消毒液,静置15min现象如下表。
序号
1-1
1-2
1-3
1-4
实验
操作
实验现象
液体表面产生大量气泡,无其他现象
液体中产生大量白色固体
液体中产生少量白色固体
液体中产生极少量白色固体
实验2:探究影响84消毒液漂白性的因素
序号
2-1
2-2
实验操作
取四个烧杯,分别倒入30mL浓度为1:100
的84消毒液,并置于20°C、30°C、40°C、50°C恒温箱加热,测量
ORP
变化
取烧杯倒入30mL浓度为1:100
的84消毒液,在距烧杯10
cm处进行光照,测量
ORP
变化
测量数据
(反思与评价)综合考虑实验2的探究过程,回答下列问题:
(1)实验2-1设计中_____(填“有”或“无”)光照。实验2-2的中最好将温度控制在_____。
(解释与结论)
(1)次氯酸钠(NaClO)中氯元素的化合价为_____。
(2)实验1的目的是_____。
(3)实验2-1得出的结论是_____。
(4)由2-2能否得出光照是影响84消毒液漂白性的因素之一,请说明理由
_____。
参考答案
1.A
2.B
3.A
4.B
5.D
6.A
7.C
8.A
9.C
10.C
11.C
12.A
13.D
14.A
15.A
16.C
17.D
18.B
19.C
20.D
21.B
22.A
23.A
24.B
25.D
26.质子数不同
2
AB
四
27.石油
化石燃料逐渐减少,可再生能源使用逐渐增加
28.2H2O2=2H2O+O2↑
将气体通入澄清石灰水
29.Al、K
C
隔网、滤水池
30.3CO+Fe2O33CO2+2Fe
31.滴有酚酞的滤纸上自右向左逐渐变红
向右
探究可燃物在与氧气接触且温度达到着火点时能否燃烧
32.化学
O3有刺激性气味而O2无味;O3有淡蓝色而O2无色
温度越高,臭氧浓度越高
ABC
33.蒸馏
2NaBr+Cl2=2NaCl+Br2
③
34.解:18g水中氢元素的质量=18g×=2g
根据质量守恒定律可知,18g水电解后生成氢气的质量为2g
答:得到氢气的质量为2g。
解:设生成氢气的质量为x
=
x=2g
答:生成氢气的质量为2g。
35.长颈漏斗
BC
不溶于水且不与水发生反应
将带火星的木条放在瓶口,若木条复燃,证明已收集满
36.比较Cu与Ag的活动性强弱
Fe+2HCl=FeCl2+H2↑
活动性排列:Fe>Cu>Ag
37.通入二氧化碳后a处小花不变色而b处小花变为红色
CO2+Ca(OH)2=CaCO3↓+H2O
相同条件下CO2的密度比空气大,不燃烧也不支持燃烧
38.无
20℃
+1
探究84消毒液浓度对消毒效果的影响
在浓度、光照灯条件相同时,在实验研究的范围内,84消毒液在不同温度下放置相同时间,温度越高,消毒液的漂白能力越弱
不能,因为没有无光照条件下的对比实验
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.空气成分中,体积分数最大的是( )
A.氮气
B.二氧化碳
C.氧气
D.稀有气体
2.垃圾分类投放是每个公民应尽的义务。下列废弃物,不能投入可回收垃圾箱的是
A.废报纸
B.橘子皮
C.矿泉水瓶
D.铝质易拉罐
3.下列物质溶于水能形成溶液的是
A.蔗糖
B.花生油
C.面粉
D.奶粉
4.硬水给生活带来诸多不便。下列离子中,与水硬度有关的是
A.Na+
B.Ca2+
C.Cl-
D.H+
5.下列物质在氧气中燃烧,火星四射、生成黑色固体的是
A.木炭
B.镁条
C.红磷
D.铁丝
6.下列符号表示2个氢原子的是
A.2H
B.2H+
C.H2
D.2H2
7.下列不属于二氧化碳用途的是
A.灭火
B.人工降雨
C.火箭燃料
D.气体肥料
8.金被加工成金箔,说明金具有良好的
A.延展性
B.导电性
C.导热性
D.抗腐蚀性
9.下列金属不能与稀盐酸发生反应的是
A.镁
B.锌
C.铜
D.铁
10.下列有关物质性质的描述,属于化学性质的是
A.浓盐酸易挥发
B.干冰易升华
C.一氧化碳有毒
D.食盐有咸味
11.为保证实验安全,下列使用酒精灯的实验操作合理的是
A.点燃酒精灯
B.添加酒精C.加热液体
D.熄灭酒精灯
12.下列物质的化学式书写不正确的是
A.氯化镁
MgCl
B.硫酸锌
ZnSO4
C.氢氧化钠
NaOH
D.氧化铜
CuO
13.元素周期表中某个格中的信息如图所示,下列说法错误的是
A.元素符号为Na
B.相对原子质量为22.99
C.元素名称为钠
D.原子核内中子数为11
14.下列灭火方法不正确的是
A.电器起火—用水浇灭
B.森林起火—砍伐树木形成隔离带
C.油锅起火—用锅盖盖灭
D.图书起火—用二氧化碳灭火器灭火
15.氮化硅是一种性能优异的无机非金属材料,可通过以下反应来制备:,此化学方程式中X的化学式是( )
A.N2
B.Si
C.NO
D.CO2
16.用图所示装置进行电解水实验,下列说法正确的是
A.b中气体能燃烧
B.a中气体是氧气
C.水分子由氢原子和氧原子构成
D.水由氢气和氧气组成
17.下列有关金属或合金的说法正确的是
A.合金属于单质
B.铁在潮湿的空气中不易生锈
C.铝的金属活动性强,在空气中易被腐蚀
D.铜的导电性好,常用于电线电缆
18.下列实验操作中,正确的是
A.倾倒液体
B.检查气密性
C.称量固体
D.过滤
19.如图所示装置可用于测定空气中氧气的含量。下列说法不正确的是
A.实验装置的气密性要好
B.红磷足量是实验成功的关键之一
C.如果没冷却就打开弹簧夹,测量结果将偏大
D.进入集气瓶内水的体积等于消耗掉氧气的体积
20.下列化学方程式书写正确的是
A.H2CO3=H2O
+CO2
B.P+O2PO2
C.C+O2=CO2
D.H2O
+CO2=H2CO3
21.配制100
g质量分数为16%的食盐水,下列说法不正确的是
A.实验步骤是计算、称量、溶解
B.量取水的体积为100mL
C.实验中要用到胶头滴管
D.溶解不能在量筒中进行
22.有关空气中成分的说法中,不正确的是
A.氮气用于制作霓虹灯
B.CO2过多会造成温室效应
C.氧气用于急救病人
D.稀有气体化学性质稳定
23.不同温度时,NaCl固体的溶解度如下表所示:
温度/℃
20
40
60
80
100
溶解度/g
36.0
36.6
37.3
38.4
39.8
20℃时,将50g
NaCl固体加入到盛有100g水的烧杯中,充分溶解得到溶液。下列说法错误的是
A.烧杯中溶液的质量为150g
B.所得溶液为饱和溶液
C.烧杯中剩余固体的质量为14g
D.所得溶液中溶质质量分数的为26.5%
24.甲、乙两种固体的溶解度曲线如下图所示。下列说法中,正确的是
A.20℃时,甲、乙的溶液溶质质量分数相同
B.升温能将乙的饱和溶液溶液变为不饱和溶液
C.将20℃甲的饱和溶液升温至40℃,溶质质量增加
D.将甲、乙的饱和溶液从40oC降温到20℃,甲析出多
25.在下图1的三口瓶中加入一定量的暖宝宝原料(主要成分为Fe和碳粉),并滴加几滴水,分别用压强、氧气浓度和温度三种数字传感器绘制出数据变化图像如图2所示,下列说法中不正确的是
A.I为温度变化曲线
B.II为压强变化曲线
C.Ⅲ为氧气浓度变化曲线
D.如果暖宝宝原料足量压强可降至0
二、填空题
26.中国探月工程“绕”“落”“回”三步走规划如期完成。回答下列问题:
(1)嫦娥一号利用干涉成像光谱仪获得月球Fe和Ti等元素的含量。铁元素与钛元素的本质区别是_____。
(2)嫦娥二号由长征三号丙火箭送入既定轨道。长征三号丙火箭的三级推进剂为液氢和液氧,在点燃条件下两者发生反应的化学方程式为_____。
(3)嫦娥三号着陆地球表面,对可能存在的He-3等进行探测。He-3原子的原子核内有2个质子和1个中子,其原子核外电子数为_____。
(4)嫦娥四号的月球车靠太阳能从月夜中唤醒,已完成25个月昼的探测工作。下列能源中,与太阳能一样属于新能源的是_____。
A
风能
B
潮汐能
C
化石燃料
(5)2020年12月17日,嫦娥五号携带月壤样品成功返回地球。月球岩石中的长石以钙长石(CaO·
Al2O3·2SiO2)
为主,钙长石由_____种元素组成。
27.《2050年世界与中国能源展望-2019版》预测,未来30年,世界能源结构将发生如图所示的变化。回答下列问题:
(1)化石燃料是指天然气、煤和_____。
(2)天然气燃烧的化学方程式为_____。
(3)未来30年,能源发展的总趋势是_____。
28.小明网购金鱼时,暖心的商家附赠了一包增氧颗粒(如图),其有效成分为过碳酸钠(2Na2CO3·3H2O2)。
(1)过碳酸钠溶于水时分解为过氧化氢和碳酸钠,过氧化氢分解生成氧气的化学方程式为_____。
(2)向增氧颗粒上滴加稀盐酸,有大量气泡产生,检验该气体为二氧化碳的操作是_____。
29.自来水生产过程如图所示。
回答下列问题:
(1)明矾[KAl(SO4)2·12H2O]中含有的金属元素是_____。
(2)清水池中盛放的清水属于_____。
A
纯净物
B
单质
C
混合物
D
氧化物
(3)上述流程中起过滤作用的是_____。
三、简答题
30.钢铁有工业的骨骼之称。工业上用赤铁矿(主要成分为Fe2O3)炼铁的化学方程式为_____。
31.依据下图所示实验回答问题。
(1)A实验中观察到的现象是_____。
(2)B实验中观察到天平的指针_____(填“向左”“不”或“向右”)偏转。
(3)C实验的目的是_____。
四、科普阅读题
32.臭氧层位于距地面20-50公里的上空,其作用之一是保护地球上的人类和动植物免遭短波紫外线的伤害。在紫外线照射下,氧气和臭氧之间转化关系为3O22O3。臭氧(O3)是一种淡蓝色、有刺激气味的氧化性气体,空气中臭氧浓度太高会刺激人的呼吸道,引发支气管炎和肺气肿等。
城市空气中的臭氧主要是由汽车、石油化工等排放的氮氧化物(NOX)和挥发性有机物(VOCs)在大气中进行复杂的光化学反应而产生。
研究臭氧浓度的日变化规律与空气中NO2浓度、气温的关系,结果如下图所示。
回答下列问题:
(1)氧气在紫外线照射下转化为臭氧的过程属于_____变化。
(2)臭氧与氧气性质的不同点有_____(写出两点)。
(3)臭氧的日间(7:00-19:00)变化与气温的关系是_____。
(4)下列说法正确的是_____。
A臭氧层对人类有保护作用
B二氧化氮也是空气污染物之一
C晴朗的夏天,更有可能形成臭氧污染
D湿度与臭氧浓度的关系跟气温与臭氧浓度的关系相似
五、流程题
33.海水是一个巨大的化学资源宝库。海水综合利用可获取很多物质,其部分工业流程如下:
回答下列问题:
(1)使海水淡化的方法有_____(写出一种即可)。
(2)反应②有NaCl生成,其化学方程式为_____。
(3)上述流程中,与反应②类型相同的反应是_____。
六、计算题
34.使用氢能可实现如图所示的绿色循环。我国科学家研究用BiVO4提高光催化分解水的转化率取得重大进展。用该方法分解18克水,可得到氢气多少克?(请分别依据化学式和化学方程式计算)
七、实验题
35.结合下图所示装置回答问题:
(1)仪器a的名称是_____。
(2)实验室制取并收集一瓶CO2,选择的装置是_____。
(3)能用E装置收集的气体具有的性质是_____。
(4)用AC连接制取O2,发生反应的化学方程式为_____。检验氧气是否收集满的方法是_____。
36.为了探究相关金属的活动性,设计了如下图所示的实验。
(1)实验①的目的是_____。
(2)实验②中发生反应的反应方程式为_____。
(3)该探究得到的实验结论是_____。
37.用下图所示实验探究CO2的性质。
(1)证明二氧化碳能与水反应,依据的实验现象为_____。
(2)c处发生反应的化学方程式为_____。
(3)d处观察到燃烧的蜡烛自下而上依次熄灭,说明二氧化碳具有的性质是_____。
八、科学探究题
38.84消毒液是生活中常用的一种消毒液,实验小组对其进行研究。
(查阅资料)
Ⅰ、
84消毒液的有效成分为次氯酸钠(NaClO)。
Ⅱ、消毒原理是使菌体蛋白质变性,变性程度越大,消毒效果越好。鸡蛋清中的蛋白质变性时变为白色固体。
Ⅲ、ORP指漂白能力,ORP数值越大,漂白能力越强。
(进行实验)
实验1:在鸡蛋清中加入不同浓度的消毒液,静置15min现象如下表。
序号
1-1
1-2
1-3
1-4
实验
操作
实验现象
液体表面产生大量气泡,无其他现象
液体中产生大量白色固体
液体中产生少量白色固体
液体中产生极少量白色固体
实验2:探究影响84消毒液漂白性的因素
序号
2-1
2-2
实验操作
取四个烧杯,分别倒入30mL浓度为1:100
的84消毒液,并置于20°C、30°C、40°C、50°C恒温箱加热,测量
ORP
变化
取烧杯倒入30mL浓度为1:100
的84消毒液,在距烧杯10
cm处进行光照,测量
ORP
变化
测量数据
(反思与评价)综合考虑实验2的探究过程,回答下列问题:
(1)实验2-1设计中_____(填“有”或“无”)光照。实验2-2的中最好将温度控制在_____。
(解释与结论)
(1)次氯酸钠(NaClO)中氯元素的化合价为_____。
(2)实验1的目的是_____。
(3)实验2-1得出的结论是_____。
(4)由2-2能否得出光照是影响84消毒液漂白性的因素之一,请说明理由
_____。
参考答案
1.A
2.B
3.A
4.B
5.D
6.A
7.C
8.A
9.C
10.C
11.C
12.A
13.D
14.A
15.A
16.C
17.D
18.B
19.C
20.D
21.B
22.A
23.A
24.B
25.D
26.质子数不同
2
AB
四
27.石油
化石燃料逐渐减少,可再生能源使用逐渐增加
28.2H2O2=2H2O+O2↑
将气体通入澄清石灰水
29.Al、K
C
隔网、滤水池
30.3CO+Fe2O33CO2+2Fe
31.滴有酚酞的滤纸上自右向左逐渐变红
向右
探究可燃物在与氧气接触且温度达到着火点时能否燃烧
32.化学
O3有刺激性气味而O2无味;O3有淡蓝色而O2无色
温度越高,臭氧浓度越高
ABC
33.蒸馏
2NaBr+Cl2=2NaCl+Br2
③
34.解:18g水中氢元素的质量=18g×=2g
根据质量守恒定律可知,18g水电解后生成氢气的质量为2g
答:得到氢气的质量为2g。
解:设生成氢气的质量为x
=
x=2g
答:生成氢气的质量为2g。
35.长颈漏斗
BC
不溶于水且不与水发生反应
将带火星的木条放在瓶口,若木条复燃,证明已收集满
36.比较Cu与Ag的活动性强弱
Fe+2HCl=FeCl2+H2↑
活动性排列:Fe>Cu>Ag
37.通入二氧化碳后a处小花不变色而b处小花变为红色
CO2+Ca(OH)2=CaCO3↓+H2O
相同条件下CO2的密度比空气大,不燃烧也不支持燃烧
38.无
20℃
+1
探究84消毒液浓度对消毒效果的影响
在浓度、光照灯条件相同时,在实验研究的范围内,84消毒液在不同温度下放置相同时间,温度越高,消毒液的漂白能力越弱
不能,因为没有无光照条件下的对比实验
同课章节目录
