高中化学新教材同步必修第二册 第8章 本章知识体系构建与核心素养提升
文档属性
| 名称 | 高中化学新教材同步必修第二册 第8章 本章知识体系构建与核心素养提升 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-29 15:33:13 | ||
图片预览









文档简介
第八章 化学与可持续发展
本章知识体系构建与核心素养提升
内容索引
NEIRONGSUOYIN
知识体系构建
理清脉络 纲举目张
核心素养提升
理念渗透 贯穿始终
知识体系构建
ZHI SHI TI XI GOU JIAN
01
一、自然资源的开发利用
1.金属矿
物的开发
利用
2.海水资
源的开
发利用
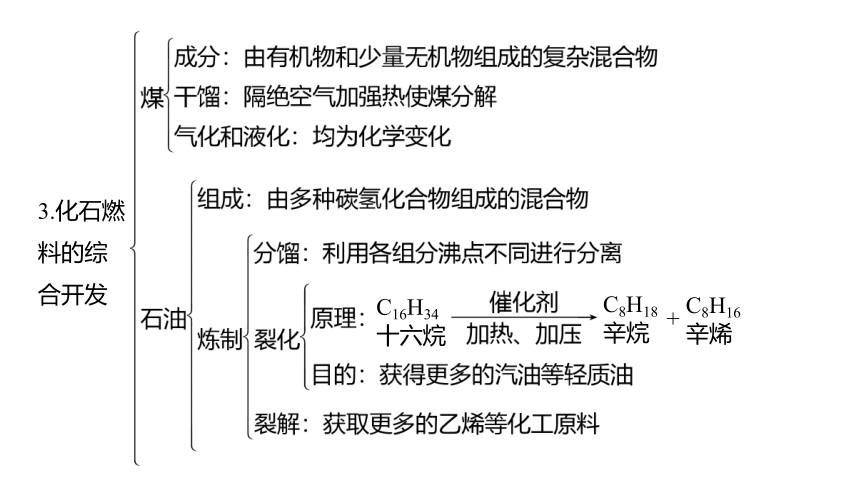
3.化石燃
料的综
合开发
C16H34
十六烷
C8H18
辛烷
C8H16
辛烯
+
3.化石燃
料的综
合开发
二、化学品的合理使用
三、环境保护与绿色化学
返回
02
核心素养提升
HE XIN SU YANG TI SHENG
一、从海水中提取单质
(1)海水
提溴
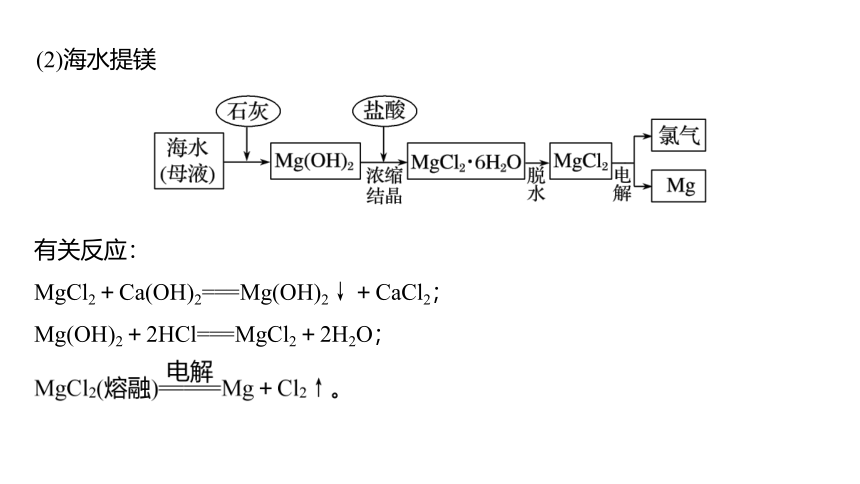
(2)海水提镁
有关反应:
MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2;
Mg(OH)2+2HCl===MgCl2+2H2O;
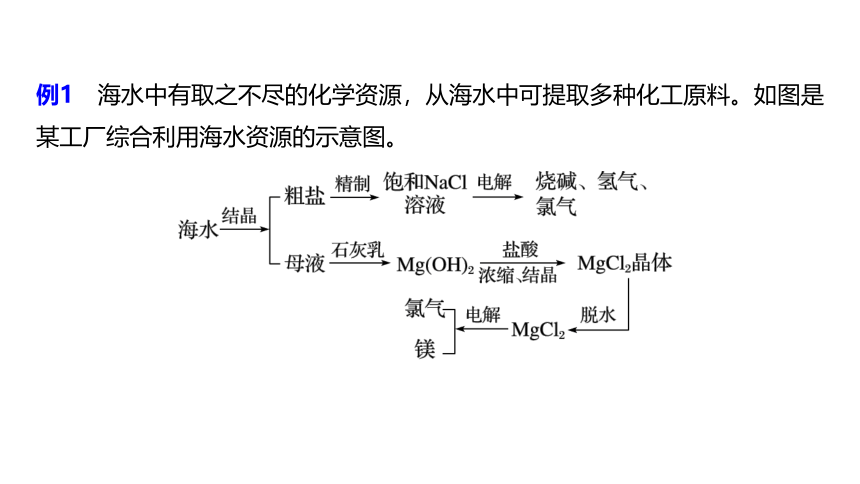
例1 海水中有取之不尽的化学资源,从海水中可提取多种化工原料。如图是某工厂综合利用海水资源的示意图。
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、 等杂质,精制后可得饱和NaCl溶液。精制过程中,通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液进行过滤,最后向滤液中加入盐酸至溶液呈中性。写出加入盐酸后滤液中可能发生反应的离子方程式:_________________________________
_____________。
H2O+CO2↑
解析 粗盐提纯加入试剂的顺序及目的:过量BaCl2溶液(沉淀 )→过量NaOH溶液(沉淀Mg2+)→过量Na2CO3溶液(沉淀Ca2+、Ba2+)→适量盐酸(中和Na2CO3并调节溶液pH)。
(2)海水中提取食盐后的母液中含有K+、Na+、Mg2+等。从离子反应的角度考虑,向母液中加入石灰乳的作用是_______________________。
(3)海水中的镁元素处于________(填“游离态”或“化合态”),从海水中提取氯化镁的反应________(填“是”或“不是”)氧化还原反应,用电解法冶炼金属镁的反应______(填“是”或“不是”)氧化还原反应,原因是__________
_____________________________。
将Mg2+沉淀为Mg(OH)2
化合态
不是
是
该反应过
程中元素的化合价发生了变化
(4)电解熔融的氯化镁所得的镁蒸气冷却后即为固体镁,可以冷却镁蒸气的气体氛围为________(填字母)。
A.H2 B.CO2
C.空气 D.O2
A
二、从矿物中提取金属单质
(1)金属冶炼的一般步骤
(2)金属活动性顺序与金属冶炼方法的关系
金属的活动性顺序
K Ca Na Mg Al
Zn Fe Sn Pb (H) Cu
Hg Ag
Pt Au
在自然界中的存在形态
化合态
多数是化合态,极少数是游离态
游离态
主要冶炼方法
电解法
热还原法
热分解法
物理方法
例2 钛(Ti)因为具有神奇的性能越来越引起人们的关注。常温下钛不与非金属、强酸反应,红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛铁矿石之一是金红石(TiO2),目前大规模生产钛的方法是:
(1)第一步:金红石、炭粉混合,在高温条件下通入Cl2制得TiCl4和一种可燃性
气体。该反应的化学方程式为_______________________________,该反应中
的还原剂是________(填化学式)。
C
解析 常温时钛不与非金属、强酸反应;红热时钛可与常见非金属单质反应。可类比一般不活泼金属氧化物,选用碳作还原剂制得金属,金属再与Cl2反应生成氯化物。再合并反应的化学方程式为TiO2+2C+2Cl2 TiCl4+2CO。
(2)第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
①写出此反应的化学方程式:___________________________。
②简述从上述所得产物中获取金属钛的步骤:__________________________
__________________________________________。
将还原后的产物溶于过量的盐
酸中,过滤、洗涤、干燥,即可得到纯净的钛
解析 还原出的Ti与Mg混合,分离时用强酸,因钛不与强酸反应,所以可将上述产物溶于过量的盐酸中,然后过滤、洗涤、干燥,即可得到纯净的钛。
三、六大工业尾气的主要成分及对有害气体的处理
硫酸工厂尾气
SO2、O2、N2等,一般用氨水吸收
硝酸工厂尾气
NO、NO2、N2、O2等,一般用NaOH溶液吸收
高炉煤气
CO、CO2、N2等,一般回收利用
炼钢烟气
Fe2O3烟尘、CO等,一般回收利用
焦炉气
CH4、CO、CO2、C2H4、N2等,可用作燃料
氯碱工业
Cl2,一般用NaOH溶液吸收
例3 改善大气质量、污水处理等都要依靠化学等科学的发展。
(1)正常雨水的pH约为5.6,是因为溶解了__________(填名称)气体的缘故;酸雨的pH______(填“>”“<”或“=”)5.6。SO2是形成酸雨的主要物质之一,生石灰可吸收煤燃烧产生的SO2,反应的化学方程式为___________________。
二氧化碳
解析 酸雨是指pH小于5.6的雨水,正常雨水pH约为5.6是因为空气中的二氧化碳能与水反应生成碳酸,生石灰可吸收煤燃烧产生的SO2,反应的化学方程式为CaO+SO2===CaSO3。
<
CaO+SO2===CaSO3
(2)治理汽车尾气中NO和CO的一种方法是在汽车的排气管上安装催化转化装置,使CO与NO反应,生成无毒气体CO2和N2。该反应的化学方程式为
____________________________。
解析 在催化剂条件下NO和CO反应生成CO2和N2,反应的化学方程式为2NO+2CO N2+2CO2。
(3)减少室内空气污染,下列措施不正确的是______(填字母,下同)。
a.保持室内空气流通
b.选用环保装饰材料,且不过度装修
c.经常喷洒大量香水或空气清新剂
d.在室内种植芦荟、常青藤等绿色植物
(4)污水处理的主要方法有:a.中和法 b.化学沉淀法 c.氧化还原法 d.过滤法,其中属于物理方法的是______。
c
d
解析 在处理污水的过程中,中和法、化学沉淀法、氧化还原法等方法都有新物质生成,都属于化学方法;过滤可以把不溶于水的物质除去,过滤过程中没有新物质生成,属于物理变化,即过滤法属于物理方法。
四、农药、化肥使用注意“四不混”
(1)碱性肥料氨水、草木灰等不能与敌百虫、乐果、甲胺磷、速灭威、托布津井冈霉素、多菌灵、叶蝉散、菊酯类杀虫剂等药混用,否则会降低药效。
(2)碱性农药石硫合剂、波尔多液、松脂合剂等,不能与碳酸氢铵、硫酸铵、硝酸铵、氯化铵等铵态氮肥和过磷酸钙等化肥混用,否则会使氨挥发损失和生成沉淀,降低肥效。
(3)含砷的农药,如砷酸钙、砷酸铝等不能与钾盐、钠盐类化肥混用,否则会产生可溶性砷而发生药害。
(4)化学肥料不能与微生物农药混用,因为化学肥料挥发性、腐蚀性很强,若与微生物农药如杀螟杆菌、青虫菌等混用,则易杀死微生物,降低防治效果。
例4 关心人类健康是化学的重要任务之一。下列说法正确的是
A.正确合理使用食品添加剂可有效改善食品品质
B.人体需要的微量元素只能来自各种营养保健品
C.长期使用青霉素等各种抗生素有利于人体健康
D.蔬菜和水果中富含的维生素可提供人体需要的能量
√
解析 合理使用食品添加剂既不会影响人体健康,又能有效改善食物品质和色、香、味,所以A选项是正确的;
食物中都含有微量元素,不只是来自各种营养保健品,故B错误;
抗生素有耐药性,不能长期使用,故C错误;
维生素是人和动物为维持正常的生理功能而必需从食物中获得的一类微量有机物质,在人体生长、代谢、发育过程中发挥着重要的作用,不能提供能量,故D错误。
例5 历史经验告诉我们,合理地使用化学物质,有利于保护环境,实现可持续发展。下表是一些化学物质对人类发展的贡献带来的问题及解决方法。
物质
贡献
带来问题
解决方法
硫酸铵等化肥
农作物增产
造成赤潮、土壤酸化
合理地使用化学肥料
含磷洗衣粉
容易洗去衣服上沾有的油污等污物
水体富营养化、造成赤潮
研制高效无磷洗衣粉
请回答下列问题:
(1)硫酸铵的化学式为__________,农业上通常使用_______________________
_______________来改良酸性土壤。
(2)对于废弃的塑料制品(包括可降解塑料)宜采用___________的措施,防止污染环境和提高物质的利用率。
(3)不合理使用化学物质对环境造成危害,为保持可持续发展,应开展的研究课题有________(填序号)。
①研制高效低毒农药
②研究无污染、高原子利用率的绿色化学物质的合成方法
③寻求合成可快速降解的塑料和橡胶的方法
(NH4)2SO4
氢氧化钙[或石灰水、熟
石灰、Ca(OH)2]
回收利用
①②③
(4)煤是当今世界最重要的能源之一。煤中含有的氮、硫等元素在燃烧时会生成NO、NO2和_______等气体,会对大气造成污染,而且是导致________形成的主要原因之一。可采取在煤中加入适量石灰石等措施,以减少煤燃烧对大气造成的污染。
SO2
酸雨
返回
本章知识体系构建与核心素养提升
内容索引
NEIRONGSUOYIN
知识体系构建
理清脉络 纲举目张
核心素养提升
理念渗透 贯穿始终
知识体系构建
ZHI SHI TI XI GOU JIAN
01
一、自然资源的开发利用
1.金属矿
物的开发
利用
2.海水资
源的开
发利用
3.化石燃
料的综
合开发
C16H34
十六烷
C8H18
辛烷
C8H16
辛烯
+
3.化石燃
料的综
合开发
二、化学品的合理使用
三、环境保护与绿色化学
返回
02
核心素养提升
HE XIN SU YANG TI SHENG
一、从海水中提取单质
(1)海水
提溴
(2)海水提镁
有关反应:
MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2;
Mg(OH)2+2HCl===MgCl2+2H2O;
例1 海水中有取之不尽的化学资源,从海水中可提取多种化工原料。如图是某工厂综合利用海水资源的示意图。
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、 等杂质,精制后可得饱和NaCl溶液。精制过程中,通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液进行过滤,最后向滤液中加入盐酸至溶液呈中性。写出加入盐酸后滤液中可能发生反应的离子方程式:_________________________________
_____________。
H2O+CO2↑
解析 粗盐提纯加入试剂的顺序及目的:过量BaCl2溶液(沉淀 )→过量NaOH溶液(沉淀Mg2+)→过量Na2CO3溶液(沉淀Ca2+、Ba2+)→适量盐酸(中和Na2CO3并调节溶液pH)。
(2)海水中提取食盐后的母液中含有K+、Na+、Mg2+等。从离子反应的角度考虑,向母液中加入石灰乳的作用是_______________________。
(3)海水中的镁元素处于________(填“游离态”或“化合态”),从海水中提取氯化镁的反应________(填“是”或“不是”)氧化还原反应,用电解法冶炼金属镁的反应______(填“是”或“不是”)氧化还原反应,原因是__________
_____________________________。
将Mg2+沉淀为Mg(OH)2
化合态
不是
是
该反应过
程中元素的化合价发生了变化
(4)电解熔融的氯化镁所得的镁蒸气冷却后即为固体镁,可以冷却镁蒸气的气体氛围为________(填字母)。
A.H2 B.CO2
C.空气 D.O2
A
二、从矿物中提取金属单质
(1)金属冶炼的一般步骤
(2)金属活动性顺序与金属冶炼方法的关系
金属的活动性顺序
K Ca Na Mg Al
Zn Fe Sn Pb (H) Cu
Hg Ag
Pt Au
在自然界中的存在形态
化合态
多数是化合态,极少数是游离态
游离态
主要冶炼方法
电解法
热还原法
热分解法
物理方法
例2 钛(Ti)因为具有神奇的性能越来越引起人们的关注。常温下钛不与非金属、强酸反应,红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛铁矿石之一是金红石(TiO2),目前大规模生产钛的方法是:
(1)第一步:金红石、炭粉混合,在高温条件下通入Cl2制得TiCl4和一种可燃性
气体。该反应的化学方程式为_______________________________,该反应中
的还原剂是________(填化学式)。
C
解析 常温时钛不与非金属、强酸反应;红热时钛可与常见非金属单质反应。可类比一般不活泼金属氧化物,选用碳作还原剂制得金属,金属再与Cl2反应生成氯化物。再合并反应的化学方程式为TiO2+2C+2Cl2 TiCl4+2CO。
(2)第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
①写出此反应的化学方程式:___________________________。
②简述从上述所得产物中获取金属钛的步骤:__________________________
__________________________________________。
将还原后的产物溶于过量的盐
酸中,过滤、洗涤、干燥,即可得到纯净的钛
解析 还原出的Ti与Mg混合,分离时用强酸,因钛不与强酸反应,所以可将上述产物溶于过量的盐酸中,然后过滤、洗涤、干燥,即可得到纯净的钛。
三、六大工业尾气的主要成分及对有害气体的处理
硫酸工厂尾气
SO2、O2、N2等,一般用氨水吸收
硝酸工厂尾气
NO、NO2、N2、O2等,一般用NaOH溶液吸收
高炉煤气
CO、CO2、N2等,一般回收利用
炼钢烟气
Fe2O3烟尘、CO等,一般回收利用
焦炉气
CH4、CO、CO2、C2H4、N2等,可用作燃料
氯碱工业
Cl2,一般用NaOH溶液吸收
例3 改善大气质量、污水处理等都要依靠化学等科学的发展。
(1)正常雨水的pH约为5.6,是因为溶解了__________(填名称)气体的缘故;酸雨的pH______(填“>”“<”或“=”)5.6。SO2是形成酸雨的主要物质之一,生石灰可吸收煤燃烧产生的SO2,反应的化学方程式为___________________。
二氧化碳
解析 酸雨是指pH小于5.6的雨水,正常雨水pH约为5.6是因为空气中的二氧化碳能与水反应生成碳酸,生石灰可吸收煤燃烧产生的SO2,反应的化学方程式为CaO+SO2===CaSO3。
<
CaO+SO2===CaSO3
(2)治理汽车尾气中NO和CO的一种方法是在汽车的排气管上安装催化转化装置,使CO与NO反应,生成无毒气体CO2和N2。该反应的化学方程式为
____________________________。
解析 在催化剂条件下NO和CO反应生成CO2和N2,反应的化学方程式为2NO+2CO N2+2CO2。
(3)减少室内空气污染,下列措施不正确的是______(填字母,下同)。
a.保持室内空气流通
b.选用环保装饰材料,且不过度装修
c.经常喷洒大量香水或空气清新剂
d.在室内种植芦荟、常青藤等绿色植物
(4)污水处理的主要方法有:a.中和法 b.化学沉淀法 c.氧化还原法 d.过滤法,其中属于物理方法的是______。
c
d
解析 在处理污水的过程中,中和法、化学沉淀法、氧化还原法等方法都有新物质生成,都属于化学方法;过滤可以把不溶于水的物质除去,过滤过程中没有新物质生成,属于物理变化,即过滤法属于物理方法。
四、农药、化肥使用注意“四不混”
(1)碱性肥料氨水、草木灰等不能与敌百虫、乐果、甲胺磷、速灭威、托布津井冈霉素、多菌灵、叶蝉散、菊酯类杀虫剂等药混用,否则会降低药效。
(2)碱性农药石硫合剂、波尔多液、松脂合剂等,不能与碳酸氢铵、硫酸铵、硝酸铵、氯化铵等铵态氮肥和过磷酸钙等化肥混用,否则会使氨挥发损失和生成沉淀,降低肥效。
(3)含砷的农药,如砷酸钙、砷酸铝等不能与钾盐、钠盐类化肥混用,否则会产生可溶性砷而发生药害。
(4)化学肥料不能与微生物农药混用,因为化学肥料挥发性、腐蚀性很强,若与微生物农药如杀螟杆菌、青虫菌等混用,则易杀死微生物,降低防治效果。
例4 关心人类健康是化学的重要任务之一。下列说法正确的是
A.正确合理使用食品添加剂可有效改善食品品质
B.人体需要的微量元素只能来自各种营养保健品
C.长期使用青霉素等各种抗生素有利于人体健康
D.蔬菜和水果中富含的维生素可提供人体需要的能量
√
解析 合理使用食品添加剂既不会影响人体健康,又能有效改善食物品质和色、香、味,所以A选项是正确的;
食物中都含有微量元素,不只是来自各种营养保健品,故B错误;
抗生素有耐药性,不能长期使用,故C错误;
维生素是人和动物为维持正常的生理功能而必需从食物中获得的一类微量有机物质,在人体生长、代谢、发育过程中发挥着重要的作用,不能提供能量,故D错误。
例5 历史经验告诉我们,合理地使用化学物质,有利于保护环境,实现可持续发展。下表是一些化学物质对人类发展的贡献带来的问题及解决方法。
物质
贡献
带来问题
解决方法
硫酸铵等化肥
农作物增产
造成赤潮、土壤酸化
合理地使用化学肥料
含磷洗衣粉
容易洗去衣服上沾有的油污等污物
水体富营养化、造成赤潮
研制高效无磷洗衣粉
请回答下列问题:
(1)硫酸铵的化学式为__________,农业上通常使用_______________________
_______________来改良酸性土壤。
(2)对于废弃的塑料制品(包括可降解塑料)宜采用___________的措施,防止污染环境和提高物质的利用率。
(3)不合理使用化学物质对环境造成危害,为保持可持续发展,应开展的研究课题有________(填序号)。
①研制高效低毒农药
②研究无污染、高原子利用率的绿色化学物质的合成方法
③寻求合成可快速降解的塑料和橡胶的方法
(NH4)2SO4
氢氧化钙[或石灰水、熟
石灰、Ca(OH)2]
回收利用
①②③
(4)煤是当今世界最重要的能源之一。煤中含有的氮、硫等元素在燃烧时会生成NO、NO2和_______等气体,会对大气造成污染,而且是导致________形成的主要原因之一。可采取在煤中加入适量石灰石等措施,以减少煤燃烧对大气造成的污染。
SO2
酸雨
返回
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
