2020-2021学年高一化学鲁科版(2019)必修第二册随堂检测(2)元素周期律和元素周期表(解析版)
文档属性
| 名称 | 2020-2021学年高一化学鲁科版(2019)必修第二册随堂检测(2)元素周期律和元素周期表(解析版) |  | |
| 格式 | doc | ||
| 文件大小 | 134.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-02 17:15:38 | ||
图片预览

文档简介
2020-2021学年高一化学鲁科版(2019)必修第二册随堂检测(2)
元素周期律和元素周期表
1.某阳离子的核外共有个电子,核内有个中子,则M的原子序数为( )
A. B. C. D.
2.下列元素中,原子半径最大的是( )
A.Na B.Mg C.Al D.Si
3.X、Y、Z、W四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是(?? )
A.四种元素的原子半径由小到大的顺序为
B.X、Y、Z既能形成离子化合物,又能形成共价化合物
C.X与其余三种元素之间形成的核外电子总数为10的微粒只有2种
D.与HW所含的化学键类型不同
4.已知某原子的结构示意图为,下列有关说法正确的是( )
A.该元素位于第2周期第ⅡA族 B.该元素位于第2周期0族
C.该元素位于第3周期第ⅡA族 D.该元素位于第3周期0族
5.下表为几种短周期元素的性质:
元素编号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径/ 0.66 1.60 1.52 1.10 0.99 1.86 0.70 0.86
最高化合价
+2 +1 +5 +7 +1 +5 +3
最低化合价 -2
-3 -1
-3
下列有关上述元素的说法正确的是( )
A. 最简单气态氢化物的沸点:⑤>①
B.③④位于同一周期
C.上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤
D.元素⑧位于周期表中第3周期ⅢA族
6.1~18号元素中,某元素的最高正化合价与最低负化合价的绝对值之差为4,该元素的离子与跟其核外电子排布相同的离子形成的化合物可能是( )
A. B.MgO C.MgS D.NaF
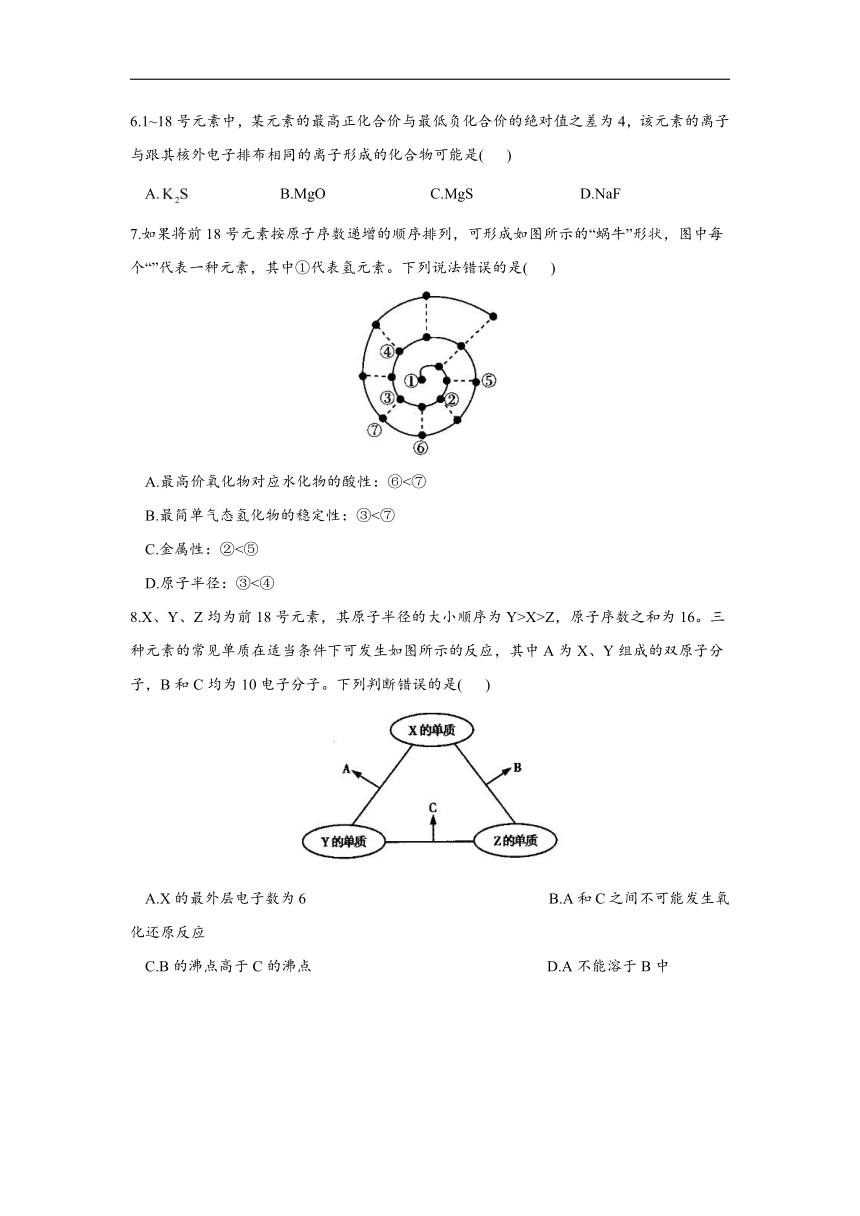
7.如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“”代表一种元素,其中①代表氢元素。下列说法错误的是( )
A.最高价氧化物对应水化物的酸性:⑥<⑦
B.最简单气态氢化物的稳定性:③<⑦
C.金属性:②<⑤
D.原子半径:③<④
8.X、Y、Z均为前18号元素,其原子半径的大小顺序为Y>X>Z,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的反应,其中A为X、Y组成的双原子分子,B和C均为10电子分子。下列判断错误的是( )
A.X的最外层电子数为6 B.A和C之间不可能发生氧化还原反应
C.B的沸点高于C的沸点 D.A不能溶于B中
答案以及解析
1.答案:C
解析:的核外共有个电子,则M原子的电子数为,原子的核外电子数=质子数=元素的原子序数,C项正确。
2.答案:A
解析:Na、Mg、Al、Si四种元素的原子核外均有3个电子层,核电荷数越大,原子半径越小,则原子半径最大的是Na,A项正确。
3.答案:B
解析:根据元素周期表的结构可知,X为H,Y为N,Z为O,W为Cl。原子半径:,故A项错误;H、N、O可以形成,属于共价化合物,可以形成,属于离子化合物,故B项正确;构成的10电子微粒有等,故C项错误;, HW为HCl,二者均只含共价键,D项错误。
4.答案:C
解析:某原子的结构示意图为,该原子的质子数是12,核外电子数是12,是Mg,镁元素位于第3周期第ⅡA族。
5.答案:C
解析:根据原子半径变化规律及最高和最低化合价可判断①为O,②为Mg,③为Li,④为P,⑤为Cl,⑥为Na,⑦为N,⑧为B。常温下,HCl为气体,而为液体,A项错误;Li位于第2周期,P位于第3周期,B项错误;B位于元素周期表中第2周期ⅢA族,D项错误。
6.答案:A
解析:118号元素中,最高正化合价与最低负化合价的绝对值之差为4的元素是S,与核外电子排布相同的离子有等,A项符合题意。
7.答案:BD
解析:①代表氢元素,②~⑦分别代表Be、C、O、Na、 Al、Si元素。元素的非金属性:AlSi,则最简单气态氢化物的稳定性:,B项错误;元素的金属性:Na>Mg、Mg>Be,则金属性:Na>Be,C项正确;同周期主族元素的原子半径随核电荷数的增大而减小,则原子半径:C>O,D项错误。
8.答案:B
解析:B和C均为10电子分子,可考虑它们为氢化物,由图示转化关系可知Z为氢,X、Y、Z的原子序数之和为16,则X、Y的原子序数之和为15,原子半径:Y>X,且A为X、Y组成的双原子分子,则Y为氮元素,X为氧元素,A项正确;由图示转化关系可知,A为NO、B为、C为,C项正确;氨气与NO可以发生氧化还原反应生成氮气与水,B项错误; NO不溶于水,D项正确。
元素周期律和元素周期表
1.某阳离子的核外共有个电子,核内有个中子,则M的原子序数为( )
A. B. C. D.
2.下列元素中,原子半径最大的是( )
A.Na B.Mg C.Al D.Si
3.X、Y、Z、W四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是(?? )
A.四种元素的原子半径由小到大的顺序为
B.X、Y、Z既能形成离子化合物,又能形成共价化合物
C.X与其余三种元素之间形成的核外电子总数为10的微粒只有2种
D.与HW所含的化学键类型不同
4.已知某原子的结构示意图为,下列有关说法正确的是( )
A.该元素位于第2周期第ⅡA族 B.该元素位于第2周期0族
C.该元素位于第3周期第ⅡA族 D.该元素位于第3周期0族
5.下表为几种短周期元素的性质:
元素编号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径/ 0.66 1.60 1.52 1.10 0.99 1.86 0.70 0.86
最高化合价
+2 +1 +5 +7 +1 +5 +3
最低化合价 -2
-3 -1
-3
下列有关上述元素的说法正确的是( )
A. 最简单气态氢化物的沸点:⑤>①
B.③④位于同一周期
C.上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤
D.元素⑧位于周期表中第3周期ⅢA族
6.1~18号元素中,某元素的最高正化合价与最低负化合价的绝对值之差为4,该元素的离子与跟其核外电子排布相同的离子形成的化合物可能是( )
A. B.MgO C.MgS D.NaF
7.如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“”代表一种元素,其中①代表氢元素。下列说法错误的是( )
A.最高价氧化物对应水化物的酸性:⑥<⑦
B.最简单气态氢化物的稳定性:③<⑦
C.金属性:②<⑤
D.原子半径:③<④
8.X、Y、Z均为前18号元素,其原子半径的大小顺序为Y>X>Z,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的反应,其中A为X、Y组成的双原子分子,B和C均为10电子分子。下列判断错误的是( )
A.X的最外层电子数为6 B.A和C之间不可能发生氧化还原反应
C.B的沸点高于C的沸点 D.A不能溶于B中
答案以及解析
1.答案:C
解析:的核外共有个电子,则M原子的电子数为,原子的核外电子数=质子数=元素的原子序数,C项正确。
2.答案:A
解析:Na、Mg、Al、Si四种元素的原子核外均有3个电子层,核电荷数越大,原子半径越小,则原子半径最大的是Na,A项正确。
3.答案:B
解析:根据元素周期表的结构可知,X为H,Y为N,Z为O,W为Cl。原子半径:,故A项错误;H、N、O可以形成,属于共价化合物,可以形成,属于离子化合物,故B项正确;构成的10电子微粒有等,故C项错误;, HW为HCl,二者均只含共价键,D项错误。
4.答案:C
解析:某原子的结构示意图为,该原子的质子数是12,核外电子数是12,是Mg,镁元素位于第3周期第ⅡA族。
5.答案:C
解析:根据原子半径变化规律及最高和最低化合价可判断①为O,②为Mg,③为Li,④为P,⑤为Cl,⑥为Na,⑦为N,⑧为B。常温下,HCl为气体,而为液体,A项错误;Li位于第2周期,P位于第3周期,B项错误;B位于元素周期表中第2周期ⅢA族,D项错误。
6.答案:A
解析:118号元素中,最高正化合价与最低负化合价的绝对值之差为4的元素是S,与核外电子排布相同的离子有等,A项符合题意。
7.答案:BD
解析:①代表氢元素,②~⑦分别代表Be、C、O、Na、 Al、Si元素。元素的非金属性:Al
8.答案:B
解析:B和C均为10电子分子,可考虑它们为氢化物,由图示转化关系可知Z为氢,X、Y、Z的原子序数之和为16,则X、Y的原子序数之和为15,原子半径:Y>X,且A为X、Y组成的双原子分子,则Y为氮元素,X为氧元素,A项正确;由图示转化关系可知,A为NO、B为、C为,C项正确;氨气与NO可以发生氧化还原反应生成氮气与水,B项错误; NO不溶于水,D项正确。
