物质在水中的溶解
图片预览









文档简介
(共51张PPT)
物质在水中
的溶解
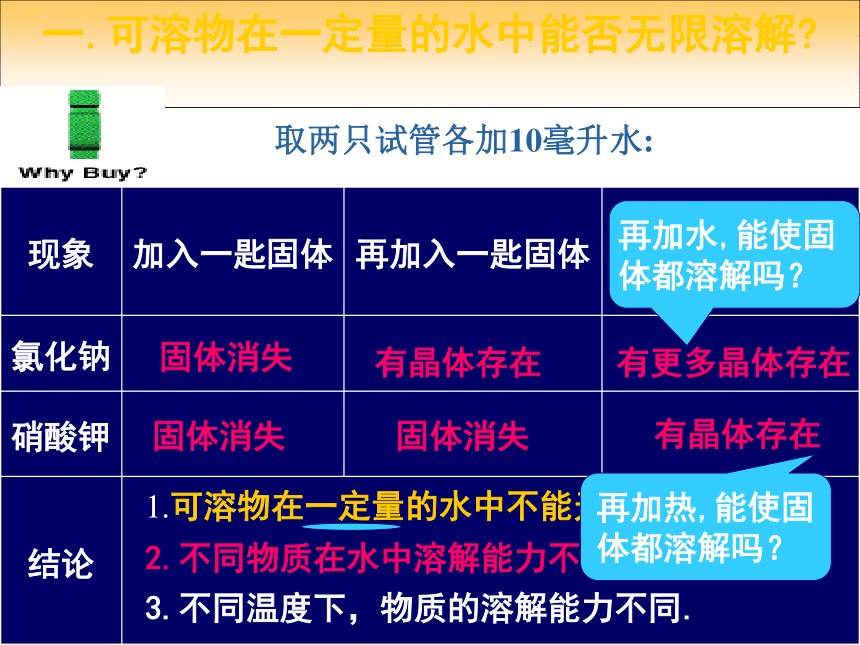
一.可溶物在一定量的水中能否无限溶解
现象 加入一匙固体 再加入一匙固体 再加入一匙固体
氯化钠
硝酸钾
结论
取两只试管各加10毫升水:
固体消失
有晶体存在
有更多晶体存在
固体消失
固体消失
有晶体存在
1.可溶物在一定量的水中不能无限溶解;
2.不同物质在水中溶解能力不一样;
再加水,能使固
体都溶解吗?
再加热,能使固
体都溶解吗?
3.不同温度下,物质的溶解能力不同.
二.溶液的分类:
饱和溶液和不饱和溶液
饱和溶液
在一定温度、一定量的溶剂中,
溶质不能继续溶解的溶液;
1、饱和溶液的前提条件是什么?
2.在上面的前提条件下,关键看什么?
3.为什么必须说明是“这种溶质”的饱和溶液?
一定温度、一定量的溶剂。
溶质是否能继续溶解
在一定温度、一定量的溶剂中,
溶质可以继续溶解的溶液.
不饱和溶液
二.饱和溶液和不饱和溶液
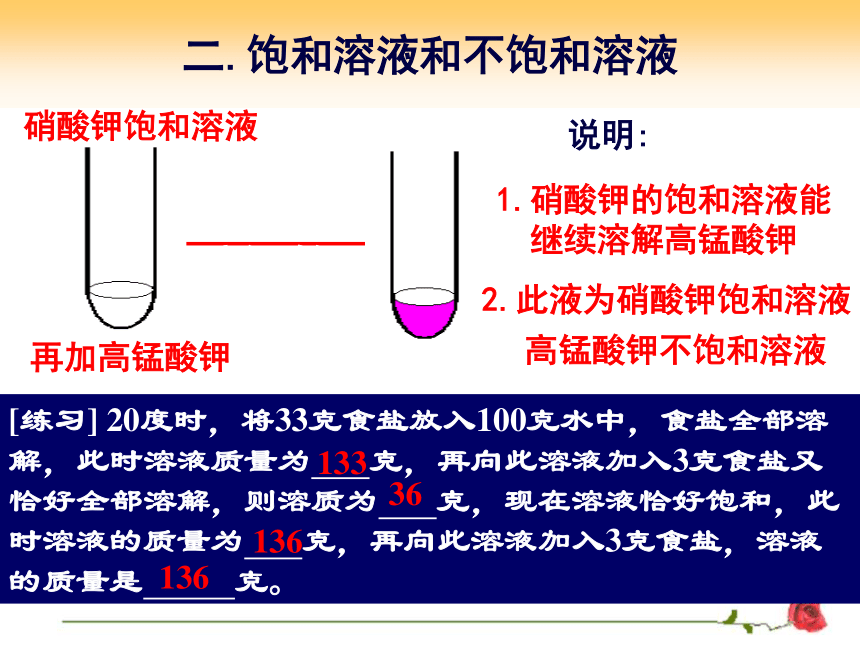
硝酸钾饱和溶液
加入少量
高锰酸钾
说明:
1.硝酸钾的饱和溶液能
继续溶解高锰酸钾
2.此液为硝酸钾饱和溶液
高锰酸钾不饱和溶液
[练习] 20度时,将33克食盐放入100克水中,食盐全部溶解,此时溶液质量为 克,再向此溶液加入3克食盐又恰好全部溶解,则溶质为 克,现在溶液恰好饱和,此时溶液的质量为 克,再向此溶液加入3克食盐,溶液的质量是 克。
133
36
136
136
再加高锰酸钾
【思考、讨论】
怎样判断一种溶液是不是饱和溶液?
1. 如果溶液中有少量未溶的溶质,则是饱和溶液;
2. 加少量的溶质,溶质能继续溶解的是不饱和溶液,不能溶解的是饱和溶液。
1、什么叫饱和溶液?
2、有一杯硝酸钾溶液,要使杯底留有的少量硝酸钾固体溶解,可采用什么方法?
饱和溶液
不饱和溶液
升温或增加溶剂
降温.减少溶剂.加溶质
3、 浓溶液和稀溶液:
在溶液中,溶有较多溶质的叫做浓溶液;有的溶有较少溶质,称为稀溶液。
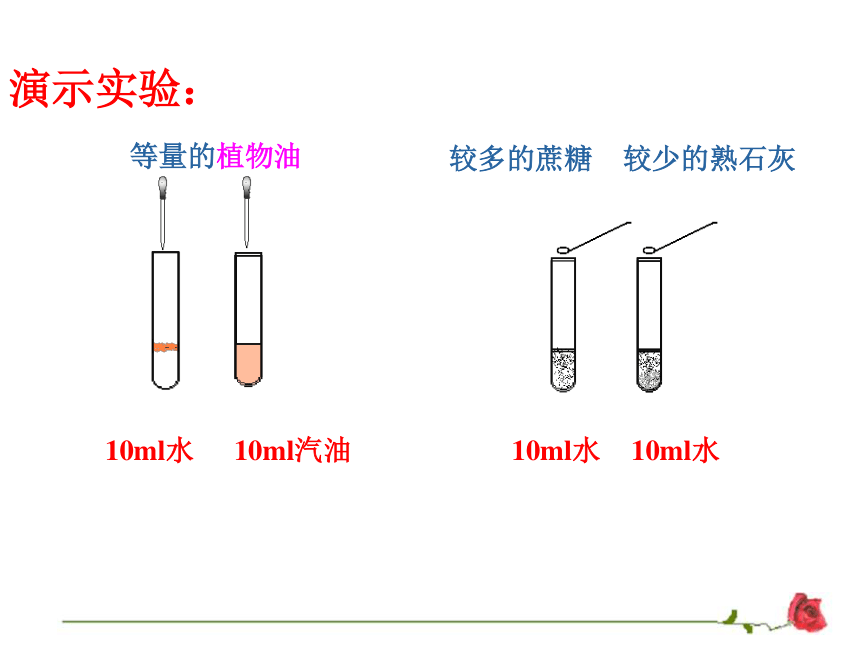
【实验演示】蔗糖、熟石灰在水中溶解的实验
现象:10克蔗糖在10毫升水中溶解了,溶液很浓,但可以继续溶解蔗糖;0.2克熟石灰在10毫升水中溶解得很少,溶液很稀,但已经饱和了不能继续溶解熟石灰。
结论:饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;在同一温度下,对溶质、溶剂一定的溶液来说,饱和溶液比不饱和溶液浓一些。
讨论:饱和溶液和溶液的浓、稀有关吗?
指出下列各题的错误之处,并加以改正:
1.不能再溶解某种溶质的溶液叫饱和溶液;
2.装有饱和溶液的瓶的瓶底,一定有这种溶质的固体;
3.使一接近饱和的溶液变成饱和溶液,可将其中的溶
剂倒出一些;
4. 在同一温度下,同体积的某物质的饱和溶液,一定
会比另一物质的不饱和溶液含有的溶质多;
5.浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液。
在一定温度.一定量的溶剂中,不能…….
不一定,有可能刚好达到饱和.
依然是不饱和溶液.
不一定,这两种物质的溶解能力有可能不同.
浓溶液不一定是饱和溶液
下页
讨 论
1.在一定温度下,某物质的饱和溶液一定是
A.很浓的溶液
B.很稀的溶液
C.不能继续溶解该物质的溶液
D.不能溶解任何物质的溶液.
2.某物质的饱和溶液中,加入一些该溶质的固体,
则下列说法正确的是
A.溶质质量减少;
B.溶液质量增大;
C.固体质量不变;
D.溶质质量增加.
演示实验:
10ml水
10ml汽油
等量的植物油
10ml水
10ml水
较多的蔗糖
较少的熟石灰
(1)
(2)
一、溶解性
定义:
与溶质和溶剂的性质、及温度有关
影响因素:
一种物质溶解在另一种物质的能力
实例:食盐溶于水,而不溶于酒精;油脂易溶于汽油而不易溶于水
表示方法:
溶解性能力的大小常用溶解度来表示
结论:各种溶质的溶解能力不一样。
讨论:
怎样比较物质的溶解能力呢?应该控制哪些条件?
10 ℃
40 ℃
氯化钠
硝酸钾
不行
应该在同一温度下
这样行吗?
氯化钠
硝酸钾
不行
应该溶剂的量相同
这样行吗?
1克氯化钠
1克硝酸钾
100克水能溶解1克氯化钠也能溶解1克氯酸钾,这可以说明氯化钠、氯酸钾的溶解性相同吗?
20克水
不行
应该达到饱和状态
这样行吗?
一定温度
一定状态(达到饱和)
一定溶剂的量、一定溶剂的种类、
比较不同物质的溶解能力,应该控制的条件有:
在一定的温度下,某物质在100 克溶剂中达到饱和状态时所溶解的质量为该物质在这种溶剂里的溶解度。
注意点:
(1)理解这个概念,抓住四个词:一定的温度,100克溶剂(一般为水)、达到饱和、溶解的质量(单位为克)
(2)溶解度值越大,表明该温度下,物质的溶解能力越强.
1、溶解度的含义
一定温度
100克溶剂 (一般指水)
饱和状态
条件---------
标准----------
溶液状态----
单位----------
克
溶解度的四要素
20℃时,蔗糖的溶解度是203.9g,其含义是什么?
20℃时,100g水中最多能够溶解203.9g蔗糖。
20℃时,100g水中溶解203.9g蔗糖,溶液达到饱和状态。
在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是____g。
在0℃时,100g水中最多可溶解13.3g硝酸钾,则0℃时硝酸钾溶解度是_____g。
36
13.3
练习
想一想
下列三句话对不对?为什么?
(1)100克水中最多溶解38克氯化钠,所以氯化钠在水中的溶解度是38克。( )
(2)某温度时,100克氯化钠饱和溶液中溶解中溶解氯化钠15克,氯化钠在该温度时的溶解度是15克。( )
(3) 在t℃时,100克水中溶有75克KNO3,所以t℃时KNO3的溶解度为75克。( )
错
错
错
溶解性等级
易溶
可溶
难溶
微溶
10
1
0.01
20℃的溶解度(克)
想一想:
20℃时NaCl的溶解度为36克,则它属于哪一个溶解性等级? 20℃时Ca(OH)2的溶解度是0.165克,又属于哪一个溶解性等级?
影响固体物质溶解度的因素
影
响
因
素
溶质的种类
溶剂的种类
温 度
注意
溶解度与溶质,
溶剂的质量无关
例题:
40℃时,在120克水中溶解多少克硝酸钠才能达到饱和 (已知40℃时硝酸钾的溶解度为100克/100克水.)
溶解度的计算公式:
溶质 溶解度 溶质 溶解度
—— = —— —— = ————
溶剂 100 溶液 100+溶解度
.
.
.
.
溶解度/
g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
.
硝酸钾
.
.
.
.
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g
硝酸钾在不同温度时的溶解度:
13.3
31.6
20.9
45.8
63.9
85.5
110
138
169
202
246
4、溶解度的表示方法
(1)列表法:
(2)溶解度曲线
溶解度曲线:以温度为横坐标,溶解度为纵坐标形象地描绘出物质的溶解度随温度变化情况的曲线。
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
固体溶解度曲线
1:同种物质在不同温度下的溶解度不同。
2:曲线的交点表示这两种物质在该温度下的溶解度相同。
3:曲线越陡,该物质的溶解度受温度影响越大。
找一找50度各物质的溶解度
含义
点:
表示溶质在不同温度下的溶解度或溶解度受温度的变化情况
线:
表示溶质在某温度下的溶解度
交点:
表示两种溶质在同一温度下具有相同的溶解度
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
100
30
溶解度/
g
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
100
30
温度/℃
100
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
溶解度/
g
温度/℃
熟石灰的溶解度曲线:
讨论:
固体物质溶解度受温度变化影响情况:
大多数固体物质溶解度随温度升高而增大, 例如 硝酸钠、氯化铵等。
少数固体物质溶解度受温度影响不大, 例如食盐。
极少数固体物质溶解度随温度升高反而减小,例如熟石灰。
氢氧化钙(熟石灰)的溶解度曲线图
饱和石灰水
不饱和石灰水
降温.加溶剂
升温.减少溶剂.加溶质
100
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
溶解度/
g
温度/℃
固体的溶解度曲线:
68
134g
小于
B.
4、在40℃时,硝酸钾的溶解度____ (填大于、小于)硝酸钠的溶解度。
练习:
3、在___℃时硝酸钾和硝酸钠的溶解度相同,都约为______。
5、在80℃时氯化钠、氯化钾、氯化铵、硼酸的溶解度由大到小的顺序是_____________________________。
氯化铵、氯化钾、氯化钠、硼酸
(4)50℃时氯化钾的溶解度约是______克。若在100克水中加入30克氯化钾,溶解后能否达到饱和? ,还应加入 克氯化钾才能刚好达到饱和。
40
不能
10
甲
乙
丙
B
温度(℃)
溶解度
(g)
T1 T2
(1)T2时,溶解度最大的是________;
(2)B点代表的含义是
_______________________
_______________;
(3)T1时的甲溶液升温到T2,甲溶液变成
_______________.
甲
T1℃时,甲、丙两种物质
的溶解度相等
不饱和溶液
练 习
温度 ℃
溶
解克
度
t
A
B
1.( )℃时A的溶解度等于B的溶解度
2.( )℃时A的溶解度大于B的溶解度
3.( )℃时A的溶解度小于B的溶解度
等于t
大于t
小于t
填一 填
返回
像 科 学 家 那 样 思 考
请你根据固体物质溶解度的概念,想一想应控制哪些相同条件来比较不同气体的溶解性大小呢?
2、定义:
通常讲的气体溶解度是指该气体在压强为101KPa, 一定温度时溶解在1体积水里达到饱和状态时的气体体积。
0℃时,氧气的溶解度为0.049的含义是什么?
在0℃,氧气压强为101kPa时,1体积水最多能溶解0. 049体积氧气
想一想:
四、气体的溶解度
[讨论] 天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
气体溶解度一般随压强增大而增大,压强减小而减小。
气体溶解度一般随温度升高而减小,温度降低而增大。
1、影响气体溶解度的因素:
拓展性练习
1、20℃时,在100克水中最多能溶解5克某物质,该物质可以认为是( )
A.易溶 B.可溶 C.微溶 D.难溶
2、6℃时硝酸钾的溶解度是110 克,若把80
克硝酸钾放人100克水中充分溶解后,能得
到 的硝酸钾溶液,还需加入 克硝酸钾才能达到饱和状态。
B
180
30
3、工厂生产啤酒的过程中,要在常温下采用
的方法增大二氧化碳在水中的溶
解度,所以啤酒瓶内的压强较大,因此国家规
定啤酒生产中应使用耐压的“B”瓶来灌装啤酒。
拓展性练习
增大压强
三、 溶质的质量分数
1、溶质的质量分数是一种溶液组成的定量表示方法。即一定量的溶液里所含溶质的量。
公式:
溶质的质量分数=
溶质质量
溶液质量
×100%
=
溶质质量
溶剂质量+溶质质量
×100%
A% =
m质
m液
×100%
=
m质
m剂+m质
×100%
说明:没有单位,是一个比值;常用百分数表示
明确溶质的质量分数、溶质、溶剂、溶液的关系:
溶质的质量 不变 不变 增加 减少
溶剂的质量 减少 增加 不变 不变
溶液的质量 减少 增加 增加 减少
溶质的质量分数 变大 变小 变大 变小
2、有关溶质的质量分数计算
㈠已知溶质和溶液或溶剂的质量,求溶质的质量分数
例1 从一瓶氯化钾溶液中取出20g溶液,蒸干后得到2.8g氯化钾固体,则这瓶溶液中溶质的质量分数是多少?
例2 某溶液的密度是1.2g/cm3,实验测得每100ml该溶液中含溶质24g,求该溶液的溶质质量分数?
㈡计算配制一定溶质的质量分数的溶液所需溶质和溶剂的质量
例3 在农业生产上,有时用10%~20%的食盐溶液来选种。如配制150kg16%的食盐溶液,需要食盐和水各多少?
㈢溶液稀释或浓缩的计算
要点:溶液稀释前后,溶质的质量不变
m前 = m后 即 m前 A前% = m后 A后%
例4 把50g 98%的浓硫酸稀释成20%的硫酸,需要水多少毫升?
梯度训练:
10%硫酸 = 1.07g/ml 98%硫酸 = 1.84g/ml
例5 (1)配制1070克10%的稀硫酸溶液需纯硫酸多少克?
(2)配制1000毫升10%的稀硫酸溶液需纯硫酸多少克?
(3)若配制1000毫升10%的稀硫酸溶液需98%浓硫酸多少克?
(4)配制1000毫升10%的稀硫酸溶液需98%浓硫酸多少毫升?
ρ
ρ
溶解度 溶质的质量分数
表示意义 表示物质溶解性大小的量 表示溶质在溶液里所含质量的多少
表示方法 在一定温度下100克溶剂中所能溶解溶质的最大克数 100分质量的溶液里所含溶质的份数
数量单位 克 没有单位。常用小数和分数表示
温度关系 随温度变化而变化 一般不受温度影响,当饱和溶液和晶体共存时饱和溶液质量分数随温度而改变
应用范围 该温度下的饱和溶液 不一定是饱和溶液
质量关系 是溶质质量和溶剂质量的关系: (溶质质量/溶剂质量)×100克 是溶质质量与溶液质量的关系:
溶质质量/溶液质量
相互关系 某温度下饱和溶液的质量分数=溶解度/(溶解度+100克)
注意:
⑴溶液通常是用量筒量取体积来计算的,要注意溶液体积与质量之间的换算,即密度的应用。
⑵对于溶液的稀释或蒸发浓缩的计算,要抓住溶液的稀释或蒸发浓缩前后,溶质的质量不变,即
浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数
3、 体积分数的表示溶液组成的方法:(见阅读材料)
4、配制一定溶质质量分数的溶液步骤:
A、计算(溶剂和溶质的质量或体积)
B、称量(称取或量取)
C、溶解(后装瓶,并贴上标签)
小结
物质在水中
的溶解
一.可溶物在一定量的水中能否无限溶解
现象 加入一匙固体 再加入一匙固体 再加入一匙固体
氯化钠
硝酸钾
结论
取两只试管各加10毫升水:
固体消失
有晶体存在
有更多晶体存在
固体消失
固体消失
有晶体存在
1.可溶物在一定量的水中不能无限溶解;
2.不同物质在水中溶解能力不一样;
再加水,能使固
体都溶解吗?
再加热,能使固
体都溶解吗?
3.不同温度下,物质的溶解能力不同.
二.溶液的分类:
饱和溶液和不饱和溶液
饱和溶液
在一定温度、一定量的溶剂中,
溶质不能继续溶解的溶液;
1、饱和溶液的前提条件是什么?
2.在上面的前提条件下,关键看什么?
3.为什么必须说明是“这种溶质”的饱和溶液?
一定温度、一定量的溶剂。
溶质是否能继续溶解
在一定温度、一定量的溶剂中,
溶质可以继续溶解的溶液.
不饱和溶液
二.饱和溶液和不饱和溶液
硝酸钾饱和溶液
加入少量
高锰酸钾
说明:
1.硝酸钾的饱和溶液能
继续溶解高锰酸钾
2.此液为硝酸钾饱和溶液
高锰酸钾不饱和溶液
[练习] 20度时,将33克食盐放入100克水中,食盐全部溶解,此时溶液质量为 克,再向此溶液加入3克食盐又恰好全部溶解,则溶质为 克,现在溶液恰好饱和,此时溶液的质量为 克,再向此溶液加入3克食盐,溶液的质量是 克。
133
36
136
136
再加高锰酸钾
【思考、讨论】
怎样判断一种溶液是不是饱和溶液?
1. 如果溶液中有少量未溶的溶质,则是饱和溶液;
2. 加少量的溶质,溶质能继续溶解的是不饱和溶液,不能溶解的是饱和溶液。
1、什么叫饱和溶液?
2、有一杯硝酸钾溶液,要使杯底留有的少量硝酸钾固体溶解,可采用什么方法?
饱和溶液
不饱和溶液
升温或增加溶剂
降温.减少溶剂.加溶质
3、 浓溶液和稀溶液:
在溶液中,溶有较多溶质的叫做浓溶液;有的溶有较少溶质,称为稀溶液。
【实验演示】蔗糖、熟石灰在水中溶解的实验
现象:10克蔗糖在10毫升水中溶解了,溶液很浓,但可以继续溶解蔗糖;0.2克熟石灰在10毫升水中溶解得很少,溶液很稀,但已经饱和了不能继续溶解熟石灰。
结论:饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;在同一温度下,对溶质、溶剂一定的溶液来说,饱和溶液比不饱和溶液浓一些。
讨论:饱和溶液和溶液的浓、稀有关吗?
指出下列各题的错误之处,并加以改正:
1.不能再溶解某种溶质的溶液叫饱和溶液;
2.装有饱和溶液的瓶的瓶底,一定有这种溶质的固体;
3.使一接近饱和的溶液变成饱和溶液,可将其中的溶
剂倒出一些;
4. 在同一温度下,同体积的某物质的饱和溶液,一定
会比另一物质的不饱和溶液含有的溶质多;
5.浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液。
在一定温度.一定量的溶剂中,不能…….
不一定,有可能刚好达到饱和.
依然是不饱和溶液.
不一定,这两种物质的溶解能力有可能不同.
浓溶液不一定是饱和溶液
下页
讨 论
1.在一定温度下,某物质的饱和溶液一定是
A.很浓的溶液
B.很稀的溶液
C.不能继续溶解该物质的溶液
D.不能溶解任何物质的溶液.
2.某物质的饱和溶液中,加入一些该溶质的固体,
则下列说法正确的是
A.溶质质量减少;
B.溶液质量增大;
C.固体质量不变;
D.溶质质量增加.
演示实验:
10ml水
10ml汽油
等量的植物油
10ml水
10ml水
较多的蔗糖
较少的熟石灰
(1)
(2)
一、溶解性
定义:
与溶质和溶剂的性质、及温度有关
影响因素:
一种物质溶解在另一种物质的能力
实例:食盐溶于水,而不溶于酒精;油脂易溶于汽油而不易溶于水
表示方法:
溶解性能力的大小常用溶解度来表示
结论:各种溶质的溶解能力不一样。
讨论:
怎样比较物质的溶解能力呢?应该控制哪些条件?
10 ℃
40 ℃
氯化钠
硝酸钾
不行
应该在同一温度下
这样行吗?
氯化钠
硝酸钾
不行
应该溶剂的量相同
这样行吗?
1克氯化钠
1克硝酸钾
100克水能溶解1克氯化钠也能溶解1克氯酸钾,这可以说明氯化钠、氯酸钾的溶解性相同吗?
20克水
不行
应该达到饱和状态
这样行吗?
一定温度
一定状态(达到饱和)
一定溶剂的量、一定溶剂的种类、
比较不同物质的溶解能力,应该控制的条件有:
在一定的温度下,某物质在100 克溶剂中达到饱和状态时所溶解的质量为该物质在这种溶剂里的溶解度。
注意点:
(1)理解这个概念,抓住四个词:一定的温度,100克溶剂(一般为水)、达到饱和、溶解的质量(单位为克)
(2)溶解度值越大,表明该温度下,物质的溶解能力越强.
1、溶解度的含义
一定温度
100克溶剂 (一般指水)
饱和状态
条件---------
标准----------
溶液状态----
单位----------
克
溶解度的四要素
20℃时,蔗糖的溶解度是203.9g,其含义是什么?
20℃时,100g水中最多能够溶解203.9g蔗糖。
20℃时,100g水中溶解203.9g蔗糖,溶液达到饱和状态。
在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是____g。
在0℃时,100g水中最多可溶解13.3g硝酸钾,则0℃时硝酸钾溶解度是_____g。
36
13.3
练习
想一想
下列三句话对不对?为什么?
(1)100克水中最多溶解38克氯化钠,所以氯化钠在水中的溶解度是38克。( )
(2)某温度时,100克氯化钠饱和溶液中溶解中溶解氯化钠15克,氯化钠在该温度时的溶解度是15克。( )
(3) 在t℃时,100克水中溶有75克KNO3,所以t℃时KNO3的溶解度为75克。( )
错
错
错
溶解性等级
易溶
可溶
难溶
微溶
10
1
0.01
20℃的溶解度(克)
想一想:
20℃时NaCl的溶解度为36克,则它属于哪一个溶解性等级? 20℃时Ca(OH)2的溶解度是0.165克,又属于哪一个溶解性等级?
影响固体物质溶解度的因素
影
响
因
素
溶质的种类
溶剂的种类
温 度
注意
溶解度与溶质,
溶剂的质量无关
例题:
40℃时,在120克水中溶解多少克硝酸钠才能达到饱和 (已知40℃时硝酸钾的溶解度为100克/100克水.)
溶解度的计算公式:
溶质 溶解度 溶质 溶解度
—— = —— —— = ————
溶剂 100 溶液 100+溶解度
.
.
.
.
溶解度/
g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
.
硝酸钾
.
.
.
.
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g
硝酸钾在不同温度时的溶解度:
13.3
31.6
20.9
45.8
63.9
85.5
110
138
169
202
246
4、溶解度的表示方法
(1)列表法:
(2)溶解度曲线
溶解度曲线:以温度为横坐标,溶解度为纵坐标形象地描绘出物质的溶解度随温度变化情况的曲线。
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
固体溶解度曲线
1:同种物质在不同温度下的溶解度不同。
2:曲线的交点表示这两种物质在该温度下的溶解度相同。
3:曲线越陡,该物质的溶解度受温度影响越大。
找一找50度各物质的溶解度
含义
点:
表示溶质在不同温度下的溶解度或溶解度受温度的变化情况
线:
表示溶质在某温度下的溶解度
交点:
表示两种溶质在同一温度下具有相同的溶解度
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
100
30
溶解度/
g
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
100
30
温度/℃
100
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
溶解度/
g
温度/℃
熟石灰的溶解度曲线:
讨论:
固体物质溶解度受温度变化影响情况:
大多数固体物质溶解度随温度升高而增大, 例如 硝酸钠、氯化铵等。
少数固体物质溶解度受温度影响不大, 例如食盐。
极少数固体物质溶解度随温度升高反而减小,例如熟石灰。
氢氧化钙(熟石灰)的溶解度曲线图
饱和石灰水
不饱和石灰水
降温.加溶剂
升温.减少溶剂.加溶质
100
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
溶解度/
g
温度/℃
固体的溶解度曲线:
68
134g
小于
B.
4、在40℃时,硝酸钾的溶解度____ (填大于、小于)硝酸钠的溶解度。
练习:
3、在___℃时硝酸钾和硝酸钠的溶解度相同,都约为______。
5、在80℃时氯化钠、氯化钾、氯化铵、硼酸的溶解度由大到小的顺序是_____________________________。
氯化铵、氯化钾、氯化钠、硼酸
(4)50℃时氯化钾的溶解度约是______克。若在100克水中加入30克氯化钾,溶解后能否达到饱和? ,还应加入 克氯化钾才能刚好达到饱和。
40
不能
10
甲
乙
丙
B
温度(℃)
溶解度
(g)
T1 T2
(1)T2时,溶解度最大的是________;
(2)B点代表的含义是
_______________________
_______________;
(3)T1时的甲溶液升温到T2,甲溶液变成
_______________.
甲
T1℃时,甲、丙两种物质
的溶解度相等
不饱和溶液
练 习
温度 ℃
溶
解克
度
t
A
B
1.( )℃时A的溶解度等于B的溶解度
2.( )℃时A的溶解度大于B的溶解度
3.( )℃时A的溶解度小于B的溶解度
等于t
大于t
小于t
填一 填
返回
像 科 学 家 那 样 思 考
请你根据固体物质溶解度的概念,想一想应控制哪些相同条件来比较不同气体的溶解性大小呢?
2、定义:
通常讲的气体溶解度是指该气体在压强为101KPa, 一定温度时溶解在1体积水里达到饱和状态时的气体体积。
0℃时,氧气的溶解度为0.049的含义是什么?
在0℃,氧气压强为101kPa时,1体积水最多能溶解0. 049体积氧气
想一想:
四、气体的溶解度
[讨论] 天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
气体溶解度一般随压强增大而增大,压强减小而减小。
气体溶解度一般随温度升高而减小,温度降低而增大。
1、影响气体溶解度的因素:
拓展性练习
1、20℃时,在100克水中最多能溶解5克某物质,该物质可以认为是( )
A.易溶 B.可溶 C.微溶 D.难溶
2、6℃时硝酸钾的溶解度是110 克,若把80
克硝酸钾放人100克水中充分溶解后,能得
到 的硝酸钾溶液,还需加入 克硝酸钾才能达到饱和状态。
B
180
30
3、工厂生产啤酒的过程中,要在常温下采用
的方法增大二氧化碳在水中的溶
解度,所以啤酒瓶内的压强较大,因此国家规
定啤酒生产中应使用耐压的“B”瓶来灌装啤酒。
拓展性练习
增大压强
三、 溶质的质量分数
1、溶质的质量分数是一种溶液组成的定量表示方法。即一定量的溶液里所含溶质的量。
公式:
溶质的质量分数=
溶质质量
溶液质量
×100%
=
溶质质量
溶剂质量+溶质质量
×100%
A% =
m质
m液
×100%
=
m质
m剂+m质
×100%
说明:没有单位,是一个比值;常用百分数表示
明确溶质的质量分数、溶质、溶剂、溶液的关系:
溶质的质量 不变 不变 增加 减少
溶剂的质量 减少 增加 不变 不变
溶液的质量 减少 增加 增加 减少
溶质的质量分数 变大 变小 变大 变小
2、有关溶质的质量分数计算
㈠已知溶质和溶液或溶剂的质量,求溶质的质量分数
例1 从一瓶氯化钾溶液中取出20g溶液,蒸干后得到2.8g氯化钾固体,则这瓶溶液中溶质的质量分数是多少?
例2 某溶液的密度是1.2g/cm3,实验测得每100ml该溶液中含溶质24g,求该溶液的溶质质量分数?
㈡计算配制一定溶质的质量分数的溶液所需溶质和溶剂的质量
例3 在农业生产上,有时用10%~20%的食盐溶液来选种。如配制150kg16%的食盐溶液,需要食盐和水各多少?
㈢溶液稀释或浓缩的计算
要点:溶液稀释前后,溶质的质量不变
m前 = m后 即 m前 A前% = m后 A后%
例4 把50g 98%的浓硫酸稀释成20%的硫酸,需要水多少毫升?
梯度训练:
10%硫酸 = 1.07g/ml 98%硫酸 = 1.84g/ml
例5 (1)配制1070克10%的稀硫酸溶液需纯硫酸多少克?
(2)配制1000毫升10%的稀硫酸溶液需纯硫酸多少克?
(3)若配制1000毫升10%的稀硫酸溶液需98%浓硫酸多少克?
(4)配制1000毫升10%的稀硫酸溶液需98%浓硫酸多少毫升?
ρ
ρ
溶解度 溶质的质量分数
表示意义 表示物质溶解性大小的量 表示溶质在溶液里所含质量的多少
表示方法 在一定温度下100克溶剂中所能溶解溶质的最大克数 100分质量的溶液里所含溶质的份数
数量单位 克 没有单位。常用小数和分数表示
温度关系 随温度变化而变化 一般不受温度影响,当饱和溶液和晶体共存时饱和溶液质量分数随温度而改变
应用范围 该温度下的饱和溶液 不一定是饱和溶液
质量关系 是溶质质量和溶剂质量的关系: (溶质质量/溶剂质量)×100克 是溶质质量与溶液质量的关系:
溶质质量/溶液质量
相互关系 某温度下饱和溶液的质量分数=溶解度/(溶解度+100克)
注意:
⑴溶液通常是用量筒量取体积来计算的,要注意溶液体积与质量之间的换算,即密度的应用。
⑵对于溶液的稀释或蒸发浓缩的计算,要抓住溶液的稀释或蒸发浓缩前后,溶质的质量不变,即
浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数
3、 体积分数的表示溶液组成的方法:(见阅读材料)
4、配制一定溶质质量分数的溶液步骤:
A、计算(溶剂和溶质的质量或体积)
B、称量(称取或量取)
C、溶解(后装瓶,并贴上标签)
小结
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
