高中化学人教版(新课程标准)选修4化学反应原理第二章化学反应速率和化学平衡章节检测
文档属性
| 名称 | 高中化学人教版(新课程标准)选修4化学反应原理第二章化学反应速率和化学平衡章节检测 |  | |
| 格式 | docx | ||
| 文件大小 | 179.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-31 21:12:56 | ||
图片预览



文档简介
高中化学人教版(新课程标准)选修4化学反应原理第二章化学反应速率和化学平衡章节检测
一、单选题
1.在密闭容器中发生如下反应:
达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.6倍.下列说法中正确的是(
??)
A.?????????????B.?A的转化率降低????????????C.?平衡向正反应方向移动????????????D.?C的体积分数增加
2.被称为人体冷冻学之父的罗伯特·埃廷格在1962年写出《不朽的前景》一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是(??
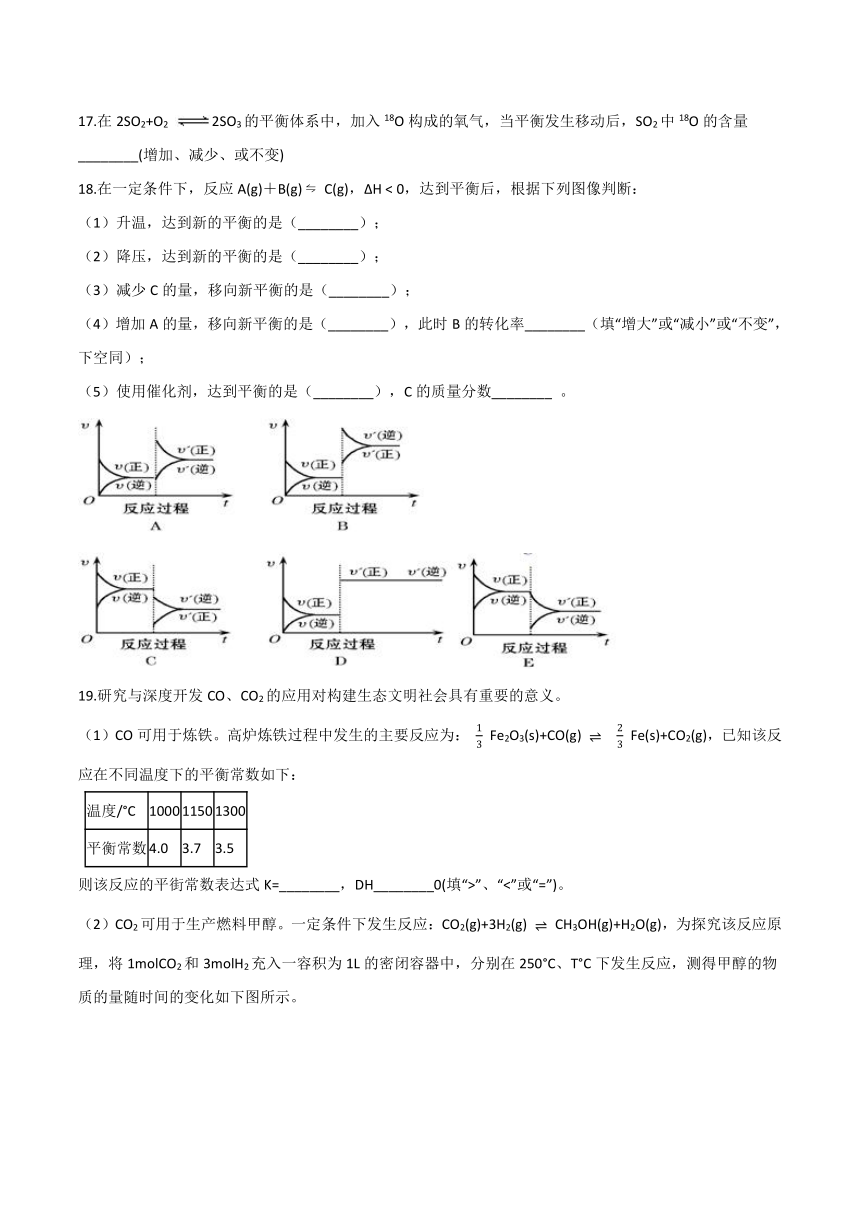
)
A.?化学反应前后质量守恒???????????????????????????????????????B.?低温下分子无法运动
C.?温度降低,化学反应停止????????????????????????????????????D.?温度越低,化学反应越慢
3.下列各组反应(表中物质均为反应物):则反应刚开始时,放出H2的速率最大的是(??
)
编号
金属(粉末状)
/mol
酸的浓度与体积
反应温度
A
Mg-0.1
6mol/L
HNO310
mL
60℃
B
Mg-0.1
3mol/L
HCl
10
mL
60℃
C
Fe-0.1
3mol/L
HCl
10
mL
60℃
D
Mg-0.1
3mol/L
H2SO410
mL
60℃
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
4.NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020
mol·L-1NaHSO3溶液(含少量淀粉)10.0
mL、KIO3(过量)酸性溶液40.0
mL混合,记录10~55
℃间溶液变蓝时间,55
℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断错误的是(
??)
A.?40
℃之前,温度升高反应速率加快,变蓝时间变短
B.?40
℃之后溶液变蓝的时间随温度的升高变长
C.?图中b、c两点对应的NaHSO3的反应速率相等
D.?图中a点对应的NaHSO3的反应速率为5.0×10-5mol·L-1·s-1
5.可逆反应
aA(s)
+
bB(g)?cC(g)
+
dD(g)进行过程中,当其他条件不变时,C
的体积分数
C%与温度(T)、压强(P)的关系如图所示。下列叙述正确的是(???
)
A.?化学方程式中,b
>
c
+
d?????????????????????????????????
??B.?达到平衡后,加入催化剂,C
的体积分数增大
C.?达到平衡后,升高温度,平衡向左移动???????????????D.?在P1时化学平衡常数大于P2时化学平衡常数
6.对于300mL1mol/L盐酸与铁片的反应,采取下列措施:
①升高温度??????????????????
②改用100mL
3mol/L盐酸
③再加300mL
1mol/L盐酸?
④用等量铁粉代替铁片
⑤改用100mL
98%的硫酸??
其中能使反应速率加快的是(?
)
A.?①②④??????????????????????????????B.?①③④??????????????????????????????C.?①②③④??????????????????????????????D.?①②③⑤
7.在Zn+H2SO4=ZnSO4+H2?反应中,2分钟内硫酸浓度由l.5mol·L-1降至1.1mol·L-1
,
则2分钟内用硫酸表示的平均反应速率为(
??)
A.?0.1mol·L-1·min-1?????????B.?0.2mo1·L-1·min-1?????????C.?0.3mol·L-1·min-1?????????D.?0.4mo1·L-1·min-1
8.将0.1
mol/L
CH3COOH溶液加水稀释或加入少量CH3COONa晶体,都会引起
(??
)
A.?溶液的pH增加??????B.?溶液中c(CH3COO-)减小??????C.?溶液的导电能力减弱??????D.?溶液中c(OH-)减小
9.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)
Z(g)+W(s)△H>0,下列叙述正确的是(
??)
A.?加入少量W,逆反应速率增大,平衡逆向移动。
B.?当容器中气体压强不变时,反应达到平衡。
C.?升高温度,正反应速率增大,逆反应速率减小,平衡正向移动。
D.?平衡后加入X,平衡正向移动,两种反应物的转化率均增大。
10.某反应CH3OH(l)+NH3(g)
CH3NH2(g)+H2O(g)在高温时才能自发进行。下列对该反应过程的ΔH、ΔS判断正确的是(???
)。
A.?ΔH>0,ΔS<0????????????????B.?ΔH<0,ΔS<0????????????????C.?ΔH>0,ΔS>0????????????????D.?ΔH<0,ΔS>0
11.反应2A(g)
2Y(g)
+
E(g)ΔH>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是(?
)
A.?加压?????????????????????????????????B.?减压?????????????????????????????????C.?减小E的浓度?????????????????????????????????D.?降温
12.在一定条件下,反应A(g)+2B(g)
3C(g)达到平衡的标志是(???
)
A.?容器内压强不再变化???????????????????????????????????????????B.?单位时间内生成nmolA同时生成2nmolB
C.?A,B,C浓度不再变化???????????????????????????????????????D.?A,B,C的分子数之比为1:2:3
13.关于A(g)+2B(g)=3C(g)的化学反应,下列表示的反应速率最大的是(??
)
A.?v(A)=0.6
mol·L-1·min-1
B.?v(B)=1.2
mol·L-1·min-1
C.?v(C)=1.2
mol·L-1·min-1
D.?v(B)=0.03
mol·L-1·s-1
14.在某2
L恒容密闭容器中充入2
mol
X(g)和1
mol
Y(g)发生反应:2X(g)+Y(g)
3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是(??
)
A.?M点时,Y的转化率最大
B.?升高温度,平衡常数减小
C.?W点时
v正
=
v逆
D.?W、M两点Y的正反应速率相同
15.在一个1L的密闭容器中加2molA和1molB发生反应:
2A(g)+B(g)
3C(g)+D(s),达到平衡时C的浓度为1.2mol/L
,
C的体积分数为a%
。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,C的体积分数仍为a%
的是(??
)
A.?6mol
C+2mol
D
B.?4mol
A+2mol
B
C.?1mol
A+0.5mol
B+1.5mol
C
D.?3mol
C+5mol
D
二、填空题
16.对于反应A
+
3B
=
2C
+
2D
,在四种不同情况下的反应速率分别vA
=0.15mol/(L.S)
,
vB=0.6mol/(L.S)
,vC
=0.4
mol/(L.S)
,vD
=0.45
mol/(L.S),则在不同情况下,反应由快到慢的顺序是________
17.在2SO2+O2
2SO3的平衡体系中,加入18O构成的氧气,当平衡发生移动后,SO2中18O的含量________(增加、减少、或不变)
18.在一定条件下,反应A(g)+B(g)
?
C(g),?H
<
0,达到平衡后,根据下列图像判断:
(1)升温,达到新的平衡的是(________);
(2)降压,达到新的平衡的是(________);
(3)减少C的量,移向新平衡的是(________);
(4)增加A的量,移向新平衡的是(________),此时B的转化率________(填“增大”或“减小”或“不变”,下空同);
(5)使用催化剂,达到平衡的是(________),C的质量分数________
。
19.研究与深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁。高炉炼铁过程中发生的主要反应为:
Fe2O3(s)+CO(g)
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/°C
1000
1150
1300
平衡常数
4.0
3.7
3.5
则该反应的平街常数表达式K=________,DH________0(填“>”、“<”或“=”)。
(2)CO2可用于生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g),为探究该反应原理,将1molCO2和3molH2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
请分析并回答下列问题:
250°C时,反应在前10min的平均速率v(H2)________mol×L-1min-1
,
从反应开始到平衡,CO2转化率为________%。相同温度下,若某时刻该容器中含有1molH2、1.2molCO2、0.8molCH3OH、1.5molH2O,则此时反应所处的状态为________(填“向正反应方向进行中”、“向逆反应方向进行中心”或“平衡状态”)。
20.现有反应mA(g)+nB(g)
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)若加入B(容器体积不变),则A的转化率________(填增大、减小或不变,下同),B的转化率________。
(2)若升高温度,则平衡时
B、C的浓度之比
将________(填增大、减小或不变)。
(3)若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色________(填变深、变浅或不变,下同),而维持容器内压强不变,充入Ne时,混合物的颜色________。
三、实验探究题
21.某化学反应2A
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为________mol/(L·min)。
(2)在实验2,A的初始浓度c2=________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为v3
,
实验1的反应速率为v1
,
则v3________v1(填>、=、<),且c3________1.0
mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。理由是?
________
22.硫—碘循环分解水制氢主要涉及下列反应:
(1)Ⅰ.SO2+2H2O+I2=H2SO4+2HI;Ⅱ.2HI
H2+I2
;Ⅲ.2H2SO4=2SO2+O2+2H2O。
分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1
mol
O2的同时产生1
mol
H2
(2)一定温度下,向1
L密闭容器中加入1
mol
HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0~2
min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)
2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2
,
反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3?????
b.CuSO4
c.Na2SO4?????
d.NaHSO3
23.某实验小组同学依据资料深入探究Fe3+在水溶液中的行为。
资料:i.Fe3+
在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;
[Fe(H2O)6]3+发生如下水解反应:
[Fe(H2O)6]3+(几乎无色)+nH2O
[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=0~6);
ii.[FeCl4(H2O)2]-为黄色。
【实验I】
【实验II】
分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。
Fe(NO3)3溶液透光率随温度变化曲线???
?FeCl3溶液透光率随温度变化曲线
(1)实验I中,试管②溶液变为无色的原因是________。
(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是________。
(3)由实验II图1、2可知:加热时,溶液颜色________(填“变浅”、“变深”或“不变”)。
(4)由实验II,可以得出如下结论:
[结论一]FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O
[Fe(H2O)6]3++4Cl-
得出此结论的理由是________。
[结论二]
结论一中反应的ΔH
________(填“>0”或“<0”)。
(5)实验小组同学重新设计了一个实验证明(4)中结论一。实验方案:取试管①中溶液,________(请描述必要的实验操作和现象)。
参考答案
1
B
2
D
3
D
4
C
5
C
6
A
7
B
8
A
9
B
10
C
11
D
12
C
13
D
14
B
15
D
16
④>③=②>①
17
增加
18
(1)B
(2)C
(3)E
(4)A;增大
(5)D;不变
19
(1);<
(2)0.225mol/(L?min);75%;向正反应方向进行中
20
(1)增大;减小
(2)减小
(3)变深;变浅
21
(1)0.013
(2)1.0;催化剂
(3)>;>
(4)吸热;温度升高时,平衡向右移动
22
(1)c
(2)0.1
mol·L-1·min-1;64;b
(3)向右;b
23
(1)由已知:[Fe(H2O)6]3++
nH2O
[Fe(H2O)6-n(OH)n]3-n+
nH3O+
加入HNO3后,c(H+)增大,导致此平衡逆向移动,溶液由黄色变为无色。
(2)②中溶液褪色,而④中溶液黄色。
(3)变深
(4)升高或降低相同温度时,FeCl3溶液透光率随温度变化幅度明显大于Fe(NO3)3溶液,说明在FeCl3溶液中存在水合铁离子的水解平衡之外,还存在[FeCl4(H2O)2]-
+
4H2O
[Fe(H2O)6]3+
+
4Cl-;<
(5)先滴加HNO3
,
再滴加几滴NaCl溶液,最后测此溶液透光率随温度改变的变化情况。若通过以上操作,经由先褪色再变黄后的溶液,透光率随温度升高而减小,随温度下降而增大,则证明了(4)中结论一。
一、单选题
1.在密闭容器中发生如下反应:
达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.6倍.下列说法中正确的是(
??)
A.?????????????B.?A的转化率降低????????????C.?平衡向正反应方向移动????????????D.?C的体积分数增加
2.被称为人体冷冻学之父的罗伯特·埃廷格在1962年写出《不朽的前景》一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是(??
)
A.?化学反应前后质量守恒???????????????????????????????????????B.?低温下分子无法运动
C.?温度降低,化学反应停止????????????????????????????????????D.?温度越低,化学反应越慢
3.下列各组反应(表中物质均为反应物):则反应刚开始时,放出H2的速率最大的是(??
)
编号
金属(粉末状)
/mol
酸的浓度与体积
反应温度
A
Mg-0.1
6mol/L
HNO310
mL
60℃
B
Mg-0.1
3mol/L
HCl
10
mL
60℃
C
Fe-0.1
3mol/L
HCl
10
mL
60℃
D
Mg-0.1
3mol/L
H2SO410
mL
60℃
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
4.NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020
mol·L-1NaHSO3溶液(含少量淀粉)10.0
mL、KIO3(过量)酸性溶液40.0
mL混合,记录10~55
℃间溶液变蓝时间,55
℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断错误的是(
??)
A.?40
℃之前,温度升高反应速率加快,变蓝时间变短
B.?40
℃之后溶液变蓝的时间随温度的升高变长
C.?图中b、c两点对应的NaHSO3的反应速率相等
D.?图中a点对应的NaHSO3的反应速率为5.0×10-5mol·L-1·s-1
5.可逆反应
aA(s)
+
bB(g)?cC(g)
+
dD(g)进行过程中,当其他条件不变时,C
的体积分数
C%与温度(T)、压强(P)的关系如图所示。下列叙述正确的是(???
)
A.?化学方程式中,b
>
c
+
d?????????????????????????????????
??B.?达到平衡后,加入催化剂,C
的体积分数增大
C.?达到平衡后,升高温度,平衡向左移动???????????????D.?在P1时化学平衡常数大于P2时化学平衡常数
6.对于300mL1mol/L盐酸与铁片的反应,采取下列措施:
①升高温度??????????????????
②改用100mL
3mol/L盐酸
③再加300mL
1mol/L盐酸?
④用等量铁粉代替铁片
⑤改用100mL
98%的硫酸??
其中能使反应速率加快的是(?
)
A.?①②④??????????????????????????????B.?①③④??????????????????????????????C.?①②③④??????????????????????????????D.?①②③⑤
7.在Zn+H2SO4=ZnSO4+H2?反应中,2分钟内硫酸浓度由l.5mol·L-1降至1.1mol·L-1
,
则2分钟内用硫酸表示的平均反应速率为(
??)
A.?0.1mol·L-1·min-1?????????B.?0.2mo1·L-1·min-1?????????C.?0.3mol·L-1·min-1?????????D.?0.4mo1·L-1·min-1
8.将0.1
mol/L
CH3COOH溶液加水稀释或加入少量CH3COONa晶体,都会引起
(??
)
A.?溶液的pH增加??????B.?溶液中c(CH3COO-)减小??????C.?溶液的导电能力减弱??????D.?溶液中c(OH-)减小
9.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)
Z(g)+W(s)△H>0,下列叙述正确的是(
??)
A.?加入少量W,逆反应速率增大,平衡逆向移动。
B.?当容器中气体压强不变时,反应达到平衡。
C.?升高温度,正反应速率增大,逆反应速率减小,平衡正向移动。
D.?平衡后加入X,平衡正向移动,两种反应物的转化率均增大。
10.某反应CH3OH(l)+NH3(g)
CH3NH2(g)+H2O(g)在高温时才能自发进行。下列对该反应过程的ΔH、ΔS判断正确的是(???
)。
A.?ΔH>0,ΔS<0????????????????B.?ΔH<0,ΔS<0????????????????C.?ΔH>0,ΔS>0????????????????D.?ΔH<0,ΔS>0
11.反应2A(g)
2Y(g)
+
E(g)ΔH>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是(?
)
A.?加压?????????????????????????????????B.?减压?????????????????????????????????C.?减小E的浓度?????????????????????????????????D.?降温
12.在一定条件下,反应A(g)+2B(g)
3C(g)达到平衡的标志是(???
)
A.?容器内压强不再变化???????????????????????????????????????????B.?单位时间内生成nmolA同时生成2nmolB
C.?A,B,C浓度不再变化???????????????????????????????????????D.?A,B,C的分子数之比为1:2:3
13.关于A(g)+2B(g)=3C(g)的化学反应,下列表示的反应速率最大的是(??
)
A.?v(A)=0.6
mol·L-1·min-1
B.?v(B)=1.2
mol·L-1·min-1
C.?v(C)=1.2
mol·L-1·min-1
D.?v(B)=0.03
mol·L-1·s-1
14.在某2
L恒容密闭容器中充入2
mol
X(g)和1
mol
Y(g)发生反应:2X(g)+Y(g)
3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是(??
)
A.?M点时,Y的转化率最大
B.?升高温度,平衡常数减小
C.?W点时
v正
=
v逆
D.?W、M两点Y的正反应速率相同
15.在一个1L的密闭容器中加2molA和1molB发生反应:
2A(g)+B(g)
3C(g)+D(s),达到平衡时C的浓度为1.2mol/L
,
C的体积分数为a%
。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,C的体积分数仍为a%
的是(??
)
A.?6mol
C+2mol
D
B.?4mol
A+2mol
B
C.?1mol
A+0.5mol
B+1.5mol
C
D.?3mol
C+5mol
D
二、填空题
16.对于反应A
+
3B
=
2C
+
2D
,在四种不同情况下的反应速率分别vA
=0.15mol/(L.S)
,
vB=0.6mol/(L.S)
,vC
=0.4
mol/(L.S)
,vD
=0.45
mol/(L.S),则在不同情况下,反应由快到慢的顺序是________
17.在2SO2+O2
2SO3的平衡体系中,加入18O构成的氧气,当平衡发生移动后,SO2中18O的含量________(增加、减少、或不变)
18.在一定条件下,反应A(g)+B(g)
?
C(g),?H
<
0,达到平衡后,根据下列图像判断:
(1)升温,达到新的平衡的是(________);
(2)降压,达到新的平衡的是(________);
(3)减少C的量,移向新平衡的是(________);
(4)增加A的量,移向新平衡的是(________),此时B的转化率________(填“增大”或“减小”或“不变”,下空同);
(5)使用催化剂,达到平衡的是(________),C的质量分数________
。
19.研究与深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁。高炉炼铁过程中发生的主要反应为:
Fe2O3(s)+CO(g)
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/°C
1000
1150
1300
平衡常数
4.0
3.7
3.5
则该反应的平街常数表达式K=________,DH________0(填“>”、“<”或“=”)。
(2)CO2可用于生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g),为探究该反应原理,将1molCO2和3molH2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
请分析并回答下列问题:
250°C时,反应在前10min的平均速率v(H2)________mol×L-1min-1
,
从反应开始到平衡,CO2转化率为________%。相同温度下,若某时刻该容器中含有1molH2、1.2molCO2、0.8molCH3OH、1.5molH2O,则此时反应所处的状态为________(填“向正反应方向进行中”、“向逆反应方向进行中心”或“平衡状态”)。
20.现有反应mA(g)+nB(g)
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)若加入B(容器体积不变),则A的转化率________(填增大、减小或不变,下同),B的转化率________。
(2)若升高温度,则平衡时
B、C的浓度之比
将________(填增大、减小或不变)。
(3)若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色________(填变深、变浅或不变,下同),而维持容器内压强不变,充入Ne时,混合物的颜色________。
三、实验探究题
21.某化学反应2A
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为________mol/(L·min)。
(2)在实验2,A的初始浓度c2=________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为v3
,
实验1的反应速率为v1
,
则v3________v1(填>、=、<),且c3________1.0
mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。理由是?
________
22.硫—碘循环分解水制氢主要涉及下列反应:
(1)Ⅰ.SO2+2H2O+I2=H2SO4+2HI;Ⅱ.2HI
H2+I2
;Ⅲ.2H2SO4=2SO2+O2+2H2O。
分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1
mol
O2的同时产生1
mol
H2
(2)一定温度下,向1
L密闭容器中加入1
mol
HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0~2
min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)
2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2
,
反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3?????
b.CuSO4
c.Na2SO4?????
d.NaHSO3
23.某实验小组同学依据资料深入探究Fe3+在水溶液中的行为。
资料:i.Fe3+
在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;
[Fe(H2O)6]3+发生如下水解反应:
[Fe(H2O)6]3+(几乎无色)+nH2O
[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=0~6);
ii.[FeCl4(H2O)2]-为黄色。
【实验I】
【实验II】
分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。
Fe(NO3)3溶液透光率随温度变化曲线???
?FeCl3溶液透光率随温度变化曲线
(1)实验I中,试管②溶液变为无色的原因是________。
(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是________。
(3)由实验II图1、2可知:加热时,溶液颜色________(填“变浅”、“变深”或“不变”)。
(4)由实验II,可以得出如下结论:
[结论一]FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O
[Fe(H2O)6]3++4Cl-
得出此结论的理由是________。
[结论二]
结论一中反应的ΔH
________(填“>0”或“<0”)。
(5)实验小组同学重新设计了一个实验证明(4)中结论一。实验方案:取试管①中溶液,________(请描述必要的实验操作和现象)。
参考答案
1
B
2
D
3
D
4
C
5
C
6
A
7
B
8
A
9
B
10
C
11
D
12
C
13
D
14
B
15
D
16
④>③=②>①
17
增加
18
(1)B
(2)C
(3)E
(4)A;增大
(5)D;不变
19
(1);<
(2)0.225mol/(L?min);75%;向正反应方向进行中
20
(1)增大;减小
(2)减小
(3)变深;变浅
21
(1)0.013
(2)1.0;催化剂
(3)>;>
(4)吸热;温度升高时,平衡向右移动
22
(1)c
(2)0.1
mol·L-1·min-1;64;b
(3)向右;b
23
(1)由已知:[Fe(H2O)6]3++
nH2O
[Fe(H2O)6-n(OH)n]3-n+
nH3O+
加入HNO3后,c(H+)增大,导致此平衡逆向移动,溶液由黄色变为无色。
(2)②中溶液褪色,而④中溶液黄色。
(3)变深
(4)升高或降低相同温度时,FeCl3溶液透光率随温度变化幅度明显大于Fe(NO3)3溶液,说明在FeCl3溶液中存在水合铁离子的水解平衡之外,还存在[FeCl4(H2O)2]-
+
4H2O
[Fe(H2O)6]3+
+
4Cl-;<
(5)先滴加HNO3
,
再滴加几滴NaCl溶液,最后测此溶液透光率随温度改变的变化情况。若通过以上操作,经由先褪色再变黄后的溶液,透光率随温度升高而减小,随温度下降而增大,则证明了(4)中结论一。
