高中化学人教版(新课程标准)选修6实验化学第四单元研究性实验章节检测
文档属性
| 名称 | 高中化学人教版(新课程标准)选修6实验化学第四单元研究性实验章节检测 |  | |
| 格式 | docx | ||
| 文件大小 | 117.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-01 09:27:17 | ||
图片预览



文档简介
高中化学人教版(新课程标准)选修6实验化学第四单元研究性实验章节检测
一、单选题
1.关于铝热反应,下列描述正确的是(???
)
A.?铝热剂可以是Fe和Al2O3?????????B.?可溶于氨水?????????C.?反应放出大量热?????????D.?属于非氧化还原反应
2.化学与生产、生活、社会密切相关,下列有关说法中正确的是(??
)
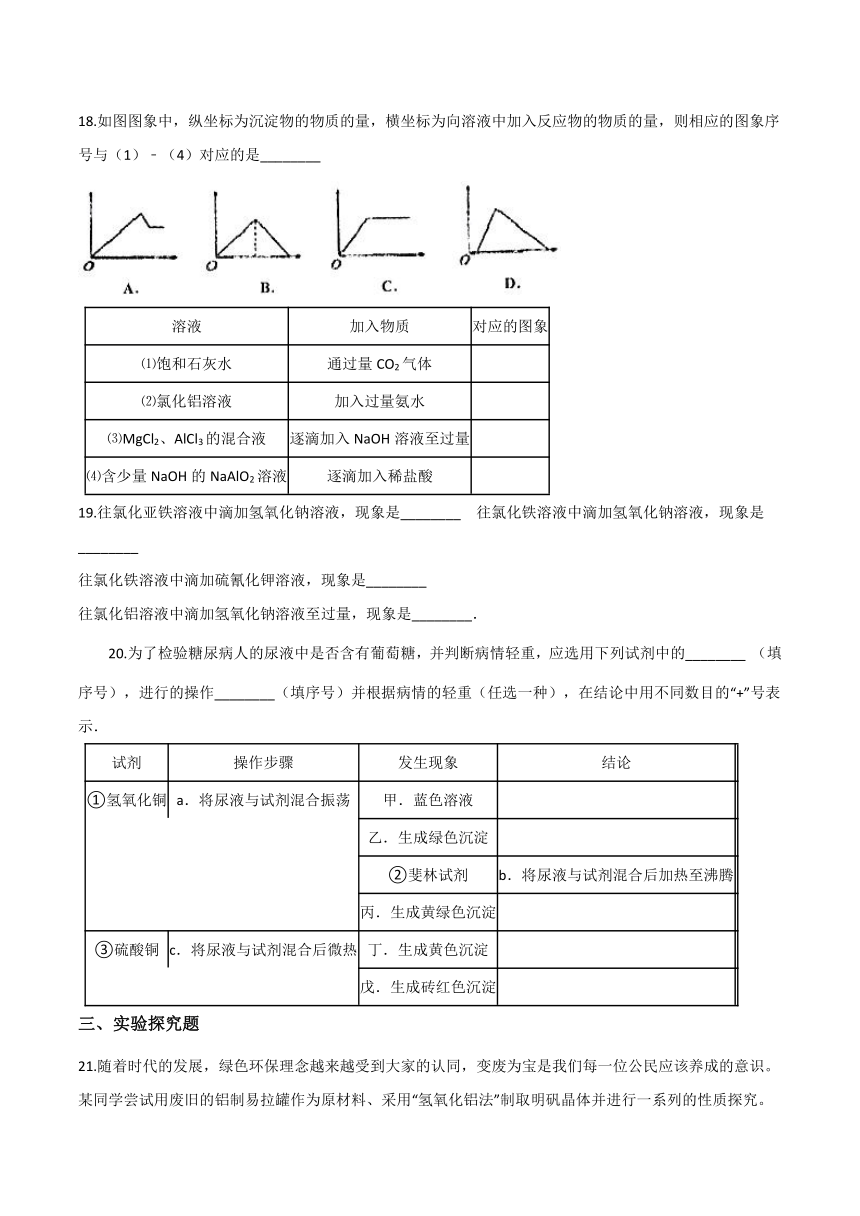
A.?二氧化硫有毒,严禁将其添加到任何食品和饮料中
B.?古有“青蒿一握,以水二升渍,绞取汁”,今用乙醚从黄花蒿中提取青蒿素是利用氧化还原反应原理
C.?面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,也属于离子化合物,其阴阳离子个数比为2∶1
D.?用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,但与氯气不同的是不产生有机氯对人体造成危害、
3.下列相关实验设计不能达到预期目的的是(
?)
选项
实验设计
预期目的
A
相同温度下,等质量的大理石块、大理石粉分别与等体积、等浓度的盐酸反应
探究接触面积对化学反应速率的影响
B
把装有颜色相同的NO2和N2O4混合气体的两支试管(密封)分别浸入冷水和热水中
探究温度对化学平衡的影响
C
用MgCl2和AlCl3分别与过量氨水反应
探究Mg、Al的金属性强弱
D
往盛有葡萄糖溶液的试管中滴入新制氢氧化铜悬浊液,加热
探究葡萄糖的化学性质
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
4.下列说法错误的是(
??)
A.?将氯气通入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色
B.?广范pH试纸测得某酸性溶液的pH为5.5
C.?用澄清石灰水鉴别CO和CO2
D.?金属钠着火时,可用细沙覆盖灭火
5.下列图像正确的是(???
)
A.?
B.?
C.?
D.?
6.下列离子方程式书写正确的是(
??)
A.?向(NH4)2Fe(SO4)2溶液中加入过量NaOH溶液:2NH
+Fe3++5OH-=2NH3·H2O+Fe(OH)3↓
B.?用稀氢碘酸除去铁制品表面的铁锈:Fe2O3+6H+=2Fe3++3H2O
C.?泡沫灭火器使用时发生的反应:Al3++3HCO
=Al(OH)3↓+3CO2↑
D.?向饱和碳酸钠溶液中通入过量的二氧化碳气体:CO
+CO2+
H2O=2HCO
7.下列有关金属性质的描述,符合事实的是(??
)
A.?金属钠暴露在空气中,表面变暗,生成白色的过氧化钠固体
B.?用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼白光,放出大量热,生成白色固体
C.?用坩埚钳夹住一小块铝箔,在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落
D.?金属铝比铁活泼,因此在空气中,铁制品比铝制品耐腐蚀
8.下列物质的转化在给定条件下能实现的是(
??)
A.?NaCl(ag)
?NaHCO3(s)
?Na2CO3(s)
B.?Si
SiO2
H2SiO3
C.?CuCl2
?
Cu(OH)2
Cu2O
D.?MgO(s)
Mg(NO3)2
(aq)
?Mg(s)
9.在含有Fe2+、Fe3+、Al3+、NH4+的溶液中加入足量的Na2O2固体,再加入过量的稀盐酸,完全反应后,离子数目几乎没有改变的是(?
)
A.?Fe2+??????????????????????????????????B.?Fe3+?????
??????????????????????????????????C.?Al3+??????????????????????????????????D.?NH4+
10.向明矾(KAl(SO4)2·12H2O)溶液中滴入Ba(OH)2溶液,当SO42-沉淀完全时,铝元素的存在形式是:(
??)
A.?Al(OH)3和Al3+???????????????????????????
B.?Al(OH)3和AlO2-
C.?全部为Al(OH)3?????????????????????????
?
D.?全部为AlO2-
11.下列关于Cl2的实验操作能达到实验目的的是(??
)
A.?用装置甲制取少量Cl2????????????????????B.?用装置乙除去Cl2中的HCl
C.?用装置丙收集Cl2???????????????????????D.?用装置丁吸收尾气
12.“84消毒液”可消杀新冠病毒,可用Cl2与NaOH溶液反应制备。下列关于“84消毒液”的说法错误的是(??
)
A.?属于胶体????????????????B.?有效成分为NaClO????????????????C.?室温下溶液pH大于7????????????????D.?有强氧化性
13.已知NH4++AlO2-+2H2O=Al(OH)3↓+NH3·H2O,向含有等物质的量的NH4+、Al3+、H+的混合溶液中,慢慢滴加NaOH溶液直至过量,并不断搅拌,发生以下离子反应:
①H++OH-=H2O
②Al(OH)3+OH-=AlO2-+2H2O
③Al3++3OH-=Al(OH)3↓
④NH4++OH-=NH3·H2O
先后顺序正确的是(??
)
A.?①→②→③→④?????????????B.?①→③→②→④?????????????C.?①→③→④→②?????????????D.?①→④→②→③
14.为了除去铁粉中的少量铝粉,可以选取的试剂是(???
)
A.?浓盐酸???????????????????????????B.?浓硝酸???????????????????????????C.?浓硫酸???????????????????????????D.?浓氢氧化钠溶液
15.既能与盐酸反应,又能与氢氧化钠溶液反应的是(???
)
A.?金属铁????????????????????????????????B.?金属铜????????????????????????????????C.?金属钠????????????????????????????????D.?金属铝
二、填空题
16.请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸:________.
17.某同学欲检验抗酸药中是否含有Al(OH)3
,
操作如下:取药剂3~4片研碎,向样品中加入过量的盐酸,过滤,得澄清溶液,向澄清溶液中滴加NaOH溶液,观察到有白色沉淀,继续加过量NaOH溶液,白色沉淀又溶解。你能得出该抗酸药中是否含有Al(OH)3?________(填含或不含),请写出有关反应的化学方程式:
①________
②________
③________
18.如图图象中,纵坐标为沉淀物的物质的量,横坐标为向溶液中加入反应物的物质的量,则相应的图象序号与(1)﹣(4)对应的是________
溶液
加入物质
对应的图象
⑴饱和石灰水
通过量CO2气体
⑵氯化铝溶液
加入过量氨水
⑶MgCl2、AlCl3的混合液
逐滴加入NaOH溶液至过量
⑷含少量NaOH的NaAlO2溶液
逐滴加入稀盐酸
19.往氯化亚铁溶液中滴加氢氧化钠溶液,现象是________
往氯化铁溶液中滴加氢氧化钠溶液,现象是________
往氯化铁溶液中滴加硫氰化钾溶液,现象是________
往氯化铝溶液中滴加氢氧化钠溶液至过量,现象是________.
20.为了检验糖尿病人的尿液中是否含有葡萄糖,并判断病情轻重,应选用下列试剂中的________
(填序号),进行的操作________(填序号)并根据病情的轻重(任选一种),在结论中用不同数目的“+”号表示.
试剂
操作步骤
发生现象
结论
①氢氧化铜
a.将尿液与试剂混合振荡
甲.蓝色溶液
乙.生成绿色沉淀
?
②斐林试剂
b.将尿液与试剂混合后加热至沸腾
丙.生成黄绿色沉淀
?
③硫酸铜
c.将尿液与试剂混合后微热
丁.生成黄色沉淀
?
戊.生成砖红色沉淀
?
三、实验探究题
21.随着时代的发展,绿色环保理念越来越受到大家的认同,变废为宝是我们每一位公民应该养成的意识。某同学尝试用废旧的铝制易拉罐作为原材料、采用“氢氧化铝法”制取明矾晶体并进行一系列的性质探究。
制取明矾晶体主要涉及到以下四个步骤:
第一步:铝制品的溶解。取一定量铝制品,置于250mL锥形瓶中,加入一定浓度和体积的强碱溶液,水浴加热(约93℃),待反应完全后(不再有氢气生成),趁热减压抽滤,收集滤液于250mL烧杯中;
第二步:氢氧化铝沉淀的生成。将滤液重新置于水浴锅中,用3
mol/L
H2SO4调节滤液pH至8~9,得到不溶性白色絮凝状Al(OH)3
,
减压抽滤得到沉淀;
第三步:硫酸铝溶液的生成。将沉淀转移至250mL烧杯中,边加热边滴入一定浓度和体积的H2SO4溶液;
第四步:硫酸铝钾溶液的形成。待沉淀全部溶解后加入一定量的固体K2SO4
,
将得到的饱和澄清溶液冷却降温直至晶体全部析出,减压抽滤、洗涤、抽干,获得产品明矾晶体[KAl(SO4)2·12H2O,M=474g/mol]。
回答下列问题:
(1)第一步铝的溶解过程中涉及到的主要反应的离子方程式为________
(2)为了加快铝制品的溶解,应该对铝制品进行怎样的预处理:________
(3)第四步操作中,为了保证产品的纯度,同时又减少产品的损失,应选择下列溶液中的___(填选项字母)进行洗涤,实验效果最佳。
A.乙醇
B.饱和K2SO4溶液
C.蒸馏水
D.1:1乙醇水溶液
(4)为了测定所得明矾晶体的纯度,进行如下实验操作:准确称取明矾晶体试样4.0g于烧杯中,加入50mL
1mol/L盐酸进行溶解,将上述溶液转移至100mL容量瓶中,稀释至刻度线,摇匀;移取25.00
mL溶液干250
mL锥形瓶中,加入30
mL
0.10mol/L
EDTA-2Na标准溶液,再滴加几滴2D二甲酚橙,此时溶液呈黄色;经过后续一系列操作,最终用0.20
mol/L锌标准溶液滴定至溶液由黄色变为紫红色,达到滴定终点时,共消耗5.00
mL锌标准溶液。滴定原理为H2Y2-+Al3+→AlY-+2H+
,
H2Y2-(过量)+Zn2+→ZnY2-+2H+(注:H2Y2-表示EDTA-2Na标准溶液离子)。则所得明矾晶体的纯度为________%。
(5)明矾除了可以用作人们熟悉的净水剂之外,还常用作部分食品的膨松剂,例如油条(饼)的制作过程需要加入一定量的明矾,请简述明矾在面食制作过程作膨松剂的原理:________
(6)为了探究明矾晶体的结晶水数目及分解产物,在N2气流中进行热分解实验,得到明矾晶体的热分解曲线如图所示(TG%代表的是分解后剩余固体质量占样品原始质量的百分率,失重百分率=
×100%):
根据TG曲线出现的平台及失重百分率,30~270℃范围内,失重率约为45.57%,680~810℃范围内,失重百分率约为25.31%,总失重率约为70.88%,请分别写出所涉及到30~270℃、680~810℃温度范围内这两个阶段的热分解方程式:________、________
22.如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答下列问题:
(1)仪器A的名称是________,烧瓶中反应的化学方程式是________。
(2)装置B中盛放液体是________,气体通过装置B的目的是________。
装置C中盛放的液体是________,气体通过装置C的目的是________。
(3)D中反应的化学方程式是________。
(4)烧杯E中盛放的液体是________,反应的化学方程式是________。
23.镁在空气中燃烧除生成MgO外,还可能生成Mg3N2。某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成。
(1)甲组同学取一定量燃烧后的固体投入水中,得到了一种能使湿润的红色石蕊试纸变蓝
的气体,该气体的化学式为________,说明固体中含有Mg3N2
,
生成该气体的化学反应方程式为________。
(2)乙组同学为测定Mg3N2含量,用图示装置进行实验,充分反应后再加热A。其中浓硫酸的作用是________,对A加热的目的是________。已知加入的固体质量为4.0g,最终C装置增重ag,则固体中含Mg3N2
________g(用含a的式子表示)。
(3)丙组有的同学认为乙组同学的测定结果偏高,理由是________。
有的同学认为乙组同学的测定结果偏低,理由是________。
丙组同学进行了改进,他们将乙组同学实验中得到的难溶固体进行过滤、洗涤、干燥,并灼烧固体至恒重,测得其质量为4.08g。上述过程中,洗涤沉淀的操作是________。
镁在空气中燃烧后生成的固体中Mg3N2的质量分数为________。
(4)有一种用铵盐与含镁矿石混合煅烧制取氧化镁的方法,解决了现有方法存在的原料成
本高、项目投资大、能耗高、副产品不好用等问题,其原理是将含镁矿石粉(含氧化镁)与
铵盐混合,经过煅烧、水溶、过滤,得到粗镁盐溶液,并回收煅烧产生的氨。写出用固体(NH4)2SO4与含镁矿石粉煅烧的化学反应方程式________。
参考答案
1
C
2
D
3
C
4
B
5
C
6
C
7
B
8
C
9
C
10
D
11
A
12
A
13
C
14
D
15
D
16在氯水中存在平衡:Cl2+H2O?HCl+HClO,HClO见光易分解为HCl和O2
,
使得平衡体系中HClO浓度减小,平衡向正反应方向移动,Cl2浓度减小.HCl浓度增大,最后浅绿色消失,溶液变成稀盐酸
17
含;Al(OH)3+3HCl=AlCl3+3H2O;AlCl3+3NaOH=
Al(OH)3↓+3NaCl;Al(OH)3+
NaOH=NaAlO2+2H2O
18
BCAD
19先白色沉淀,很快变成灰绿色,最终变成红褐色;生成红褐色沉淀;溶液变成血红色;先生成白色沉淀后沉淀溶解
20
②;c
21
(1)2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)用砂纸将废旧铝制易拉罐内外表面打磨光滑,并剪成小片备用(其他合理答案也给分)
(3)D
(4)94.8
(5)明矾与小苏打(NaHCO3)发生反应(双水解):Al3++3HCO3-=Al(OH)3↓+3CO2↑,产生大量CO2
,
使面食内部体积迅速膨胀,形成较大空隙。
(6)KAl(SO4)2?12H2O
KAl(SO4)2+12H2O;2KAl(SO4)2
K2SO4+Al2O3+3SO3↑
22
(1)分液漏斗;4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
(2)饱和NaCl溶液;吸收氯气中混有的杂质HCl;浓硫酸;吸收水蒸气,干燥氯气
(3)2Fe+3Cl2
2FeCl3
(4)NaOH溶液;2NaOH+Cl2=NaCl+NaClO+H2O
23
(1)NH3;Mg3N2
+
6H2O
=
3Mg(OH)2
+
2NH3↑
(2)吸收生成的NH3;将装置A中反应产生的NH3全部驱赶到装置C中;
(3)C装置的两侧无干燥装置,NH3中的水蒸气以及外部空气中的水蒸气都可能进入C装置而被浓硫酸吸收,造成结果偏高;可能有部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低;向过滤器中的沉淀上加蒸馏水至完全浸没沉淀,待水全部流出后,重复操作2~3次;10%
(4)(NH4)2SO4+MgO
MgSO4+2NH3↑+H2O
一、单选题
1.关于铝热反应,下列描述正确的是(???
)
A.?铝热剂可以是Fe和Al2O3?????????B.?可溶于氨水?????????C.?反应放出大量热?????????D.?属于非氧化还原反应
2.化学与生产、生活、社会密切相关,下列有关说法中正确的是(??
)
A.?二氧化硫有毒,严禁将其添加到任何食品和饮料中
B.?古有“青蒿一握,以水二升渍,绞取汁”,今用乙醚从黄花蒿中提取青蒿素是利用氧化还原反应原理
C.?面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,也属于离子化合物,其阴阳离子个数比为2∶1
D.?用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,但与氯气不同的是不产生有机氯对人体造成危害、
3.下列相关实验设计不能达到预期目的的是(
?)
选项
实验设计
预期目的
A
相同温度下,等质量的大理石块、大理石粉分别与等体积、等浓度的盐酸反应
探究接触面积对化学反应速率的影响
B
把装有颜色相同的NO2和N2O4混合气体的两支试管(密封)分别浸入冷水和热水中
探究温度对化学平衡的影响
C
用MgCl2和AlCl3分别与过量氨水反应
探究Mg、Al的金属性强弱
D
往盛有葡萄糖溶液的试管中滴入新制氢氧化铜悬浊液,加热
探究葡萄糖的化学性质
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
4.下列说法错误的是(
??)
A.?将氯气通入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色
B.?广范pH试纸测得某酸性溶液的pH为5.5
C.?用澄清石灰水鉴别CO和CO2
D.?金属钠着火时,可用细沙覆盖灭火
5.下列图像正确的是(???
)
A.?
B.?
C.?
D.?
6.下列离子方程式书写正确的是(
??)
A.?向(NH4)2Fe(SO4)2溶液中加入过量NaOH溶液:2NH
+Fe3++5OH-=2NH3·H2O+Fe(OH)3↓
B.?用稀氢碘酸除去铁制品表面的铁锈:Fe2O3+6H+=2Fe3++3H2O
C.?泡沫灭火器使用时发生的反应:Al3++3HCO
=Al(OH)3↓+3CO2↑
D.?向饱和碳酸钠溶液中通入过量的二氧化碳气体:CO
+CO2+
H2O=2HCO
7.下列有关金属性质的描述,符合事实的是(??
)
A.?金属钠暴露在空气中,表面变暗,生成白色的过氧化钠固体
B.?用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼白光,放出大量热,生成白色固体
C.?用坩埚钳夹住一小块铝箔,在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落
D.?金属铝比铁活泼,因此在空气中,铁制品比铝制品耐腐蚀
8.下列物质的转化在给定条件下能实现的是(
??)
A.?NaCl(ag)
?NaHCO3(s)
?Na2CO3(s)
B.?Si
SiO2
H2SiO3
C.?CuCl2
?
Cu(OH)2
Cu2O
D.?MgO(s)
Mg(NO3)2
(aq)
?Mg(s)
9.在含有Fe2+、Fe3+、Al3+、NH4+的溶液中加入足量的Na2O2固体,再加入过量的稀盐酸,完全反应后,离子数目几乎没有改变的是(?
)
A.?Fe2+??????????????????????????????????B.?Fe3+?????
??????????????????????????????????C.?Al3+??????????????????????????????????D.?NH4+
10.向明矾(KAl(SO4)2·12H2O)溶液中滴入Ba(OH)2溶液,当SO42-沉淀完全时,铝元素的存在形式是:(
??)
A.?Al(OH)3和Al3+???????????????????????????
B.?Al(OH)3和AlO2-
C.?全部为Al(OH)3?????????????????????????
?
D.?全部为AlO2-
11.下列关于Cl2的实验操作能达到实验目的的是(??
)
A.?用装置甲制取少量Cl2????????????????????B.?用装置乙除去Cl2中的HCl
C.?用装置丙收集Cl2???????????????????????D.?用装置丁吸收尾气
12.“84消毒液”可消杀新冠病毒,可用Cl2与NaOH溶液反应制备。下列关于“84消毒液”的说法错误的是(??
)
A.?属于胶体????????????????B.?有效成分为NaClO????????????????C.?室温下溶液pH大于7????????????????D.?有强氧化性
13.已知NH4++AlO2-+2H2O=Al(OH)3↓+NH3·H2O,向含有等物质的量的NH4+、Al3+、H+的混合溶液中,慢慢滴加NaOH溶液直至过量,并不断搅拌,发生以下离子反应:
①H++OH-=H2O
②Al(OH)3+OH-=AlO2-+2H2O
③Al3++3OH-=Al(OH)3↓
④NH4++OH-=NH3·H2O
先后顺序正确的是(??
)
A.?①→②→③→④?????????????B.?①→③→②→④?????????????C.?①→③→④→②?????????????D.?①→④→②→③
14.为了除去铁粉中的少量铝粉,可以选取的试剂是(???
)
A.?浓盐酸???????????????????????????B.?浓硝酸???????????????????????????C.?浓硫酸???????????????????????????D.?浓氢氧化钠溶液
15.既能与盐酸反应,又能与氢氧化钠溶液反应的是(???
)
A.?金属铁????????????????????????????????B.?金属铜????????????????????????????????C.?金属钠????????????????????????????????D.?金属铝
二、填空题
16.请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸:________.
17.某同学欲检验抗酸药中是否含有Al(OH)3
,
操作如下:取药剂3~4片研碎,向样品中加入过量的盐酸,过滤,得澄清溶液,向澄清溶液中滴加NaOH溶液,观察到有白色沉淀,继续加过量NaOH溶液,白色沉淀又溶解。你能得出该抗酸药中是否含有Al(OH)3?________(填含或不含),请写出有关反应的化学方程式:
①________
②________
③________
18.如图图象中,纵坐标为沉淀物的物质的量,横坐标为向溶液中加入反应物的物质的量,则相应的图象序号与(1)﹣(4)对应的是________
溶液
加入物质
对应的图象
⑴饱和石灰水
通过量CO2气体
⑵氯化铝溶液
加入过量氨水
⑶MgCl2、AlCl3的混合液
逐滴加入NaOH溶液至过量
⑷含少量NaOH的NaAlO2溶液
逐滴加入稀盐酸
19.往氯化亚铁溶液中滴加氢氧化钠溶液,现象是________
往氯化铁溶液中滴加氢氧化钠溶液,现象是________
往氯化铁溶液中滴加硫氰化钾溶液,现象是________
往氯化铝溶液中滴加氢氧化钠溶液至过量,现象是________.
20.为了检验糖尿病人的尿液中是否含有葡萄糖,并判断病情轻重,应选用下列试剂中的________
(填序号),进行的操作________(填序号)并根据病情的轻重(任选一种),在结论中用不同数目的“+”号表示.
试剂
操作步骤
发生现象
结论
①氢氧化铜
a.将尿液与试剂混合振荡
甲.蓝色溶液
乙.生成绿色沉淀
?
②斐林试剂
b.将尿液与试剂混合后加热至沸腾
丙.生成黄绿色沉淀
?
③硫酸铜
c.将尿液与试剂混合后微热
丁.生成黄色沉淀
?
戊.生成砖红色沉淀
?
三、实验探究题
21.随着时代的发展,绿色环保理念越来越受到大家的认同,变废为宝是我们每一位公民应该养成的意识。某同学尝试用废旧的铝制易拉罐作为原材料、采用“氢氧化铝法”制取明矾晶体并进行一系列的性质探究。
制取明矾晶体主要涉及到以下四个步骤:
第一步:铝制品的溶解。取一定量铝制品,置于250mL锥形瓶中,加入一定浓度和体积的强碱溶液,水浴加热(约93℃),待反应完全后(不再有氢气生成),趁热减压抽滤,收集滤液于250mL烧杯中;
第二步:氢氧化铝沉淀的生成。将滤液重新置于水浴锅中,用3
mol/L
H2SO4调节滤液pH至8~9,得到不溶性白色絮凝状Al(OH)3
,
减压抽滤得到沉淀;
第三步:硫酸铝溶液的生成。将沉淀转移至250mL烧杯中,边加热边滴入一定浓度和体积的H2SO4溶液;
第四步:硫酸铝钾溶液的形成。待沉淀全部溶解后加入一定量的固体K2SO4
,
将得到的饱和澄清溶液冷却降温直至晶体全部析出,减压抽滤、洗涤、抽干,获得产品明矾晶体[KAl(SO4)2·12H2O,M=474g/mol]。
回答下列问题:
(1)第一步铝的溶解过程中涉及到的主要反应的离子方程式为________
(2)为了加快铝制品的溶解,应该对铝制品进行怎样的预处理:________
(3)第四步操作中,为了保证产品的纯度,同时又减少产品的损失,应选择下列溶液中的___(填选项字母)进行洗涤,实验效果最佳。
A.乙醇
B.饱和K2SO4溶液
C.蒸馏水
D.1:1乙醇水溶液
(4)为了测定所得明矾晶体的纯度,进行如下实验操作:准确称取明矾晶体试样4.0g于烧杯中,加入50mL
1mol/L盐酸进行溶解,将上述溶液转移至100mL容量瓶中,稀释至刻度线,摇匀;移取25.00
mL溶液干250
mL锥形瓶中,加入30
mL
0.10mol/L
EDTA-2Na标准溶液,再滴加几滴2D二甲酚橙,此时溶液呈黄色;经过后续一系列操作,最终用0.20
mol/L锌标准溶液滴定至溶液由黄色变为紫红色,达到滴定终点时,共消耗5.00
mL锌标准溶液。滴定原理为H2Y2-+Al3+→AlY-+2H+
,
H2Y2-(过量)+Zn2+→ZnY2-+2H+(注:H2Y2-表示EDTA-2Na标准溶液离子)。则所得明矾晶体的纯度为________%。
(5)明矾除了可以用作人们熟悉的净水剂之外,还常用作部分食品的膨松剂,例如油条(饼)的制作过程需要加入一定量的明矾,请简述明矾在面食制作过程作膨松剂的原理:________
(6)为了探究明矾晶体的结晶水数目及分解产物,在N2气流中进行热分解实验,得到明矾晶体的热分解曲线如图所示(TG%代表的是分解后剩余固体质量占样品原始质量的百分率,失重百分率=
×100%):
根据TG曲线出现的平台及失重百分率,30~270℃范围内,失重率约为45.57%,680~810℃范围内,失重百分率约为25.31%,总失重率约为70.88%,请分别写出所涉及到30~270℃、680~810℃温度范围内这两个阶段的热分解方程式:________、________
22.如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答下列问题:
(1)仪器A的名称是________,烧瓶中反应的化学方程式是________。
(2)装置B中盛放液体是________,气体通过装置B的目的是________。
装置C中盛放的液体是________,气体通过装置C的目的是________。
(3)D中反应的化学方程式是________。
(4)烧杯E中盛放的液体是________,反应的化学方程式是________。
23.镁在空气中燃烧除生成MgO外,还可能生成Mg3N2。某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成。
(1)甲组同学取一定量燃烧后的固体投入水中,得到了一种能使湿润的红色石蕊试纸变蓝
的气体,该气体的化学式为________,说明固体中含有Mg3N2
,
生成该气体的化学反应方程式为________。
(2)乙组同学为测定Mg3N2含量,用图示装置进行实验,充分反应后再加热A。其中浓硫酸的作用是________,对A加热的目的是________。已知加入的固体质量为4.0g,最终C装置增重ag,则固体中含Mg3N2
________g(用含a的式子表示)。
(3)丙组有的同学认为乙组同学的测定结果偏高,理由是________。
有的同学认为乙组同学的测定结果偏低,理由是________。
丙组同学进行了改进,他们将乙组同学实验中得到的难溶固体进行过滤、洗涤、干燥,并灼烧固体至恒重,测得其质量为4.08g。上述过程中,洗涤沉淀的操作是________。
镁在空气中燃烧后生成的固体中Mg3N2的质量分数为________。
(4)有一种用铵盐与含镁矿石混合煅烧制取氧化镁的方法,解决了现有方法存在的原料成
本高、项目投资大、能耗高、副产品不好用等问题,其原理是将含镁矿石粉(含氧化镁)与
铵盐混合,经过煅烧、水溶、过滤,得到粗镁盐溶液,并回收煅烧产生的氨。写出用固体(NH4)2SO4与含镁矿石粉煅烧的化学反应方程式________。
参考答案
1
C
2
D
3
C
4
B
5
C
6
C
7
B
8
C
9
C
10
D
11
A
12
A
13
C
14
D
15
D
16在氯水中存在平衡:Cl2+H2O?HCl+HClO,HClO见光易分解为HCl和O2
,
使得平衡体系中HClO浓度减小,平衡向正反应方向移动,Cl2浓度减小.HCl浓度增大,最后浅绿色消失,溶液变成稀盐酸
17
含;Al(OH)3+3HCl=AlCl3+3H2O;AlCl3+3NaOH=
Al(OH)3↓+3NaCl;Al(OH)3+
NaOH=NaAlO2+2H2O
18
BCAD
19先白色沉淀,很快变成灰绿色,最终变成红褐色;生成红褐色沉淀;溶液变成血红色;先生成白色沉淀后沉淀溶解
20
②;c
21
(1)2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)用砂纸将废旧铝制易拉罐内外表面打磨光滑,并剪成小片备用(其他合理答案也给分)
(3)D
(4)94.8
(5)明矾与小苏打(NaHCO3)发生反应(双水解):Al3++3HCO3-=Al(OH)3↓+3CO2↑,产生大量CO2
,
使面食内部体积迅速膨胀,形成较大空隙。
(6)KAl(SO4)2?12H2O
KAl(SO4)2+12H2O;2KAl(SO4)2
K2SO4+Al2O3+3SO3↑
22
(1)分液漏斗;4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
(2)饱和NaCl溶液;吸收氯气中混有的杂质HCl;浓硫酸;吸收水蒸气,干燥氯气
(3)2Fe+3Cl2
2FeCl3
(4)NaOH溶液;2NaOH+Cl2=NaCl+NaClO+H2O
23
(1)NH3;Mg3N2
+
6H2O
=
3Mg(OH)2
+
2NH3↑
(2)吸收生成的NH3;将装置A中反应产生的NH3全部驱赶到装置C中;
(3)C装置的两侧无干燥装置,NH3中的水蒸气以及外部空气中的水蒸气都可能进入C装置而被浓硫酸吸收,造成结果偏高;可能有部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低;向过滤器中的沉淀上加蒸馏水至完全浸没沉淀,待水全部流出后,重复操作2~3次;10%
(4)(NH4)2SO4+MgO
MgSO4+2NH3↑+H2O
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
