6.1.1化学反应与热能(课件26张ppt)-2020_2021学年化学必修第二册课件精讲及好题精练(人教版2019) (1)
文档属性
| 名称 | 6.1.1化学反应与热能(课件26张ppt)-2020_2021学年化学必修第二册课件精讲及好题精练(人教版2019) (1) |  | |
| 格式 | pptx | ||
| 文件大小 | 51.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-01 10:41:57 | ||
图片预览







文档简介
第一课时 化学反应与热能
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到科学研究等)都离不开能量,而许多能量的利用与化学反应中的能量变化密切相关。从煤、石油和天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的
第一节 化学反应与能量变化
第六章 化学反应与能量
天然气的主要成分为甲烷(CH4),燃烧时产生蓝色火焰,产物主要是水及二氧化碳。
CH4+2O2 CO2+2H2O
化学反应中除了物质变化还伴随着
能量变化
能量变化:热能、光能、电能……
化学反应中两大变化
燃烧是放出热量的反应
“暖宝宝”中含有铁粉、活性炭、水、氯化钠等物质,遇空气发生反应的化学方程式:
4Fe+3O2+6H2O=4Fe(OH)3
该过程放热
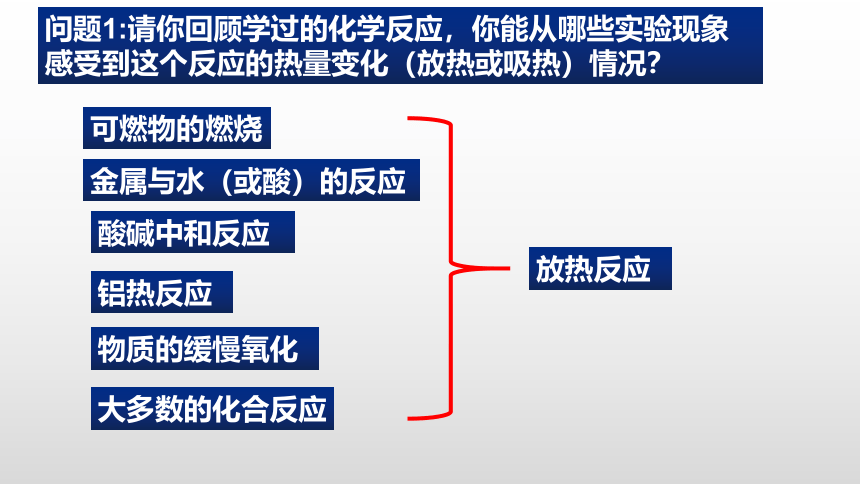
问题1:请你回顾学过的化学反应,你能从哪些实验现象感受到这个反应的热量变化(放热或吸热)情况?
金属与水(或酸)反应是一类放热反应
NaOH+HCI=NaCl+H2O
酸碱中和反应是放热反应
问题1:请你回顾学过的化学反应,你能从哪些实验现象感受到这个反应的热量变化(放热或吸热)情况?
铝热反应
实验现象:反应放出大量的热,并发出耀眼的光芒;纸漏斗的下部被烧穿,有熔融物落入沙中。
Fe2O3+2Al 2Fe+Al2O3
冶炼难溶的金属(物质变化)
利用放出的热,焊接钢轨等大截面钢材部件(能量变化)
酸碱中和反应
金属与水(或酸)的反应
可燃物的燃烧
大多数的化合反应
物质的缓慢氧化
铝热反应
放热反应
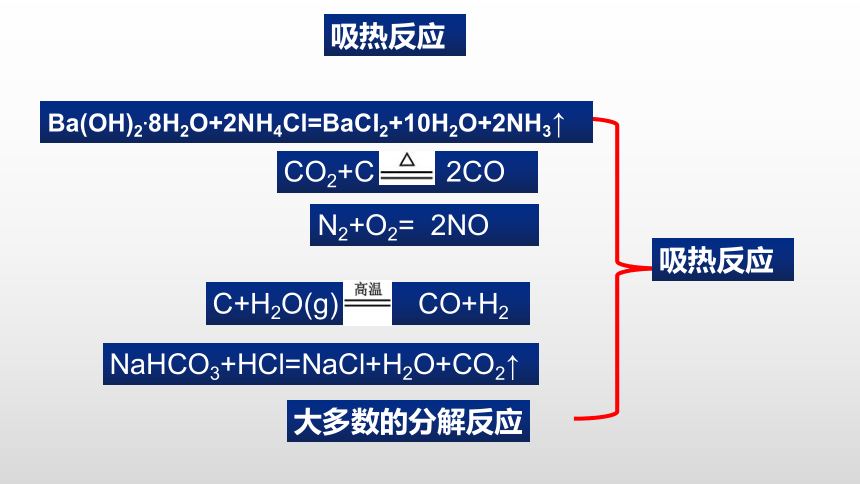
问题1:请你回顾学过的化学反应,你能从哪些实验现象感受到这个反应的热量变化(放热或吸热)情况?
Ba(OH)2.8H2O+2NH4Cl=BaCI2+10H2O+2NH3↑
吸热反应
大多数的分解反应
NaHCO3+HCl=NaCl+H2O+CO2↑
吸热反应
Ba(OH)2.8H2O+2NH4Cl=BaCI2+10H2O+2NH3↑
CO2+C 2CO
C+H2O(g) CO+H2
N2+O2= 2NO
吸热反应
【问题1】小结
酸碱中和反应
金属与水(或酸)的反应
可燃物的燃烧
大多数的化合反应
物质的缓慢氧化
铝热反应
放热
反应
Ba(OH)2.8H2O+2NH4Cl=
BaCI2+10H2O+2NH3↑
CO2+C 2CO
N2+O2= 2NO
C+H2O(g) CO+H2
NaHCO3+HCl=
NaCl+H2O+CO2↑
大多数的分解反应
吸热
反应
注意:大多数的吸热反应需要加热高温等条件;但也有常温的吸热反应和需要加热或高温的放热反应(例如铝热反应)
问题2:化学反应中为什么会有能量变化?能量变化的本质是什么?
100℃
液态水
气态水
H2O
2200℃
H2+O2
破坏分子间作用力
破坏化学键
物质中的原子(或离子)之间是通过化学键相结合的。当发生化学反应时,破坏旧化学键需要吸收能量,而形成新化学键需要释放能量。因此,在化学反应中,不仅有新物质生成,而且伴随着能量变化。
问题2:化学反应中为什么会有能量变化?
能量变化的本质是什么?
角度一:比较旧化学键断裂吸收与新化学键生成放出的能量(微观)
【算一算】请根据下列信息判断氢气和氯气化合生成氯化氢的反应是吸收能量还是放出能量?
1molH2
2molH
共价键断裂
吸收436kJ能量
1molCl2
2molCl
共价键断裂
吸收243kJ能量
共价键形成
释放862kJ能量
}
2molHCl
H2 + CI2 = 2HCI
183KJ
H—H + Cl—Cl → 2H—Cl
吸收的能量
(436+243)KJ
(431+431)KJ
释放的能量
<
放热反应
吸热反应
【算一算】请根据下列信息判断水蒸气分解生成氢气和氧气的反应是吸收能量还是放出能量?
2H2O = 2 H2 + O2
490KJ
4H—O → 2H—H + O=O
吸收的能量
4×465KJ
(2×436+498)KJ
释放的能量
>
吸热反应
放热反应
4molH
2molH2
1molH-H形成释放436KJ能量
2molO
1molO2
1molH-O键断裂吸收465kJ能量
}
2molH2O
1molO=O形成释放498KJ能量
问题2:化学反应中为什么会有能量变化?
能量变化的本质是什么?
角度一:比较旧化学键断裂吸收与新化学键生成放出的能量(微观)
问题2:化学反应中为什么会有能量变化?
能量变化的本质是什么?
角度一:比较旧化学键断裂吸收与新化学键生成放出的能量(微观)
角度二:(宏观)
问题2:化学反应中为什么会有能量变化?
能量变化的本质是什么?
化学反应中的两大变化
}
物质变化
能量变化
质量守恒
能量守恒
}
化学反应中的两大守恒
各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。放热反应可以看成是反应物所具有的化学能转化为热能释放出来,吸热反应可以看成是热能转化为化学能被生成物所“储存”。
问题2:化学反应中为什么会有能量变化?
能量变化的本质是什么?
角度二:比较反应物与生成物的总能能量(宏观)
你能否将这幅图变得更简单直观,能一目了然的看出一个化学反应是吸热也还是放热呢?
问题2:化学反应中为什么会有能量变化?
能量变化的本质是什么?
放热反应
吸热反应
问题2小结:化学反应中能量变化的原因和本质
角度一:比较旧化学键断裂吸收与新化学键生成放出的能量(微观)
角度二:比较反应物与生成物的总能能量(宏观)
能源的开发与综合利用
1.判断下列说法的正误,正确的在括号内划“√”,错误的在括号内划“×”。
(1)所有化学反应必然引起物质状态的变化( )
(2)不同的化学反应放出或吸收的能量一般是不相同的( )
(3)放出能量越多的反应,通常生成物越不稳定( )
(4)因为氢气在氧气中燃烧是放出能量的,所以水的分解反应一定是吸收能量的( )
解析:放出能量越多的反应,说明生成物的能量越低,生成物越稳定
答案
解析
×
√
×
√
达标检测
2.从如图所示的某气体反应的能量变化分析,以下判断正确的是( )
A.该反应为吸热反应
B.该反应需要加热
C.生成物的总能量低于反应物的总能量
D.反应物比生成物更稳定
C
达标检测
3.下列变化中属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A.①④ B.②④ C.③⑤ D.④⑥
答案
解析
解析 ①③⑥不是化学反应,②④是吸热反应,⑤是放热反应。
B
达标检测
4.下列说法正确的是( )
A.物质发生化学反应时都伴随着能量变化
B.伴有能量变化的物质变化都是化学变化
C.在一个确定的化学反应体系中,反应物的总能量与生成物的总能量一定相同
D.在一个确定的化学反应体系中,反应物的总能量总是高于生成物的总能量
答案
解析
A
物质发生化学反应时都伴随着能量变化,伴有能量变化的物质变化不一定是化学变化,如物质发生核变(如原子弹的爆炸)时也伴有能量变化。在一个确定的化学反应体系中,反应物的总能量(设为x)与生成物的总能量(设为y)之间的关系:①x>y,化学反应为放热反应;②x<y,化学反应为吸热反应。
达标检测
5.下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下一定很容易发生 ③反应是放出能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小 ④有的放热反应加热到一定温度引发后,停止加热反应也能继续进行
A.只有③④ B.只有①② C.①②③④ D.②③④
A
加热才能发生的反应不一定是吸热反应,如铜在氯气中燃烧;放热反应在常温下不一定容易发生,如N2与H2合成NH3;反应是放热还是吸热取决于反应物、生成物所具有的总能量的相对大小;需要加热才能发生的放热反应,如果反应放出的热量达到反应所需要的热量,停止加热反应也能继续进行,如Fe+S= FeS。
达标检测
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到科学研究等)都离不开能量,而许多能量的利用与化学反应中的能量变化密切相关。从煤、石油和天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的
第一节 化学反应与能量变化
第六章 化学反应与能量
天然气的主要成分为甲烷(CH4),燃烧时产生蓝色火焰,产物主要是水及二氧化碳。
CH4+2O2 CO2+2H2O
化学反应中除了物质变化还伴随着
能量变化
能量变化:热能、光能、电能……
化学反应中两大变化
燃烧是放出热量的反应
“暖宝宝”中含有铁粉、活性炭、水、氯化钠等物质,遇空气发生反应的化学方程式:
4Fe+3O2+6H2O=4Fe(OH)3
该过程放热
问题1:请你回顾学过的化学反应,你能从哪些实验现象感受到这个反应的热量变化(放热或吸热)情况?
金属与水(或酸)反应是一类放热反应
NaOH+HCI=NaCl+H2O
酸碱中和反应是放热反应
问题1:请你回顾学过的化学反应,你能从哪些实验现象感受到这个反应的热量变化(放热或吸热)情况?
铝热反应
实验现象:反应放出大量的热,并发出耀眼的光芒;纸漏斗的下部被烧穿,有熔融物落入沙中。
Fe2O3+2Al 2Fe+Al2O3
冶炼难溶的金属(物质变化)
利用放出的热,焊接钢轨等大截面钢材部件(能量变化)
酸碱中和反应
金属与水(或酸)的反应
可燃物的燃烧
大多数的化合反应
物质的缓慢氧化
铝热反应
放热反应
问题1:请你回顾学过的化学反应,你能从哪些实验现象感受到这个反应的热量变化(放热或吸热)情况?
Ba(OH)2.8H2O+2NH4Cl=BaCI2+10H2O+2NH3↑
吸热反应
大多数的分解反应
NaHCO3+HCl=NaCl+H2O+CO2↑
吸热反应
Ba(OH)2.8H2O+2NH4Cl=BaCI2+10H2O+2NH3↑
CO2+C 2CO
C+H2O(g) CO+H2
N2+O2= 2NO
吸热反应
【问题1】小结
酸碱中和反应
金属与水(或酸)的反应
可燃物的燃烧
大多数的化合反应
物质的缓慢氧化
铝热反应
放热
反应
Ba(OH)2.8H2O+2NH4Cl=
BaCI2+10H2O+2NH3↑
CO2+C 2CO
N2+O2= 2NO
C+H2O(g) CO+H2
NaHCO3+HCl=
NaCl+H2O+CO2↑
大多数的分解反应
吸热
反应
注意:大多数的吸热反应需要加热高温等条件;但也有常温的吸热反应和需要加热或高温的放热反应(例如铝热反应)
问题2:化学反应中为什么会有能量变化?能量变化的本质是什么?
100℃
液态水
气态水
H2O
2200℃
H2+O2
破坏分子间作用力
破坏化学键
物质中的原子(或离子)之间是通过化学键相结合的。当发生化学反应时,破坏旧化学键需要吸收能量,而形成新化学键需要释放能量。因此,在化学反应中,不仅有新物质生成,而且伴随着能量变化。
问题2:化学反应中为什么会有能量变化?
能量变化的本质是什么?
角度一:比较旧化学键断裂吸收与新化学键生成放出的能量(微观)
【算一算】请根据下列信息判断氢气和氯气化合生成氯化氢的反应是吸收能量还是放出能量?
1molH2
2molH
共价键断裂
吸收436kJ能量
1molCl2
2molCl
共价键断裂
吸收243kJ能量
共价键形成
释放862kJ能量
}
2molHCl
H2 + CI2 = 2HCI
183KJ
H—H + Cl—Cl → 2H—Cl
吸收的能量
(436+243)KJ
(431+431)KJ
释放的能量
<
放热反应
吸热反应
【算一算】请根据下列信息判断水蒸气分解生成氢气和氧气的反应是吸收能量还是放出能量?
2H2O = 2 H2 + O2
490KJ
4H—O → 2H—H + O=O
吸收的能量
4×465KJ
(2×436+498)KJ
释放的能量
>
吸热反应
放热反应
4molH
2molH2
1molH-H形成释放436KJ能量
2molO
1molO2
1molH-O键断裂吸收465kJ能量
}
2molH2O
1molO=O形成释放498KJ能量
问题2:化学反应中为什么会有能量变化?
能量变化的本质是什么?
角度一:比较旧化学键断裂吸收与新化学键生成放出的能量(微观)
问题2:化学反应中为什么会有能量变化?
能量变化的本质是什么?
角度一:比较旧化学键断裂吸收与新化学键生成放出的能量(微观)
角度二:(宏观)
问题2:化学反应中为什么会有能量变化?
能量变化的本质是什么?
化学反应中的两大变化
}
物质变化
能量变化
质量守恒
能量守恒
}
化学反应中的两大守恒
各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。放热反应可以看成是反应物所具有的化学能转化为热能释放出来,吸热反应可以看成是热能转化为化学能被生成物所“储存”。
问题2:化学反应中为什么会有能量变化?
能量变化的本质是什么?
角度二:比较反应物与生成物的总能能量(宏观)
你能否将这幅图变得更简单直观,能一目了然的看出一个化学反应是吸热也还是放热呢?
问题2:化学反应中为什么会有能量变化?
能量变化的本质是什么?
放热反应
吸热反应
问题2小结:化学反应中能量变化的原因和本质
角度一:比较旧化学键断裂吸收与新化学键生成放出的能量(微观)
角度二:比较反应物与生成物的总能能量(宏观)
能源的开发与综合利用
1.判断下列说法的正误,正确的在括号内划“√”,错误的在括号内划“×”。
(1)所有化学反应必然引起物质状态的变化( )
(2)不同的化学反应放出或吸收的能量一般是不相同的( )
(3)放出能量越多的反应,通常生成物越不稳定( )
(4)因为氢气在氧气中燃烧是放出能量的,所以水的分解反应一定是吸收能量的( )
解析:放出能量越多的反应,说明生成物的能量越低,生成物越稳定
答案
解析
×
√
×
√
达标检测
2.从如图所示的某气体反应的能量变化分析,以下判断正确的是( )
A.该反应为吸热反应
B.该反应需要加热
C.生成物的总能量低于反应物的总能量
D.反应物比生成物更稳定
C
达标检测
3.下列变化中属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A.①④ B.②④ C.③⑤ D.④⑥
答案
解析
解析 ①③⑥不是化学反应,②④是吸热反应,⑤是放热反应。
B
达标检测
4.下列说法正确的是( )
A.物质发生化学反应时都伴随着能量变化
B.伴有能量变化的物质变化都是化学变化
C.在一个确定的化学反应体系中,反应物的总能量与生成物的总能量一定相同
D.在一个确定的化学反应体系中,反应物的总能量总是高于生成物的总能量
答案
解析
A
物质发生化学反应时都伴随着能量变化,伴有能量变化的物质变化不一定是化学变化,如物质发生核变(如原子弹的爆炸)时也伴有能量变化。在一个确定的化学反应体系中,反应物的总能量(设为x)与生成物的总能量(设为y)之间的关系:①x>y,化学反应为放热反应;②x<y,化学反应为吸热反应。
达标检测
5.下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下一定很容易发生 ③反应是放出能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小 ④有的放热反应加热到一定温度引发后,停止加热反应也能继续进行
A.只有③④ B.只有①② C.①②③④ D.②③④
A
加热才能发生的反应不一定是吸热反应,如铜在氯气中燃烧;放热反应在常温下不一定容易发生,如N2与H2合成NH3;反应是放热还是吸热取决于反应物、生成物所具有的总能量的相对大小;需要加热才能发生的放热反应,如果反应放出的热量达到反应所需要的热量,停止加热反应也能继续进行,如Fe+S= FeS。
达标检测
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
