人教版九年级化学下册 9.3溶液的浓度 课后训练(word版,含答案)
文档属性
| 名称 | 人教版九年级化学下册 9.3溶液的浓度 课后训练(word版,含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 131.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-30 15:37:43 | ||
图片预览


文档简介
《溶液的浓度》课后训练
一、选择题
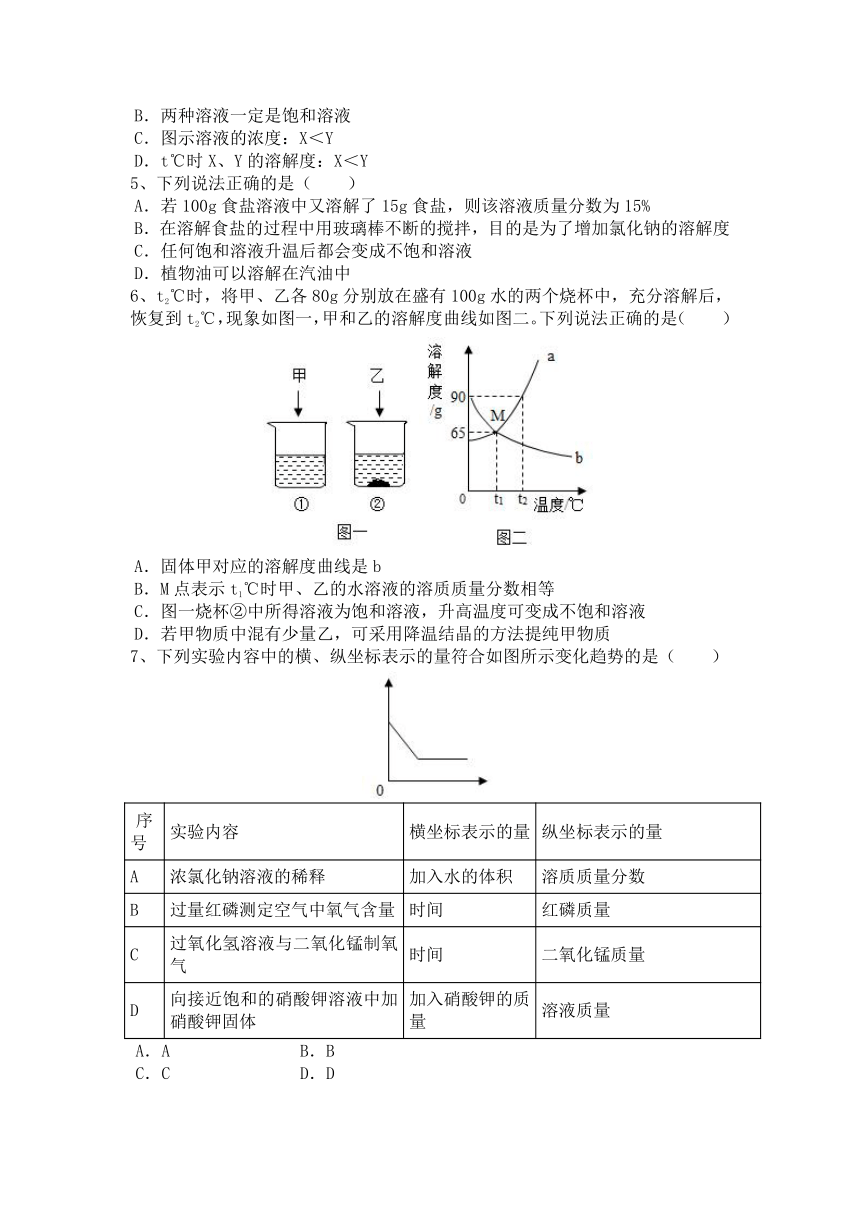
1、下列涉及学科观点的有关说法正确的是( )
A.根据微粒观:二氧化碳是由碳原子和氧原子构成的
B.根据转化观:一氧化碳和二氧化碳在一定条件下可相互转化
C.根据组成观:二氧化碳与一氧化碳组成元素相同,化学性质相同
D.根据守恒观:20mL质量分数40%的硫酸,加20mL水后质量分数变为20%
2、室温时,对100mL氯化钠饱和溶液作如下操作,最终甲、乙两烧杯中溶液( )
A.甲溶液的溶质质量分数大于乙溶液
B.甲溶液一定饱和,乙溶液可能饱和
C.甲溶液中氯化钠溶解度不变,乙溶液中氯化钠溶解度降低
D.两杯溶液中存在的微粒都只有钠离子和氯离子
3、20℃时,在各盛有100g水的烧杯中,分别加入10g甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是( )
A.20℃时,乙溶液的溶质质量最小
B.所得溶液可能都是饱和溶液
C.溶液溶质质量分数:甲>丙>乙
D.若升高温度,则甲、丙溶液的溶质质量分数一定变大
4、在t℃时,某物质X、Y分别完全溶于水,溶液中X、Y与水的质量关系分别如图a、图b所示。下列说法正确的是( )
A.X、Y都只能是固体
B.两种溶液一定是饱和溶液
C.图示溶液的浓度:X<Y
D.t℃时X、Y的溶解度:X<Y
5、下列说法正确的是( )
A.若100g食盐溶液中又溶解了15g食盐,则该溶液质量分数为15%
B.在溶解食盐的过程中用玻璃棒不断的搅拌,目的是为了增加氯化钠的溶解度
C.任何饱和溶液升温后都会变成不饱和溶液
D.植物油可以溶解在汽油中
6、t2℃时,将甲、乙各80g分别放在盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图一,甲和乙的溶解度曲线如图二。下列说法正确的是( )
A.固体甲对应的溶解度曲线是b
B.M点表示t1℃时甲、乙的水溶液的溶质质量分数相等
C.图一烧杯②中所得溶液为饱和溶液,升高温度可变成不饱和溶液
D.若甲物质中混有少量乙,可采用降温结晶的方法提纯甲物质
7、下列实验内容中的横、纵坐标表示的量符合如图所示变化趋势的是( )
序号
实验内容
横坐标表示的量
纵坐标表示的量
A
浓氯化钠溶液的稀释
加入水的体积
溶质质量分数
B
过量红磷测定空气中氧气含量
时间
红磷质量
C
过氧化氢溶液与二氧化锰制氧气
时间
二氧化锰质量
D
向接近饱和的硝酸钾溶液中加硝酸钾固体
加入硝酸钾的质量
溶液质量
A.A???????
B.B??????????????????
C.C?
?
?
?
?
D.D
8、运用图示法可以帮助我们巧学化学。下列化学知识用相应图示表示正确的是( )
9、如图所示的四个图像,能正确反映对应变化关系的是( )
10、参照下表(A物质的溶解性表)在常温20℃时进行如下实验,则下列说法正确的是( )
温度℃
20
50
溶解度(g/100g)水
30
110
A.①的质量分数为20%
B.质量分数的大小关系是④>③>②>①
C.②④为饱和溶液
D.④的质量分数为52.38%
?二、填空题:(共30分)
11、下表为两种物质在不同温度时的溶解度,请回答下列几个问题:
温度/℃
20
40
60
80
100
溶解度/g
氯化钾
34.0
40.0
45.6
51.5
56.7
硝酸钾
31.6
63.9
110
169
246
(1)40℃时,将30g氯化钾加入到50g水中,充分溶解后所得溶液质量为??????????????g。
(2)将20℃时硝酸钾和氯化钾的两种饱和溶液升温至60℃,则两种溶液的溶质质量分数大小关系是:硝酸钾??????????????氯化钾(填“>”、“<”或“=”)。
12、水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)“生命吸管”是一种可以随身携带的小型浄化器,里面装有网丝、注入了活性炭和碘的树脂。其中活性炭起到???????????和过滤的作用。
(2)衣服上沾有的油污,可用汽油洗去,是因为汽油能?
?
??(选填“溶解”或“乳化”)油污。
(3)喝了冰镇汽水以后,常常会打嗝。这种现象说明气体在温度越髙时,在等量水中溶解
得???(选填“多”“少”或“不变”)。
(4)水常用来配制各种溶液,硝酸钾溶液中的溶质为?????????。
(5)农业生产上常用溶质质量分数为10%?20%的氯化钠溶液来选种。现将300g25%的氯化钠溶液稀释为15%的氯化钠溶液,需要加水的质量为?????????????g。
13、下表是硝酸钾在不同温度时的溶解度。
温度/℃
0
20
40
60
80
溶解度/g
13.3
32
64
110
169
(1)硝酸钾的溶解度随温度升高而????????????????。
(2)要使接近饱和的硝酸钾溶液变为饱和溶液,可采用的一种方法是???????????????。
(3)60℃时,硝酸钾饱和溶液中溶质与溶剂的质量比是?????????????。
(4)将40℃硝酸钾饱和溶液降温至20℃,其溶质质量分数(填“变大”“变小”或“不变”)????????。
14、下表是?KNO3、NaCl在不同温度下的部分溶解度数据。
(1)以上两种物质溶解度的变化受温度影响较小的是???????
?。
(2)在40℃时,将40g
KNO3溶解在50g水中,形成溶液的质量是?
?
??g。若升温至60℃,形成的溶液为???????
?
?(填“饱和”或“不饱和”)溶液,该溶液的溶质质量分数为?
?
?
?
?
?。
(3)50℃时,饱和NaCl溶液中溶质的质量分数(w1)与饱和KNO3溶液中溶质的质量分数(w2)的大小关系是:w1????w2。(填“>”“=”或“<”)。
(4)根据表中数据,找出50.0g水能够溶解55.0g
KNO3的温度范围是?
?
?
??。
(5)固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为
加适量水溶解→加热得到热饱和溶液→???
?
?→过滤→洗涤→干燥→KNO3
(6)气体在水中的溶解度也有定的变化规律,如图为不同温度下,某气体的溶解度与温度的关系。
图中P1与P2表示气压,则P1与P2的关系是????。
A.P1>P2??????B.P1=P2
C.P1<P2??????D.无法确定
图中还可以看出温度对气体溶解度的影响为????????????。
参考答案
一、选择题(每题只有一个正确答案,每题1分,共10分)
1、B
2、A?3、B
4、C?5、D?6、D?
7、B?
8、A?
9、D?
10、B
二、填空题:(共30分)
11、解:(1)在40℃时,KCl的溶解度为40g;故50g水中最多可溶解20gKCl即饱和,故将30g KCl加入到50g水中,充分溶解后所得溶液是50+20=70g,故填:70;
(2)20℃时KNO3的溶解度小于KCl;KNO3和KCl的两种物质的溶解度随着温度的升高而增大,该溶液升温到60℃时,都转化为了不饱和溶液,溶质质量分数不变;故KNO3溶质质量分数要小于KCl,故填:<。
12、解:(1)活性炭起到吸附和过滤的作用,故填:吸附。
(2)衣服上沾有的油污,可用汽油洗去,是因为汽油能溶解油污,利用的是溶解原理,故填:溶解。
(3)喝了冰镇汽水以后,常常会打嗝,是由于胃内的温度高二氧化碳的溶解度变小而导致的,故填:少。
(4)水常用来配制各种溶液,硝酸钾溶液中的溶质为硝酸钾,故填:硝酸钾;
(5)设需要加水的质量为x
300g×25%=(300g+x)×15%
x=200g
故填:200;
13、解:(1)由表格中的数据可知,硝酸钾的溶解度随温度升高而增大;故填:增大;
(2)因为硝酸钾的溶解度随着温度的升高而增大,所以降低温度可使接近饱和的硝酸钾溶液变为饱和溶液;加入硝酸钾固体也可使接近饱和的硝酸钾溶液变为饱和溶液;蒸发水也使接近饱和的硝酸钾溶液变为饱和溶液;故填:加硝酸钾(合理答案均可);
(3)60℃时,硝酸钾的溶解度为110g,即在该温度下,100g水中溶解110g硝酸钾就达到饱和状态,此时硝酸钾饱和溶液中溶质与溶剂的质量比是110g:100g=11:10;故填:11:10;
(4)因为硝酸钾的溶解度随着温度的降低而减小,所以将40℃硝酸钾饱和溶液降温至20℃会有晶体析出,所以其溶质质量分数会变小;故填:变小。
14、答案:(1)氯化钠;
(2)82;不饱和;44.4%;
(3)<;
(4)等于或高于60℃;
(5)冷却热饱和溶液;
(6)P1<P2;温度越高,气体的溶解度越小。
一、选择题
1、下列涉及学科观点的有关说法正确的是( )
A.根据微粒观:二氧化碳是由碳原子和氧原子构成的
B.根据转化观:一氧化碳和二氧化碳在一定条件下可相互转化
C.根据组成观:二氧化碳与一氧化碳组成元素相同,化学性质相同
D.根据守恒观:20mL质量分数40%的硫酸,加20mL水后质量分数变为20%
2、室温时,对100mL氯化钠饱和溶液作如下操作,最终甲、乙两烧杯中溶液( )
A.甲溶液的溶质质量分数大于乙溶液
B.甲溶液一定饱和,乙溶液可能饱和
C.甲溶液中氯化钠溶解度不变,乙溶液中氯化钠溶解度降低
D.两杯溶液中存在的微粒都只有钠离子和氯离子
3、20℃时,在各盛有100g水的烧杯中,分别加入10g甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是( )
A.20℃时,乙溶液的溶质质量最小
B.所得溶液可能都是饱和溶液
C.溶液溶质质量分数:甲>丙>乙
D.若升高温度,则甲、丙溶液的溶质质量分数一定变大
4、在t℃时,某物质X、Y分别完全溶于水,溶液中X、Y与水的质量关系分别如图a、图b所示。下列说法正确的是( )
A.X、Y都只能是固体
B.两种溶液一定是饱和溶液
C.图示溶液的浓度:X<Y
D.t℃时X、Y的溶解度:X<Y
5、下列说法正确的是( )
A.若100g食盐溶液中又溶解了15g食盐,则该溶液质量分数为15%
B.在溶解食盐的过程中用玻璃棒不断的搅拌,目的是为了增加氯化钠的溶解度
C.任何饱和溶液升温后都会变成不饱和溶液
D.植物油可以溶解在汽油中
6、t2℃时,将甲、乙各80g分别放在盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图一,甲和乙的溶解度曲线如图二。下列说法正确的是( )
A.固体甲对应的溶解度曲线是b
B.M点表示t1℃时甲、乙的水溶液的溶质质量分数相等
C.图一烧杯②中所得溶液为饱和溶液,升高温度可变成不饱和溶液
D.若甲物质中混有少量乙,可采用降温结晶的方法提纯甲物质
7、下列实验内容中的横、纵坐标表示的量符合如图所示变化趋势的是( )
序号
实验内容
横坐标表示的量
纵坐标表示的量
A
浓氯化钠溶液的稀释
加入水的体积
溶质质量分数
B
过量红磷测定空气中氧气含量
时间
红磷质量
C
过氧化氢溶液与二氧化锰制氧气
时间
二氧化锰质量
D
向接近饱和的硝酸钾溶液中加硝酸钾固体
加入硝酸钾的质量
溶液质量
A.A???????
B.B??????????????????
C.C?
?
?
?
?
D.D
8、运用图示法可以帮助我们巧学化学。下列化学知识用相应图示表示正确的是( )
9、如图所示的四个图像,能正确反映对应变化关系的是( )
10、参照下表(A物质的溶解性表)在常温20℃时进行如下实验,则下列说法正确的是( )
温度℃
20
50
溶解度(g/100g)水
30
110
A.①的质量分数为20%
B.质量分数的大小关系是④>③>②>①
C.②④为饱和溶液
D.④的质量分数为52.38%
?二、填空题:(共30分)
11、下表为两种物质在不同温度时的溶解度,请回答下列几个问题:
温度/℃
20
40
60
80
100
溶解度/g
氯化钾
34.0
40.0
45.6
51.5
56.7
硝酸钾
31.6
63.9
110
169
246
(1)40℃时,将30g氯化钾加入到50g水中,充分溶解后所得溶液质量为??????????????g。
(2)将20℃时硝酸钾和氯化钾的两种饱和溶液升温至60℃,则两种溶液的溶质质量分数大小关系是:硝酸钾??????????????氯化钾(填“>”、“<”或“=”)。
12、水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)“生命吸管”是一种可以随身携带的小型浄化器,里面装有网丝、注入了活性炭和碘的树脂。其中活性炭起到???????????和过滤的作用。
(2)衣服上沾有的油污,可用汽油洗去,是因为汽油能?
?
??(选填“溶解”或“乳化”)油污。
(3)喝了冰镇汽水以后,常常会打嗝。这种现象说明气体在温度越髙时,在等量水中溶解
得???(选填“多”“少”或“不变”)。
(4)水常用来配制各种溶液,硝酸钾溶液中的溶质为?????????。
(5)农业生产上常用溶质质量分数为10%?20%的氯化钠溶液来选种。现将300g25%的氯化钠溶液稀释为15%的氯化钠溶液,需要加水的质量为?????????????g。
13、下表是硝酸钾在不同温度时的溶解度。
温度/℃
0
20
40
60
80
溶解度/g
13.3
32
64
110
169
(1)硝酸钾的溶解度随温度升高而????????????????。
(2)要使接近饱和的硝酸钾溶液变为饱和溶液,可采用的一种方法是???????????????。
(3)60℃时,硝酸钾饱和溶液中溶质与溶剂的质量比是?????????????。
(4)将40℃硝酸钾饱和溶液降温至20℃,其溶质质量分数(填“变大”“变小”或“不变”)????????。
14、下表是?KNO3、NaCl在不同温度下的部分溶解度数据。
(1)以上两种物质溶解度的变化受温度影响较小的是???????
?。
(2)在40℃时,将40g
KNO3溶解在50g水中,形成溶液的质量是?
?
??g。若升温至60℃,形成的溶液为???????
?
?(填“饱和”或“不饱和”)溶液,该溶液的溶质质量分数为?
?
?
?
?
?。
(3)50℃时,饱和NaCl溶液中溶质的质量分数(w1)与饱和KNO3溶液中溶质的质量分数(w2)的大小关系是:w1????w2。(填“>”“=”或“<”)。
(4)根据表中数据,找出50.0g水能够溶解55.0g
KNO3的温度范围是?
?
?
??。
(5)固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为
加适量水溶解→加热得到热饱和溶液→???
?
?→过滤→洗涤→干燥→KNO3
(6)气体在水中的溶解度也有定的变化规律,如图为不同温度下,某气体的溶解度与温度的关系。
图中P1与P2表示气压,则P1与P2的关系是????。
A.P1>P2??????B.P1=P2
C.P1<P2??????D.无法确定
图中还可以看出温度对气体溶解度的影响为????????????。
参考答案
一、选择题(每题只有一个正确答案,每题1分,共10分)
1、B
2、A?3、B
4、C?5、D?6、D?
7、B?
8、A?
9、D?
10、B
二、填空题:(共30分)
11、解:(1)在40℃时,KCl的溶解度为40g;故50g水中最多可溶解20gKCl即饱和,故将30g KCl加入到50g水中,充分溶解后所得溶液是50+20=70g,故填:70;
(2)20℃时KNO3的溶解度小于KCl;KNO3和KCl的两种物质的溶解度随着温度的升高而增大,该溶液升温到60℃时,都转化为了不饱和溶液,溶质质量分数不变;故KNO3溶质质量分数要小于KCl,故填:<。
12、解:(1)活性炭起到吸附和过滤的作用,故填:吸附。
(2)衣服上沾有的油污,可用汽油洗去,是因为汽油能溶解油污,利用的是溶解原理,故填:溶解。
(3)喝了冰镇汽水以后,常常会打嗝,是由于胃内的温度高二氧化碳的溶解度变小而导致的,故填:少。
(4)水常用来配制各种溶液,硝酸钾溶液中的溶质为硝酸钾,故填:硝酸钾;
(5)设需要加水的质量为x
300g×25%=(300g+x)×15%
x=200g
故填:200;
13、解:(1)由表格中的数据可知,硝酸钾的溶解度随温度升高而增大;故填:增大;
(2)因为硝酸钾的溶解度随着温度的升高而增大,所以降低温度可使接近饱和的硝酸钾溶液变为饱和溶液;加入硝酸钾固体也可使接近饱和的硝酸钾溶液变为饱和溶液;蒸发水也使接近饱和的硝酸钾溶液变为饱和溶液;故填:加硝酸钾(合理答案均可);
(3)60℃时,硝酸钾的溶解度为110g,即在该温度下,100g水中溶解110g硝酸钾就达到饱和状态,此时硝酸钾饱和溶液中溶质与溶剂的质量比是110g:100g=11:10;故填:11:10;
(4)因为硝酸钾的溶解度随着温度的降低而减小,所以将40℃硝酸钾饱和溶液降温至20℃会有晶体析出,所以其溶质质量分数会变小;故填:变小。
14、答案:(1)氯化钠;
(2)82;不饱和;44.4%;
(3)<;
(4)等于或高于60℃;
(5)冷却热饱和溶液;
(6)P1<P2;温度越高,气体的溶解度越小。
同课章节目录
