高中化学人教版(新课程标准)选修6实验化学第一单元从实验走进化学单元检测
文档属性
| 名称 | 高中化学人教版(新课程标准)选修6实验化学第一单元从实验走进化学单元检测 |
|
|
| 格式 | docx | ||
| 文件大小 | 243.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-02 00:00:00 | ||
图片预览



文档简介
高中化学人教版(新课程标准)选修6实验化学第一单元从实验走进化学单元检测
一、单选题
1.下列行为中,符合安全要求的是(??
)
A.?节日期间,在任意场所燃放烟花爆竹
B.?实验时,将水倒入浓硫酸中配制稀硫酸
C.?煤矿矿井,必须通风、严禁烟火
D.?将点燃的火柴放在液化气钢瓶口检验是否漏气
2.遇到下列情况,采用的措施有误的是(??
)
A.?将煤气中毒者转移到通风处抢救
B.?被玻璃割伤手后,先取出伤口里的碎玻璃片,再用稀双氧水擦洗,然后敷药包扎
C.?炒菜时油锅着火,立即盖上锅盖
D.?发现家中天然气泄漏,立即打开抽油烟机
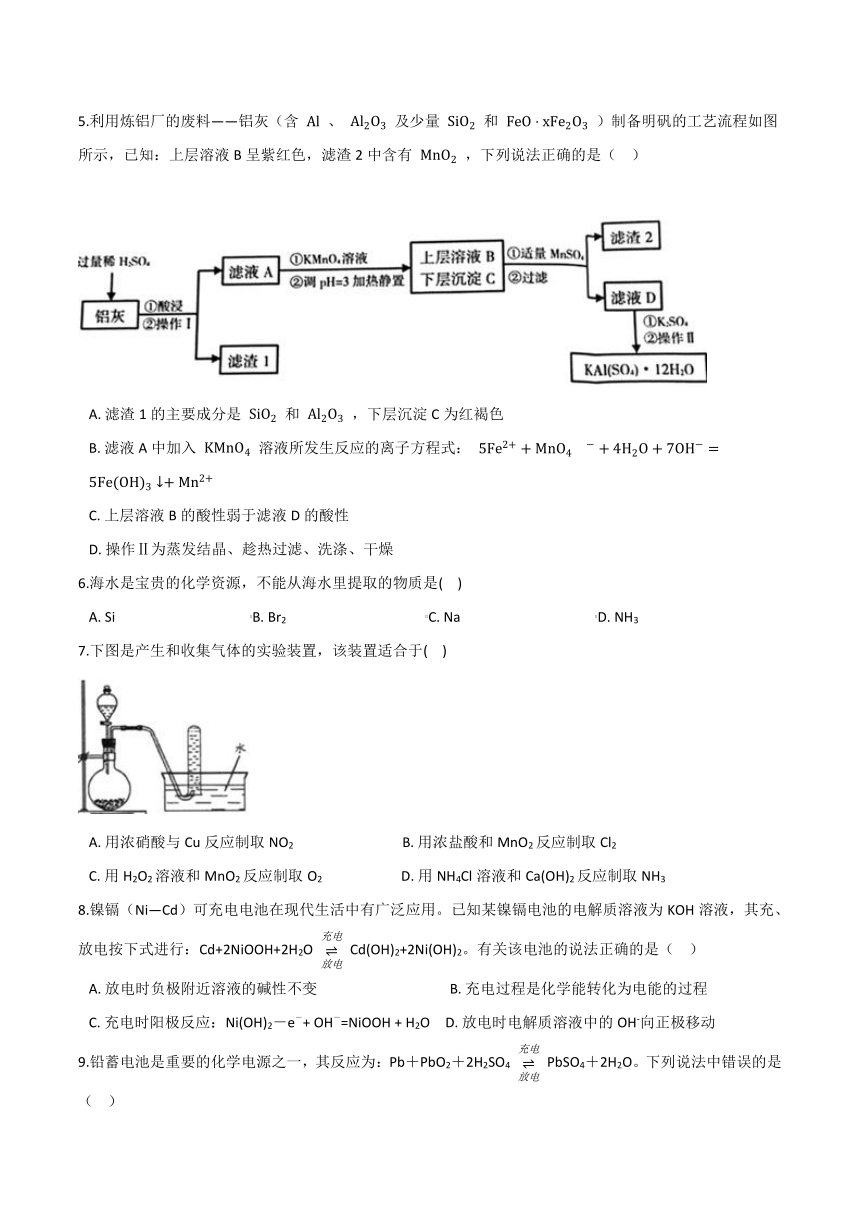
3.某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2
,
排尽装置内的空气。
已知:在溶液中FeSO4+NO
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法错误的是(??
)
A.?装置F、I中的试剂依次为水、硫酸亚铁溶液
B.?若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
C.?实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D.?装置J收集的气体中一定不含NO
4.蒸馏时须用到的仪器是(
??)
A.????????????????????????????B.????????????????????????????C.????????????????????????????D.?
5.利用炼铝厂的废料——铝灰(含
、
及少量
和
)制备明矾的工艺流程如图所示,已知:上层溶液B呈紫红色,滤渣2中含有
,下列说法正确的是(
??)
A.?滤渣1的主要成分是
和
,下层沉淀C为红褐色
B.?滤液A中加入
溶液所发生反应的离子方程式:
C.?上层溶液B的酸性弱于滤液D的酸性
D.?操作Ⅱ为蒸发结晶、趁热过滤、洗涤、干燥
6.海水是宝贵的化学资源,不能从海水里提取的物质是(??
)
A.?Si???????????????????????????????????????B.?Br2
???????????????????????????????????????C.?Na???????????????????????????????????????D.?NH3
7.下图是产生和收集气体的实验装置,该装置适合于(??
)
A.?用浓硝酸与Cu反应制取NO2???????????????????????????????B.?用浓盐酸和MnO2反应制取Cl2
C.?用H2O2溶液和MnO2反应制取O2???????????????????????D.?用NH4Cl溶液和Ca(OH)2反应制取NH3
8.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是(??
)
A.?放电时负极附近溶液的碱性不变
B.?充电过程是化学能转化为电能的过程
C.?充电时阳极反应:Ni(OH)2-e-+
OH-=NiOOH
+
H2O
D.?放电时电解质溶液中的OH-向正极移动
9.铅蓄电池是重要的化学电源之一,其反应为:Pb+PbO2+2H2SO4
PbSO4+2H2O。下列说法中错误的是(??
)
A.?充电时阴极为
PbSO4
变为
Pb,发生氧化反应
B.?充电时
Pb
与电源负极相连
C.?放电时正极增加
64
g,转移
2
mol
电子
D.?阳极电极反应为:PbSO4-2e-+2H2O=
PbO2+4H++SO42-
10.下列事实不能用电化学原理解释的是(
??)
A.?铝片不需要特殊的保护方法?????????????????????????????
???B.?炒过菜的铁锅未清洗易生锈
C.?轮船水线以下的船壳上镶有一定数量的锌???????????D.?生铁比熟铁(几乎是纯铁)容易生锈
11.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd
+
2NiOOH
+
2H2O
?Cd(OH)2
+
2Ni(OH)2。有关该电池的说法正确的是(??
)
A.?放电时电解质溶液中的OH-向正极移动
B.?充电过程是化学能转化为电能的过程
C.?放电时负极附近溶液的碱性不变
D.?充电时阳极反应:Ni(OH)2
-e-
+
OH-
=
NiOOH
+
H2O
12.有A,B,C,D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极
②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D
③A、C相连后,同时浸入稀H2SO4
,
C极产生大量气泡
④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为:(??
)
A.?A>B>C>D???????????????????????B.?A>C>D>B???????????????????????C.?C>A>B>D???????????????????????D.?B>D>C>A
13.海水是巨大的资源宝库。下图表示以海水为基本原料的相关工业,其中不符合实际情况的是(??
)
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
14.以下物质保存方法错误的是(??
)
A.?少量金属钠保存在煤油中????????????????????????????????????B.?少量白磷保存在水中
C.?浓硝酸保存在棕色试剂瓶中????????????????????????????????D.?氢氧化钠溶液保存在配有玻璃塞的细口瓶中
15.一定条件下,碳钢腐蚀与溶液pH的关系如下,下列说法错误的是(??
)
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO2-
A.?在pH>7溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
B.?在pH<4溶液中,碳钢主要发生析氢腐蚀
C.?在pH>6溶液中,碳钢主要发生吸氧腐蚀
D.?在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
二、填空题
16.材料是人类社会发展的物质基础,材料科学的发展离不开化学.
①黏土是陶瓷的生产原料,其中江苏宜兴的高岭土是含有杂质较少的高品质黏土,其主要组成可表示为Al2Si2Ox(OH)4
,
则x=________.
②2016年奥运会在巴西举行,场馆的建设需大量的建筑材料.其中生产水泥、玻璃共同的原料是________(填名称),场馆内的座椅通常用高密度聚乙烯(HDPE)为原料制得,聚乙烯属于________塑料(填“热固性”或“热塑性”).
③沪通铁路建设正在积极推进,其中如何防止铁轨的腐蚀是工程技术人员攻克的难题之一.铁在发生电化学腐蚀时的负极反应方程式为________.
④工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2
,
并于2000℃下拉成光纤细丝.该反应的化学方程式为________.
17.为了检验糖尿病人的尿液中是否含有葡萄糖,并判断病情轻重,应选用下列试剂中的________
(填序号),进行的操作________(填序号)并根据病情的轻重(任选一种),在结论中用不同数目的“+”号表示.
试剂
操作步骤
发生现象
结论
①氢氧化铜
a.将尿液与试剂混合振荡
甲.蓝色溶液
乙.生成绿色沉淀
?
②斐林试剂
b.将尿液与试剂混合后加热至沸腾
丙.生成黄绿色沉淀
?
③硫酸铜
c.将尿液与试剂混合后微热
丁.生成黄色沉淀
?
戊.生成砖红色沉淀
?
18.如图所示,水槽中试管内有一枚铁钉,放置数天观察:
①铁钉在逐渐生绣.
②若试管内液面上升,发生________腐蚀,正极:________.
③若试管内液面下降,则原溶液呈________性,正极:________.
19.如右图所示a、b、c、d分别是几种常见漏斗的上部,A,B,C,D是实际操作中各漏斗的下部插入容器中的示意图,请指出A,B,C,D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体.
①A与________组合,用于________,②B与________组合,用于________,
③B与________组合,用于________,④D与________组合,用于________.
20.海水中提取金属镁的生产步骤有:①浓缩结晶
②加熟石灰
③加盐酸
④过滤
⑤熔融电解,正确的生产步骤是________。
三、综合题
21.?(1)I.NaHSO3、CuSO4为实验室常用的化学试剂,均易溶于水,且水溶液显酸性。在铁片镀铜实验中,为提高电镀效果,常用CuSO4溶液作为电镀液。装置如图所示,a接电源________极,阳极的电极反应式为:________。电镀过程中c(Cu2+)________(填“基本不变”、“变大”或“变小”)。
II.某实验小组对NaHSO3溶液分别与CuSO4、CuCl2溶液的反应进行探究。
实验
装置
试剂x
操作及现象
A
1mol·L?1CuSO4溶液
加入2mLCuSO4溶液,得到绿色溶液,3分钟未见明显变化。
B
1mol·L?1CuCl2溶液
加入2mLCuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。
推测实验B产生的无色气体为SO2
,
实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到________,反应的离子方程式为________。
(2)对实验B产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与HSO
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是________;
②实验表明假设b合理,实验B反应的离子方程式有________、H++HSO
=SO2↑+H2O。
(3)对比实验A,B,提出假设:Cl-增强了Cu2+的氧化性。下述实验C证实了假设合理,装置如图(两个电极均为碳棒)。实验方案:闭合K
,
电压表的指针偏转至“X”处;向U形管________(补全实验操作及现象)。
(4)将实验A的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO
。已知:
I.
;
II.
III.Cu2O是一种红色粉末状固体,几乎不溶于水,但溶于氨水,形成稳定的、无色的配合物[Cu(NH3)2]+。
①通过实验D证实红色沉淀中含有Cu+和Cu2+。
实验D:
证实红色沉淀中含有Cu+的实验证据是________;
②有同学认为实验D不足以证实红色沉淀中含有Cu2+
,
设计实验D的对比实验E,证实了Cu2+的存在。实验E的方案和现象是________。(要求:用图示表示,参照实验D)
22.电化学原理被广泛地应用于生产、生活的许多方面。
(1)I.制备氯气
工业中用电解饱和食盐水的方法制备氯气,其原理如下图所示。
此过程中能量转化形式为________转化为________(填“化学能”或“电能”)
(2)电极乙为________(填“阴极”或“阳极”),A
口生成的气体是________
(3)电解饱和食盐水的离子方程式是
________
(4)下列有关氯气的说法中正确的是________
a.实验室常用排饱和食盐水法收集
b.可使碘化钾溶液变蓝
c.转化为
NaClO、ClO2
等含氯化合物可用于杀菌消毒
(5)II.金属防护
某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3Fe(CN)6溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如下。
被腐蚀的是包裹________的铁钉(填“锌片”或“铜片”)
(6)结合电极反应式解释
i
中现象产生的原因________
(7)结合以上实验,请对铁制零件的使用提出建议________
23.???????????????
(1)量取12.00mL溶液所用玻璃仪器的名称是________。
(2)按系统命名法命法,有机物
的名称是________。
(3)CaH2是离子化合物,写出CaH2的电子式________。。
(4)乙醇沸点高于二甲醚的主要原因是________。
参考答案
1
C
2
D
3
D
4
D
5
C
6
A
7
C
8
C
9
A
10
A
11
D
12
A
13
D
14
D
15
A
16
5;碳酸钙;热塑性;Fe﹣2e﹣=Fe2+;SiCl4+O2
SiO2+2Cl2
17
②;c
18吸氧;2H2O+O2+4e﹣=4OH﹣;酸;2H++2e﹣=H2↑
19
c;制取气体;b;分液;d;过滤;d;添加酒精
20
②④③①⑤
21
(1)负;Cu-2e-=Cu2+;基本不变;蓝色褪去;SO2+I2+2H2O=
+2I?+4H+
(2)实验A、B中c(Cu2+)相同,但实验A中未见气泡;2Cu2++2Cl?+
+H2O=2CuCl↓+
+3H+
(3)右侧加入一定量NaCl固体,溶解后,观察到电压表指针偏转变大
(4)一段时间后溶液由浅蓝色变为深蓝色;取少量纯净的Cu2O于试管中,滴加足量浓氨水,沉淀溶解,得到无色溶液,露置一段时间后溶液变为深蓝色或图示表示:
22
(1)电能;化学能
(2)阴极;Cl2
(3)2Cl-+2H2O
2OH-+H2↑+Cl2↑
(4)ac
(5)铜片
(6)锌为负极,发生电极反应Zn-2e-=Zn2+
,
铁为正极,发生电极反应O2+2H2O+4e-=4OH-
,
生成的氢氧根离子能使酚酞变红色,没有生成Fe2+
,
K3Fe(CN)6溶液不能变蓝
(7)在铁表面镀上一层比铁活泼的金属
23
(1)移液管(或滴定管)
(2)2,2,3-三甲基丁烷
(3)
(4)乙醇分子间存在氢键
一、单选题
1.下列行为中,符合安全要求的是(??
)
A.?节日期间,在任意场所燃放烟花爆竹
B.?实验时,将水倒入浓硫酸中配制稀硫酸
C.?煤矿矿井,必须通风、严禁烟火
D.?将点燃的火柴放在液化气钢瓶口检验是否漏气
2.遇到下列情况,采用的措施有误的是(??
)
A.?将煤气中毒者转移到通风处抢救
B.?被玻璃割伤手后,先取出伤口里的碎玻璃片,再用稀双氧水擦洗,然后敷药包扎
C.?炒菜时油锅着火,立即盖上锅盖
D.?发现家中天然气泄漏,立即打开抽油烟机
3.某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2
,
排尽装置内的空气。
已知:在溶液中FeSO4+NO
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法错误的是(??
)
A.?装置F、I中的试剂依次为水、硫酸亚铁溶液
B.?若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
C.?实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D.?装置J收集的气体中一定不含NO
4.蒸馏时须用到的仪器是(
??)
A.????????????????????????????B.????????????????????????????C.????????????????????????????D.?
5.利用炼铝厂的废料——铝灰(含
、
及少量
和
)制备明矾的工艺流程如图所示,已知:上层溶液B呈紫红色,滤渣2中含有
,下列说法正确的是(
??)
A.?滤渣1的主要成分是
和
,下层沉淀C为红褐色
B.?滤液A中加入
溶液所发生反应的离子方程式:
C.?上层溶液B的酸性弱于滤液D的酸性
D.?操作Ⅱ为蒸发结晶、趁热过滤、洗涤、干燥
6.海水是宝贵的化学资源,不能从海水里提取的物质是(??
)
A.?Si???????????????????????????????????????B.?Br2
???????????????????????????????????????C.?Na???????????????????????????????????????D.?NH3
7.下图是产生和收集气体的实验装置,该装置适合于(??
)
A.?用浓硝酸与Cu反应制取NO2???????????????????????????????B.?用浓盐酸和MnO2反应制取Cl2
C.?用H2O2溶液和MnO2反应制取O2???????????????????????D.?用NH4Cl溶液和Ca(OH)2反应制取NH3
8.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是(??
)
A.?放电时负极附近溶液的碱性不变
B.?充电过程是化学能转化为电能的过程
C.?充电时阳极反应:Ni(OH)2-e-+
OH-=NiOOH
+
H2O
D.?放电时电解质溶液中的OH-向正极移动
9.铅蓄电池是重要的化学电源之一,其反应为:Pb+PbO2+2H2SO4
PbSO4+2H2O。下列说法中错误的是(??
)
A.?充电时阴极为
PbSO4
变为
Pb,发生氧化反应
B.?充电时
Pb
与电源负极相连
C.?放电时正极增加
64
g,转移
2
mol
电子
D.?阳极电极反应为:PbSO4-2e-+2H2O=
PbO2+4H++SO42-
10.下列事实不能用电化学原理解释的是(
??)
A.?铝片不需要特殊的保护方法?????????????????????????????
???B.?炒过菜的铁锅未清洗易生锈
C.?轮船水线以下的船壳上镶有一定数量的锌???????????D.?生铁比熟铁(几乎是纯铁)容易生锈
11.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd
+
2NiOOH
+
2H2O
?Cd(OH)2
+
2Ni(OH)2。有关该电池的说法正确的是(??
)
A.?放电时电解质溶液中的OH-向正极移动
B.?充电过程是化学能转化为电能的过程
C.?放电时负极附近溶液的碱性不变
D.?充电时阳极反应:Ni(OH)2
-e-
+
OH-
=
NiOOH
+
H2O
12.有A,B,C,D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极
②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D
③A、C相连后,同时浸入稀H2SO4
,
C极产生大量气泡
④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为:(??
)
A.?A>B>C>D???????????????????????B.?A>C>D>B???????????????????????C.?C>A>B>D???????????????????????D.?B>D>C>A
13.海水是巨大的资源宝库。下图表示以海水为基本原料的相关工业,其中不符合实际情况的是(??
)
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
14.以下物质保存方法错误的是(??
)
A.?少量金属钠保存在煤油中????????????????????????????????????B.?少量白磷保存在水中
C.?浓硝酸保存在棕色试剂瓶中????????????????????????????????D.?氢氧化钠溶液保存在配有玻璃塞的细口瓶中
15.一定条件下,碳钢腐蚀与溶液pH的关系如下,下列说法错误的是(??
)
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO2-
A.?在pH>7溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
B.?在pH<4溶液中,碳钢主要发生析氢腐蚀
C.?在pH>6溶液中,碳钢主要发生吸氧腐蚀
D.?在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
二、填空题
16.材料是人类社会发展的物质基础,材料科学的发展离不开化学.
①黏土是陶瓷的生产原料,其中江苏宜兴的高岭土是含有杂质较少的高品质黏土,其主要组成可表示为Al2Si2Ox(OH)4
,
则x=________.
②2016年奥运会在巴西举行,场馆的建设需大量的建筑材料.其中生产水泥、玻璃共同的原料是________(填名称),场馆内的座椅通常用高密度聚乙烯(HDPE)为原料制得,聚乙烯属于________塑料(填“热固性”或“热塑性”).
③沪通铁路建设正在积极推进,其中如何防止铁轨的腐蚀是工程技术人员攻克的难题之一.铁在发生电化学腐蚀时的负极反应方程式为________.
④工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2
,
并于2000℃下拉成光纤细丝.该反应的化学方程式为________.
17.为了检验糖尿病人的尿液中是否含有葡萄糖,并判断病情轻重,应选用下列试剂中的________
(填序号),进行的操作________(填序号)并根据病情的轻重(任选一种),在结论中用不同数目的“+”号表示.
试剂
操作步骤
发生现象
结论
①氢氧化铜
a.将尿液与试剂混合振荡
甲.蓝色溶液
乙.生成绿色沉淀
?
②斐林试剂
b.将尿液与试剂混合后加热至沸腾
丙.生成黄绿色沉淀
?
③硫酸铜
c.将尿液与试剂混合后微热
丁.生成黄色沉淀
?
戊.生成砖红色沉淀
?
18.如图所示,水槽中试管内有一枚铁钉,放置数天观察:
①铁钉在逐渐生绣.
②若试管内液面上升,发生________腐蚀,正极:________.
③若试管内液面下降,则原溶液呈________性,正极:________.
19.如右图所示a、b、c、d分别是几种常见漏斗的上部,A,B,C,D是实际操作中各漏斗的下部插入容器中的示意图,请指出A,B,C,D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体.
①A与________组合,用于________,②B与________组合,用于________,
③B与________组合,用于________,④D与________组合,用于________.
20.海水中提取金属镁的生产步骤有:①浓缩结晶
②加熟石灰
③加盐酸
④过滤
⑤熔融电解,正确的生产步骤是________。
三、综合题
21.?(1)I.NaHSO3、CuSO4为实验室常用的化学试剂,均易溶于水,且水溶液显酸性。在铁片镀铜实验中,为提高电镀效果,常用CuSO4溶液作为电镀液。装置如图所示,a接电源________极,阳极的电极反应式为:________。电镀过程中c(Cu2+)________(填“基本不变”、“变大”或“变小”)。
II.某实验小组对NaHSO3溶液分别与CuSO4、CuCl2溶液的反应进行探究。
实验
装置
试剂x
操作及现象
A
1mol·L?1CuSO4溶液
加入2mLCuSO4溶液,得到绿色溶液,3分钟未见明显变化。
B
1mol·L?1CuCl2溶液
加入2mLCuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。
推测实验B产生的无色气体为SO2
,
实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到________,反应的离子方程式为________。
(2)对实验B产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与HSO
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是________;
②实验表明假设b合理,实验B反应的离子方程式有________、H++HSO
=SO2↑+H2O。
(3)对比实验A,B,提出假设:Cl-增强了Cu2+的氧化性。下述实验C证实了假设合理,装置如图(两个电极均为碳棒)。实验方案:闭合K
,
电压表的指针偏转至“X”处;向U形管________(补全实验操作及现象)。
(4)将实验A的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO
。已知:
I.
;
II.
III.Cu2O是一种红色粉末状固体,几乎不溶于水,但溶于氨水,形成稳定的、无色的配合物[Cu(NH3)2]+。
①通过实验D证实红色沉淀中含有Cu+和Cu2+。
实验D:
证实红色沉淀中含有Cu+的实验证据是________;
②有同学认为实验D不足以证实红色沉淀中含有Cu2+
,
设计实验D的对比实验E,证实了Cu2+的存在。实验E的方案和现象是________。(要求:用图示表示,参照实验D)
22.电化学原理被广泛地应用于生产、生活的许多方面。
(1)I.制备氯气
工业中用电解饱和食盐水的方法制备氯气,其原理如下图所示。
此过程中能量转化形式为________转化为________(填“化学能”或“电能”)
(2)电极乙为________(填“阴极”或“阳极”),A
口生成的气体是________
(3)电解饱和食盐水的离子方程式是
________
(4)下列有关氯气的说法中正确的是________
a.实验室常用排饱和食盐水法收集
b.可使碘化钾溶液变蓝
c.转化为
NaClO、ClO2
等含氯化合物可用于杀菌消毒
(5)II.金属防护
某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3Fe(CN)6溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如下。
被腐蚀的是包裹________的铁钉(填“锌片”或“铜片”)
(6)结合电极反应式解释
i
中现象产生的原因________
(7)结合以上实验,请对铁制零件的使用提出建议________
23.???????????????
(1)量取12.00mL溶液所用玻璃仪器的名称是________。
(2)按系统命名法命法,有机物
的名称是________。
(3)CaH2是离子化合物,写出CaH2的电子式________。。
(4)乙醇沸点高于二甲醚的主要原因是________。
参考答案
1
C
2
D
3
D
4
D
5
C
6
A
7
C
8
C
9
A
10
A
11
D
12
A
13
D
14
D
15
A
16
5;碳酸钙;热塑性;Fe﹣2e﹣=Fe2+;SiCl4+O2
SiO2+2Cl2
17
②;c
18吸氧;2H2O+O2+4e﹣=4OH﹣;酸;2H++2e﹣=H2↑
19
c;制取气体;b;分液;d;过滤;d;添加酒精
20
②④③①⑤
21
(1)负;Cu-2e-=Cu2+;基本不变;蓝色褪去;SO2+I2+2H2O=
+2I?+4H+
(2)实验A、B中c(Cu2+)相同,但实验A中未见气泡;2Cu2++2Cl?+
+H2O=2CuCl↓+
+3H+
(3)右侧加入一定量NaCl固体,溶解后,观察到电压表指针偏转变大
(4)一段时间后溶液由浅蓝色变为深蓝色;取少量纯净的Cu2O于试管中,滴加足量浓氨水,沉淀溶解,得到无色溶液,露置一段时间后溶液变为深蓝色或图示表示:
22
(1)电能;化学能
(2)阴极;Cl2
(3)2Cl-+2H2O
2OH-+H2↑+Cl2↑
(4)ac
(5)铜片
(6)锌为负极,发生电极反应Zn-2e-=Zn2+
,
铁为正极,发生电极反应O2+2H2O+4e-=4OH-
,
生成的氢氧根离子能使酚酞变红色,没有生成Fe2+
,
K3Fe(CN)6溶液不能变蓝
(7)在铁表面镀上一层比铁活泼的金属
23
(1)移液管(或滴定管)
(2)2,2,3-三甲基丁烷
(3)
(4)乙醇分子间存在氢键
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
