苏教版(2019)必修第二册高中化学专题7氨与社会可持续发展第二单元重要的含氮化工原料同步练习
文档属性
| 名称 | 苏教版(2019)必修第二册高中化学专题7氨与社会可持续发展第二单元重要的含氮化工原料同步练习 |  | |
| 格式 | docx | ||
| 文件大小 | 502.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-03 07:48:17 | ||
图片预览



文档简介
苏教版(2019)必修第二册高中化学专题7氨与社会可持续发展第二单元重要的含氮化工原料同步练习
一、单选题
1.下列离子方程式书写正确的是(
)
A.氢氧化铁与盐酸反应:
B.铜与稀硝酸反应:
C.钠与水反应:
D.碳酸氢钠与盐酸反应:
2.下列与相关实验的说法错误的是(
)
A.甲图制备可选用的药品为与的混合物
B.乙图实验时,可观察到烧瓶中液体为红色,体现是碱性气体
C.丙图实验中,可观察到有大量白烟生成,体现的还原性
D.丁图可用于的尾气处理,且具有防倒吸作用
3.下列物质中,能使石蕊试液最终变红的是(
)
A.
SO2
B.Na2O2
C.Cl2
D.NH3
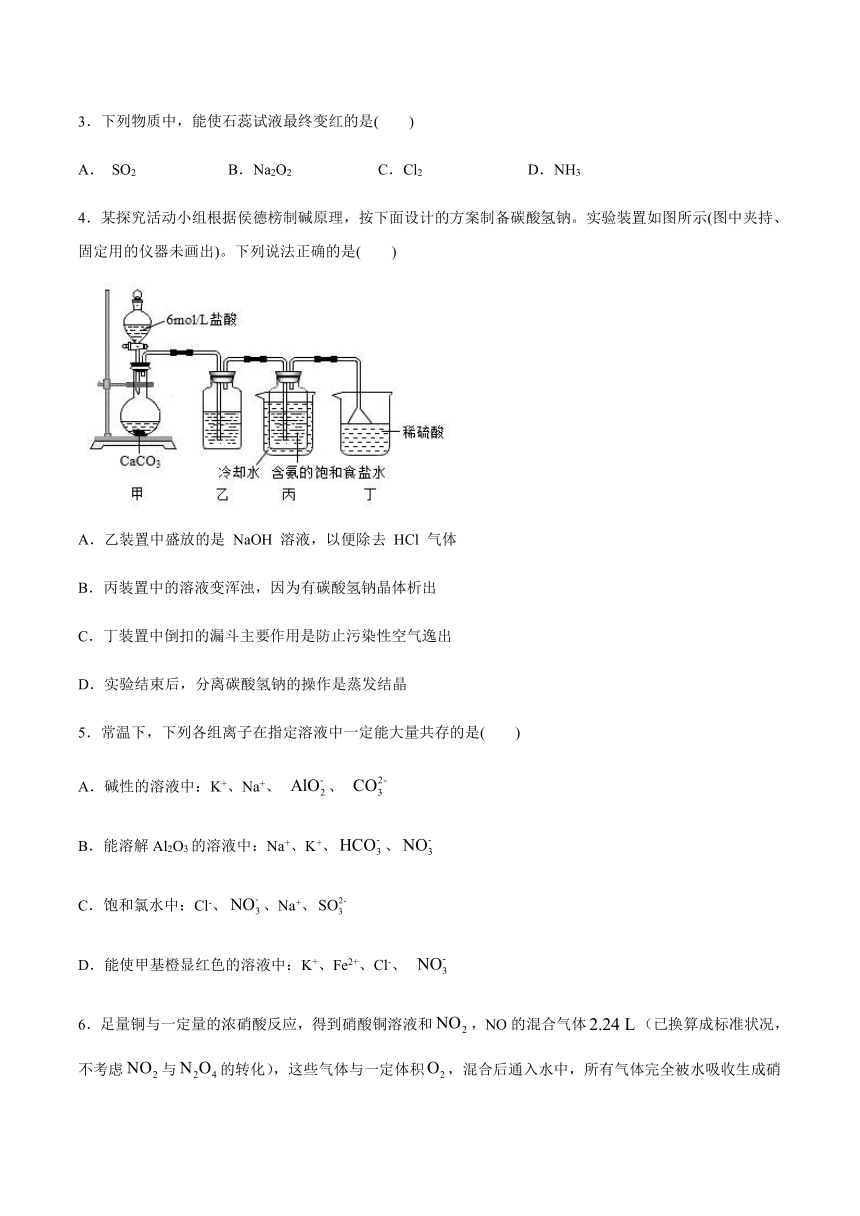
4.某探究活动小组根据侯德榜制碱原理,按下面设计的方案制备碳酸氢钠。实验装置如图所示(图中夹持、固定用的仪器未画出)。下列说法正确的是(
)
A.乙装置中盛放的是
NaOH
溶液,以便除去
HCl
气体
B.丙装置中的溶液变浑浊,因为有碳酸氢钠晶体析出
C.丁装置中倒扣的漏斗主要作用是防止污染性空气逸出
D.实验结束后,分离碳酸氢钠的操作是蒸发结晶
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.碱性的溶液中:K+、Na+、
、
B.能溶解Al2O3的溶液中:Na+、K+、、
C.饱和氯水中:Cl-、、Na+、
D.能使甲基橙显红色的溶液中:K+、Fe2+、Cl-、
6.足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和,NO的混合气体(已换算成标准状况,不考虑与的转化),这些气体与一定体积,混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入溶液。则恰好完全沉淀:下列说法正确的是
A.此反应过程中转移的电子为
B.混合气体中含(标准状况)
C.参加反应的是
D.消耗氧气的体积为(标准状况)
7.下列反应中,硝酸既表现出氧化性又表现出酸性的是
A.稀与FeO反应
B.稀与HI反应
C.稀与反应
D.浓受热分解
8.稀HNO3的还原产物可以是①NO、②N2O、③N2、④NH4NO3。在稀HNO3和Zn的反应中,若有1
mol
HNO3参加反应,则有0.8
mol电子转移,由此推断稀HNO3的还原产物可能为(
)
A.仅④
B.②或④
C.③或④
D.仅②
9.向某HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如下图所示,则原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为( )
A.4∶1
B.3∶1
C.2∶1
D.1∶1
10.已知X、Y、Z、W(含同一种元素)之间的转化关系为,且X能与W发生反应生成一种易溶于水的盐,则X可能是(
)
A.
B.
C.
D.NO
11.关于氨的下列叙述中,正确的是(
)
A.氨因为有刺激性气味,因此不用来作制冷剂
B.氨具有还原性,可以被氧化为NO
C.氨极易溶于水,因此氨水比较稳定(不容易分解)
D.氨溶于水显弱碱性,因此可使石蕊试液变为红色
12.设NA为阿伏加德罗常数的值,则下列说法正确的是(
)
A.标准状况下,1molSO3的体积为22.4L
B.1molCu与足量的S充分反应,转移的电子数为2NA
C.0.2molCu与含0.4molH2SO4的浓硫酸在加热的条件下反应时,生成的SO2在标准状况下的体积为4.48L
D.0.5molCu与足量浓HNO3反应时,转移的电子数为NA
13.将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是
A.大理石和稀盐酸
B.NaOH和NH4Cl
C.Cu和浓硝酸
D.MnO2和浓盐酸
14.我国清代《本草纲目拾遗》中记载无机药物
335
种,其中“强水”条目下写道:“性最烈,
能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是
A.氨水
B.硝酸
C.酒精
D.烧碱
15.工厂排放的烟气对环境造成污染,某企业用如图流程综合处理,下列有关说法正确的是
A.二氧化硫吸收塔中发生的反应为
B.氨气吸收塔中发生的反应为
C.上述流程利用的是氧化还原反应原理
D.上述流程可缓解温室效应
16.7.5g镁铝合金完全溶解于100mL密度为1.40g/mL、质量分数为63%的浓硝酸中得到NO2和NO的混合气体11.2L(标准状况),向反应后的溶液中加入3.0mol/LNaOH溶液,当金属离子恰好完全沉淀时,得到19.4g沉淀,下列说法不正确的是
A.该合金中铝与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C.NO2和NO的混合气体中,NO的体积分数是20%
D.得到19.4g沉淀时,加入NaOH溶液的体积是300mL
17.已知
1L
水中溶解了
700L
氨气(S.T.P),所得溶液密度为
0.883g/cm3.下列说法正确的是( )
A.溶液中
NH3
的物质的量浓度为
31.25mol/L
B.溶液中
OH﹣的物质的量浓度为
18.02mol/L
C.向所得溶液中再加入
1L
水,NH3
的物质的量浓度为
9.01mol/L
D.取原溶液
10mL,其中
NH3
的质量分数为
34.69%
二、填空题
18.(1)写出除去或分离括号内物质所用方法(填序号):
a.加热法b.过滤c.渗析d.水洗法e.升华法f.萃取和分液g.沉淀法
①碳酸钠(碳酸氢钠)_____;
②一氧化氮(二氧化氮)_____;
③氯化钠(I2)_____;
④氢氧化铁胶体中的离子_____;
⑤碘水中碘单质_____;
⑥氯化钠(硫酸钠)_____。
(2)①写出实验室中由固体物质制取氨气的化学方程式_____。
②欲用上述方法制取并收集一瓶干燥的氨气,从图中选择合适的装置,其连接顺序为_____。(按气流方向,用小写字母表示,如x→y→z)。
19.将下列性质的选项,填入各小题后面对应的括号中:A.脱水性;B.强酸性;C.二元酸;D.氧化性;E.吸水性
(1)将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。(________)
(2)NaOH与H2SO4反应,可生成Na2SO4和NaHSO4这两种盐。(________)
(3)在冷浓HNO3中放入铝片没明显现象。(________)
(4)浓H2SO4敞口久置会增重。(________)
(5)用稀硫酸清洗金属表面的氧化物(________)
(6)在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。(________)
(7)在稀HNO3中放入铜片产生NO。(________)
20.下列反应或者现象主要体现了硝酸的什么性质?久置浓硝酸显黄色________(填序号,下同),用稀硝酸清洗试管壁上的银________,稀硝酸清洗石灰水试剂瓶壁上的固体________,用浓硝酸清洗积碳的试管________。
①(强)氧化性???
②酸性?
③还原性?
④不稳定性?
⑤挥发性??
⑥脱水性?
⑦吸水性
三、工业流程题
21.氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:
(1)合成塔中发生反应的化学方程式为_______。
(2)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨_______的性质。
(3)氧化炉中,NH3转化为NO的化学方程式为_______。标准状况下,5.6LNH3被氧化为NO时转移电子的物质的量为_______。
(4)吸收塔中出来的尾气可用Na2CO3溶液吸收,主要反应为:
a.
b.
①吸收后的溶液经浓缩、结晶、过滤,得到晶体。该晶体中的主要杂质是_______(填化学式);吸收后排放的尾气中含量较高的氮氧化物是_______(填化学式)。
②根据反应b,每产生22.4L(标准状况下)吸收液质量将增加_______g。
(5)以合成氨为基础的化肥工业对粮食增长的贡献率占50%左右,但人类如果过度施用化肥,对环境造成影响是_______(任答1点);为了维持自然界中氮的平衡,除了合理施用化肥外,人类还可以采取措施是_______(任答1点)。
四、实验题
22.I.研究性学习小组进行SO2的制备及性质探究实验,装置如图(a为活塞,加热及固定装置已略去)。
(1)连接仪器、检查装置气密性,检验上述装置气密性的操作是_______,然后加药品,打开a,然后滴入浓硫酸,加热。
(2)铜与浓硫酸反应制备SO2的化学方程式是_______。
(3)探究SO2与品红作用的可逆性,请写出实验操作及现象_______。
(4)SO2通入KMnO4溶液中,现象是_______说明SO2具有_______性。
Ⅱ.硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而变化,总体上说,浓硝酸的还原产物主要为NO2、稀硝酸的还原产物为NO。回答下列问题:64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况),反应中消耗的HNO3的物质的量是_______,产生的气体是_______,其物质的量之比是_______。
参考答案
1.D2.C3.A4.B5.A6.B7.A8.B9.A10.C11.B12.D13.A14.B15.A16.A17.D
18.a
d
e
c
f
g
2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
a→d→c→f→e→i
19.E
C
D
E
B
A、D
B、D
20.④
①②
②
①
21.N2+3H22NH3
易液化
4NH3+5O24NO+6H2O
1.25mol
NaNO3
NO
32
水体富营养化(或土壤酸化板结、赤潮、酸雨光化学烟雾、臭氧层空洞等合理答案)
氨氮废水处理后排放(或工业污水处理后排放、养殖业污水处理后排放、出行多使用公共交通用具,减少私家车使用或植树造林等其他合理答案)
22.关闭分液漏斗活塞,向最后一支试管中加水至没过导管口微热圆底烧瓶,导管口有气泡冒出,停止加热后,回升一段水柱,则装置气密性良好
Cu+2H2SO4(浓)CuSO4+
SO2↑+2H2O
把褪色后的品红溶液加热,溶液恢复红色
溶液红色褪去(或变浅)
还原性
3.0mol
NO2和NO
1∶1
一、单选题
1.下列离子方程式书写正确的是(
)
A.氢氧化铁与盐酸反应:
B.铜与稀硝酸反应:
C.钠与水反应:
D.碳酸氢钠与盐酸反应:
2.下列与相关实验的说法错误的是(
)
A.甲图制备可选用的药品为与的混合物
B.乙图实验时,可观察到烧瓶中液体为红色,体现是碱性气体
C.丙图实验中,可观察到有大量白烟生成,体现的还原性
D.丁图可用于的尾气处理,且具有防倒吸作用
3.下列物质中,能使石蕊试液最终变红的是(
)
A.
SO2
B.Na2O2
C.Cl2
D.NH3
4.某探究活动小组根据侯德榜制碱原理,按下面设计的方案制备碳酸氢钠。实验装置如图所示(图中夹持、固定用的仪器未画出)。下列说法正确的是(
)
A.乙装置中盛放的是
NaOH
溶液,以便除去
HCl
气体
B.丙装置中的溶液变浑浊,因为有碳酸氢钠晶体析出
C.丁装置中倒扣的漏斗主要作用是防止污染性空气逸出
D.实验结束后,分离碳酸氢钠的操作是蒸发结晶
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.碱性的溶液中:K+、Na+、
、
B.能溶解Al2O3的溶液中:Na+、K+、、
C.饱和氯水中:Cl-、、Na+、
D.能使甲基橙显红色的溶液中:K+、Fe2+、Cl-、
6.足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和,NO的混合气体(已换算成标准状况,不考虑与的转化),这些气体与一定体积,混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入溶液。则恰好完全沉淀:下列说法正确的是
A.此反应过程中转移的电子为
B.混合气体中含(标准状况)
C.参加反应的是
D.消耗氧气的体积为(标准状况)
7.下列反应中,硝酸既表现出氧化性又表现出酸性的是
A.稀与FeO反应
B.稀与HI反应
C.稀与反应
D.浓受热分解
8.稀HNO3的还原产物可以是①NO、②N2O、③N2、④NH4NO3。在稀HNO3和Zn的反应中,若有1
mol
HNO3参加反应,则有0.8
mol电子转移,由此推断稀HNO3的还原产物可能为(
)
A.仅④
B.②或④
C.③或④
D.仅②
9.向某HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如下图所示,则原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为( )
A.4∶1
B.3∶1
C.2∶1
D.1∶1
10.已知X、Y、Z、W(含同一种元素)之间的转化关系为,且X能与W发生反应生成一种易溶于水的盐,则X可能是(
)
A.
B.
C.
D.NO
11.关于氨的下列叙述中,正确的是(
)
A.氨因为有刺激性气味,因此不用来作制冷剂
B.氨具有还原性,可以被氧化为NO
C.氨极易溶于水,因此氨水比较稳定(不容易分解)
D.氨溶于水显弱碱性,因此可使石蕊试液变为红色
12.设NA为阿伏加德罗常数的值,则下列说法正确的是(
)
A.标准状况下,1molSO3的体积为22.4L
B.1molCu与足量的S充分反应,转移的电子数为2NA
C.0.2molCu与含0.4molH2SO4的浓硫酸在加热的条件下反应时,生成的SO2在标准状况下的体积为4.48L
D.0.5molCu与足量浓HNO3反应时,转移的电子数为NA
13.将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是
A.大理石和稀盐酸
B.NaOH和NH4Cl
C.Cu和浓硝酸
D.MnO2和浓盐酸
14.我国清代《本草纲目拾遗》中记载无机药物
335
种,其中“强水”条目下写道:“性最烈,
能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是
A.氨水
B.硝酸
C.酒精
D.烧碱
15.工厂排放的烟气对环境造成污染,某企业用如图流程综合处理,下列有关说法正确的是
A.二氧化硫吸收塔中发生的反应为
B.氨气吸收塔中发生的反应为
C.上述流程利用的是氧化还原反应原理
D.上述流程可缓解温室效应
16.7.5g镁铝合金完全溶解于100mL密度为1.40g/mL、质量分数为63%的浓硝酸中得到NO2和NO的混合气体11.2L(标准状况),向反应后的溶液中加入3.0mol/LNaOH溶液,当金属离子恰好完全沉淀时,得到19.4g沉淀,下列说法不正确的是
A.该合金中铝与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C.NO2和NO的混合气体中,NO的体积分数是20%
D.得到19.4g沉淀时,加入NaOH溶液的体积是300mL
17.已知
1L
水中溶解了
700L
氨气(S.T.P),所得溶液密度为
0.883g/cm3.下列说法正确的是( )
A.溶液中
NH3
的物质的量浓度为
31.25mol/L
B.溶液中
OH﹣的物质的量浓度为
18.02mol/L
C.向所得溶液中再加入
1L
水,NH3
的物质的量浓度为
9.01mol/L
D.取原溶液
10mL,其中
NH3
的质量分数为
34.69%
二、填空题
18.(1)写出除去或分离括号内物质所用方法(填序号):
a.加热法b.过滤c.渗析d.水洗法e.升华法f.萃取和分液g.沉淀法
①碳酸钠(碳酸氢钠)_____;
②一氧化氮(二氧化氮)_____;
③氯化钠(I2)_____;
④氢氧化铁胶体中的离子_____;
⑤碘水中碘单质_____;
⑥氯化钠(硫酸钠)_____。
(2)①写出实验室中由固体物质制取氨气的化学方程式_____。
②欲用上述方法制取并收集一瓶干燥的氨气,从图中选择合适的装置,其连接顺序为_____。(按气流方向,用小写字母表示,如x→y→z)。
19.将下列性质的选项,填入各小题后面对应的括号中:A.脱水性;B.强酸性;C.二元酸;D.氧化性;E.吸水性
(1)将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。(________)
(2)NaOH与H2SO4反应,可生成Na2SO4和NaHSO4这两种盐。(________)
(3)在冷浓HNO3中放入铝片没明显现象。(________)
(4)浓H2SO4敞口久置会增重。(________)
(5)用稀硫酸清洗金属表面的氧化物(________)
(6)在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。(________)
(7)在稀HNO3中放入铜片产生NO。(________)
20.下列反应或者现象主要体现了硝酸的什么性质?久置浓硝酸显黄色________(填序号,下同),用稀硝酸清洗试管壁上的银________,稀硝酸清洗石灰水试剂瓶壁上的固体________,用浓硝酸清洗积碳的试管________。
①(强)氧化性???
②酸性?
③还原性?
④不稳定性?
⑤挥发性??
⑥脱水性?
⑦吸水性
三、工业流程题
21.氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:
(1)合成塔中发生反应的化学方程式为_______。
(2)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨_______的性质。
(3)氧化炉中,NH3转化为NO的化学方程式为_______。标准状况下,5.6LNH3被氧化为NO时转移电子的物质的量为_______。
(4)吸收塔中出来的尾气可用Na2CO3溶液吸收,主要反应为:
a.
b.
①吸收后的溶液经浓缩、结晶、过滤,得到晶体。该晶体中的主要杂质是_______(填化学式);吸收后排放的尾气中含量较高的氮氧化物是_______(填化学式)。
②根据反应b,每产生22.4L(标准状况下)吸收液质量将增加_______g。
(5)以合成氨为基础的化肥工业对粮食增长的贡献率占50%左右,但人类如果过度施用化肥,对环境造成影响是_______(任答1点);为了维持自然界中氮的平衡,除了合理施用化肥外,人类还可以采取措施是_______(任答1点)。
四、实验题
22.I.研究性学习小组进行SO2的制备及性质探究实验,装置如图(a为活塞,加热及固定装置已略去)。
(1)连接仪器、检查装置气密性,检验上述装置气密性的操作是_______,然后加药品,打开a,然后滴入浓硫酸,加热。
(2)铜与浓硫酸反应制备SO2的化学方程式是_______。
(3)探究SO2与品红作用的可逆性,请写出实验操作及现象_______。
(4)SO2通入KMnO4溶液中,现象是_______说明SO2具有_______性。
Ⅱ.硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而变化,总体上说,浓硝酸的还原产物主要为NO2、稀硝酸的还原产物为NO。回答下列问题:64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况),反应中消耗的HNO3的物质的量是_______,产生的气体是_______,其物质的量之比是_______。
参考答案
1.D2.C3.A4.B5.A6.B7.A8.B9.A10.C11.B12.D13.A14.B15.A16.A17.D
18.a
d
e
c
f
g
2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
a→d→c→f→e→i
19.E
C
D
E
B
A、D
B、D
20.④
①②
②
①
21.N2+3H22NH3
易液化
4NH3+5O24NO+6H2O
1.25mol
NaNO3
NO
32
水体富营养化(或土壤酸化板结、赤潮、酸雨光化学烟雾、臭氧层空洞等合理答案)
氨氮废水处理后排放(或工业污水处理后排放、养殖业污水处理后排放、出行多使用公共交通用具,减少私家车使用或植树造林等其他合理答案)
22.关闭分液漏斗活塞,向最后一支试管中加水至没过导管口微热圆底烧瓶,导管口有气泡冒出,停止加热后,回升一段水柱,则装置气密性良好
Cu+2H2SO4(浓)CuSO4+
SO2↑+2H2O
把褪色后的品红溶液加热,溶液恢复红色
溶液红色褪去(或变浅)
还原性
3.0mol
NO2和NO
1∶1
