人教版化学九年级下册第九单元 溶液测试题(含答案)
文档属性
| 名称 | 人教版化学九年级下册第九单元 溶液测试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 172.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-02 21:42:24 | ||
图片预览


文档简介
第9单元《溶液》测试题
一、单选题
1.下列有关水或溶液的说法,正确的是(
)
A.用直流电电解水,发现负极与正极上得到的气体体积比约为2
:1
B.自来水厂的净水过程中,加入明矾的作用是杀菌消毒
C.为了节约用水,可以用工业废水直接浇灌农田
D.通过洗洁精的乳化作用,可将食用油溶液解于水形成溶液
2.下列有关实验现象的描述正确的是
A.红磷在空气中燃烧产生白色烟雾
B.铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成四氧化三铁固体
C.黄铜片和铜片互相刻划,铜片上留下的痕迹比黄铜片上的深
D.硝酸铵固体溶于水放出大量的热
3.不同温度下,氧气的溶解度随压强的变化如图所示,图中t1对应的温度为30℃,则t2对应的温度(
)
A.大于30℃
B.小于30℃
C.等于30℃
D.无法确定
4.下列说法不正确的是( )
A.蔗糖水属于溶液
B.物质的溶解度一定随温度的升高而增大
C.在一定条件下,饱和溶液与不饱和溶液之间可以相互转换
D.打开汽水瓶盖,汽水会自动喷出来,证明气体的溶解度和压强有关
5.下列有关溶液的说法中,正确的是( )
A.植物油加入水中,形成无色溶液
B.无色透明的液体一定是溶液
C.硝酸铵溶于水,使溶液的温度降低
D.不饱和溶液降低温度一定会变成饱和溶液
6.已知:KNO3在20℃和60℃时,溶解度分别为31.6
g和110
g。(溶解度是指在一定温度下,固体溶质在100
g溶剂中所溶解的质量)
序号
①
②
③
④
⑤
水温/℃
20
20
60
60
60
KNO3的质量/g
20
60
60
110
150
水的质量/g
100
100
100
100
100
⑤中溶质的质量分数约为
A.25%
B.40%
C.52%
D.60%
7.下列物质不属于溶液的是(
)
A.生理盐水
B.消毒酒精
C.液氧
D.碘酒
8.水是生命之源,下列有关水与溶液的说法错误的是(
)
A.溶液具有均一性和稳定性,因为溶液中各种粒子保持静止不动
B.天然淡水生产自来水需要经过沉降、过滤、杀菌消毒等净化过程
C.水的净化操作中,蒸馏操作净化程度最高
D.用量简量取50
mL水配制溶液,若俯视读数,会导致配制的溶液溶质质量分数偏大
9.如图表示氯化钠、硝酸钾、硫酸镁三种物质的溶解度曲线。下列说法中错误的是
A.t2℃时,硝酸钾和硫酸镁的溶解度相同
B.硝酸钾的溶解度受温度影响比氯化钠大
C.t4℃时,其它条件不变,把硫酸镁溶液升温到t5℃,看到白色沉淀
D.氯化钠溶液中含有少量硝酸钾杂质,提纯的方法是蒸发溶剂
10.天热的时候把半杯糖水(蔗糖已全部溶解)放进冰箱的冷藏室,过一段时间后发现杯底出现了部分蔗糖晶体.对于这一现象的认识不正确的是(
)
A.未放入冰箱前的糖水一定是饱和溶液
B.降低温度可从糖水中获得蔗糖晶体
C.放入冰箱前糖水中蔗糖的质量分数比放入冰箱后大
D.温度降低后蔗糖的溶解度随之变小
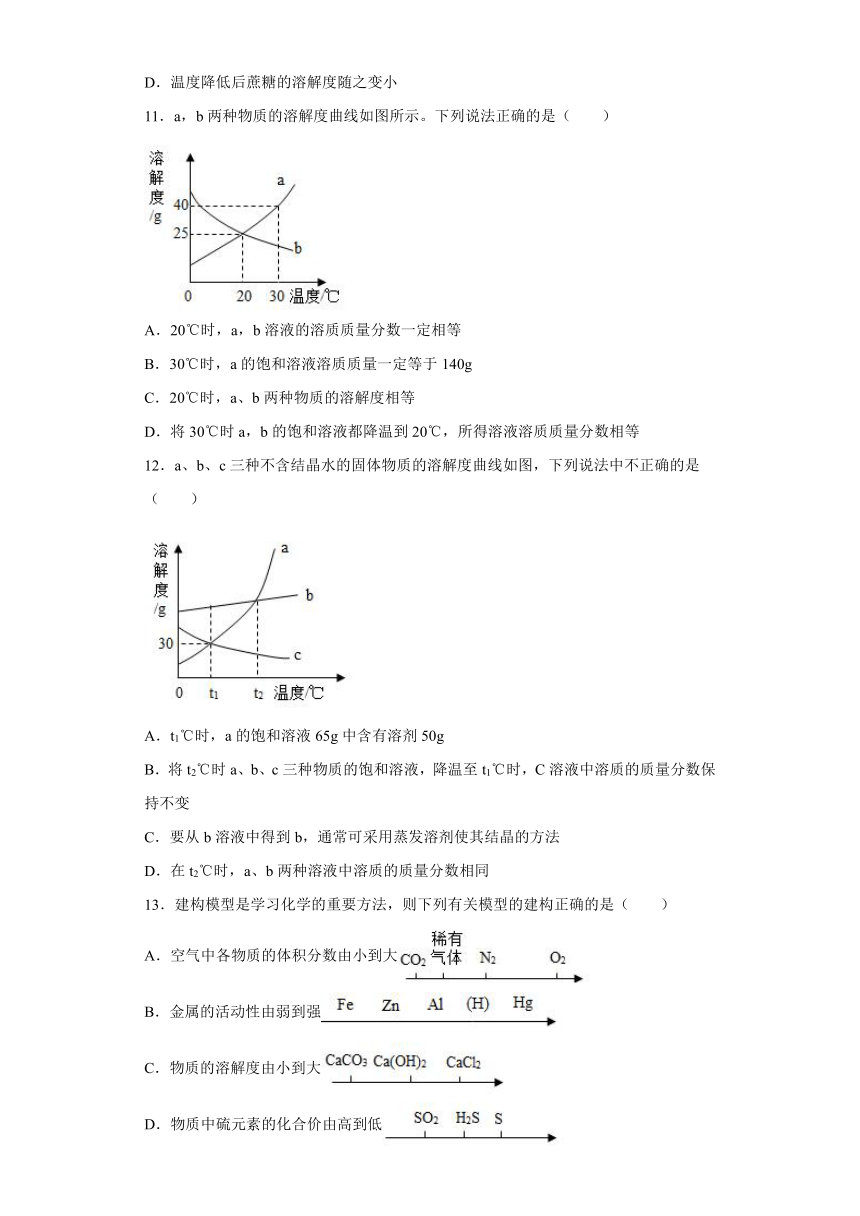
11.a,b两种物质的溶解度曲线如图所示。下列说法正确的是( )
A.20℃时,a,b溶液的溶质质量分数一定相等
B.30℃时,a的饱和溶液溶质质量一定等于140g
C.20℃时,a、b两种物质的溶解度相等
D.将30℃时a,b的饱和溶液都降温到20℃,所得溶液溶质质量分数相等
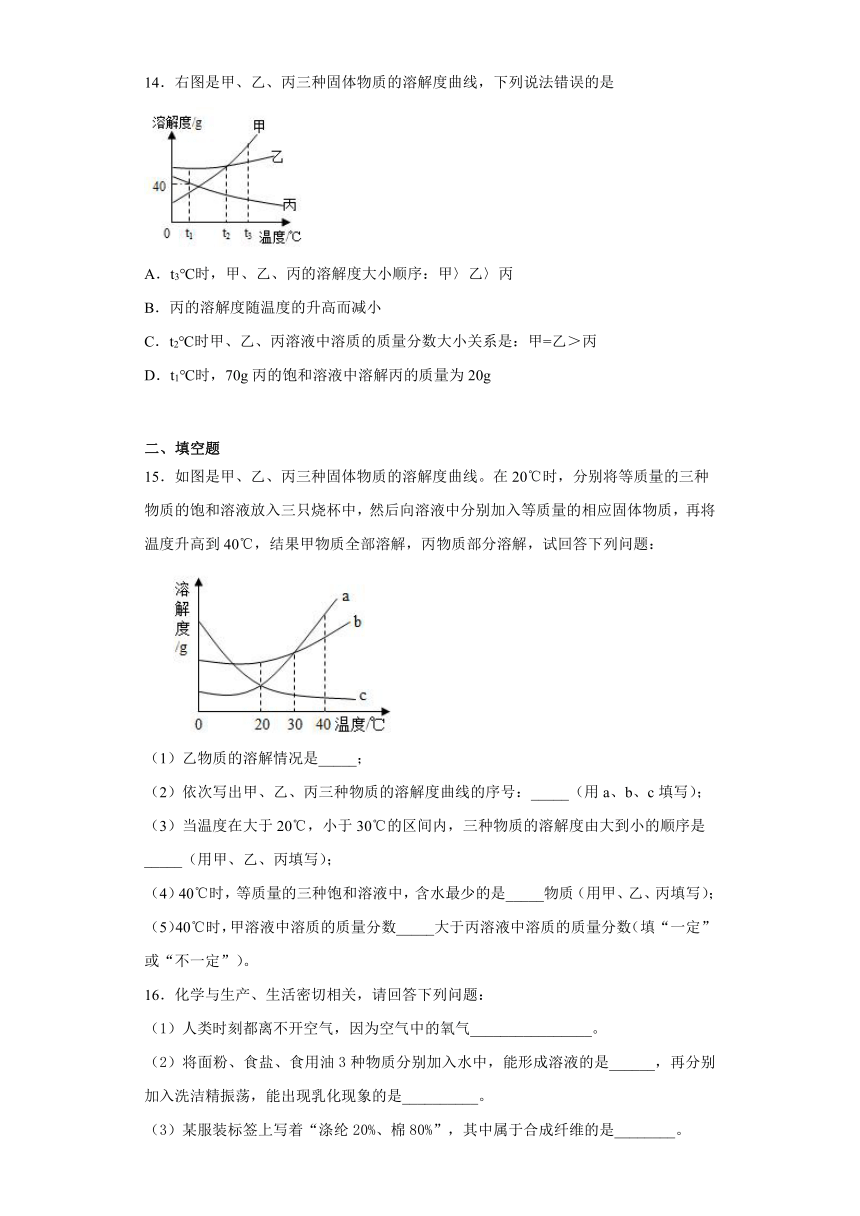
12.a、b、c三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是( )
A.t1℃时,a的饱和溶液65g中含有溶剂50g
B.将t2℃时a、b、c三种物质的饱和溶液,降温至t1℃时,C溶液中溶质的质量分数保持不变
C.要从b溶液中得到b,通常可采用蒸发溶剂使其结晶的方法
D.在t2℃时,a、b两种溶液中溶质的质量分数相同
13.建构模型是学习化学的重要方法,则下列有关模型的建构正确的是( )
A.空气中各物质的体积分数由小到大
B.金属的活动性由弱到强
C.物质的溶解度由小到大
D.物质中硫元素的化合价由高到低
14.右图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是
A.t3℃时,甲、乙、丙的溶解度大小顺序:甲〉乙〉丙
B.丙的溶解度随温度的升高而减小
C.t2℃时甲、乙、丙溶液中溶质的质量分数大小关系是:甲=乙>丙
D.t1℃时,70g丙的饱和溶液中溶解丙的质量为20g
二、填空题
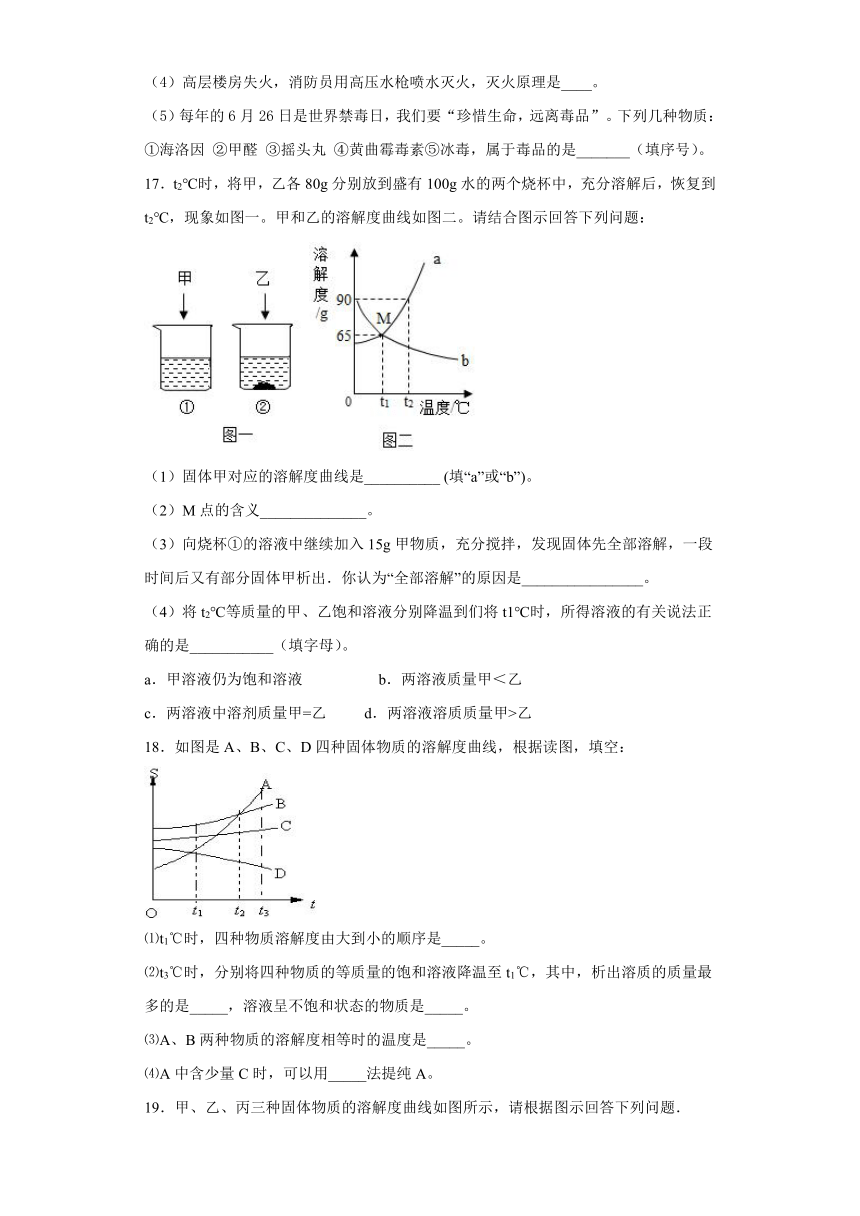
15.如图是甲、乙、丙三种固体物质的溶解度曲线。在20℃时,分别将等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液中分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题:
(1)乙物质的溶解情况是_____;
(2)依次写出甲、乙、丙三种物质的溶解度曲线的序号:_____(用a、b、c填写);
(3)当温度在大于20℃,小于30℃的区间内,三种物质的溶解度由大到小的顺序是_____(用甲、乙、丙填写);
(4)40℃时,等质量的三种饱和溶液中,含水最少的是_____物质(用甲、乙、丙填写);
(5)40℃时,甲溶液中溶质的质量分数_____大于丙溶液中溶质的质量分数(填“一定”或“不一定”)。
16.化学与生产、生活密切相关,请回答下列问题:
(1)人类时刻都离不开空气,因为空气中的氧气________________。
(2)将面粉、食盐、食用油3种物质分别加入水中,能形成溶液的是______,再分别加入洗洁精振荡,能出现乳化现象的是__________。
(3)某服装标签上写着“涤纶20%、棉80%”,其中属于合成纤维的是________。
(4)高层楼房失火,消防员用高压水枪喷水灭火,灭火原理是____。
(5)每年的6月26日是世界禁毒日,我们要“珍惜生命,远离毒品”。下列几种物质:
①海洛因
②甲醛
③摇头丸
④黄曲霉毒素⑤冰毒,属于毒品的是_______(填序号)。
17.t2℃时,将甲,乙各80g分别放到盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图一。甲和乙的溶解度曲线如图二。请结合图示回答下列问题:
(1)固体甲对应的溶解度曲线是__________
(填“a”或“b”)。
(2)M点的含义______________。
(3)向烧杯①的溶液中继续加入15g甲物质,充分搅拌,发现固体先全部溶解,一段时间后又有部分固体甲析出.你认为“全部溶解”的原因是________________。
(4)将t2℃等质量的甲、乙饱和溶液分别降温到们将t1℃时,所得溶液的有关说法正确的是___________(填字母)。
a.甲溶液仍为饱和溶液
b.两溶液质量甲<乙
c.两溶液中溶剂质量甲=乙
d.两溶液溶质质量甲>乙
18.如图是A、B、C、D四种固体物质的溶解度曲线,根据读图,填空:
⑴t1℃时,四种物质溶解度由大到小的顺序是_____。
⑵t3℃时,分别将四种物质的等质量的饱和溶液降温至t1℃,其中,析出溶质的质量最多的是_____,溶液呈不饱和状态的物质是_____。
⑶A、B两种物质的溶解度相等时的温度是_____。
⑷A中含少量C时,可以用_____法提纯A。
19.甲、乙、丙三种固体物质的溶解度曲线如图所示,请根据图示回答下列问题.
(1)丙物质的溶解度随温度的升高而
(填“增大”或“减小”).
(2)若要从乙物质的饱和溶液中得到乙固体,可用
结晶方法.
(3)t1℃时,将甲物质的饱和溶液升温到t3℃所得溶液中溶质的质量分数
(填“变大”、“变小”或“不变”).
(4)t3℃将100g水加入到盛有30g甲物质的烧杯中,充分溶解后得到不饱和溶液,若想使溶液恰好饱和,可采用的方法是:①加入甲物质
g;
②降温到
℃.
三、推断题
20.柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
(1)写出反应1的化学方程式:__________;
(2)操作1的名称为__________;
(3)反应3中会有气体生成,该气体是_________;
(4)柠檬酸亚铁的化学式为FeC6H6O7,柠檬酸亚铁中铁元素和碳元素质量比为________;
(5)若选用的稀硫酸溶质的质量分数为12%,则用100mL98%的浓硫酸(密度为1.8g/cm3)配制该稀硫酸,需加水________g。
21.我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
已知:①母液中有一种铵态氮肥
②
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____
(填离子符号),
流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3的溶解度曲线“消失”了,其原因可能是_____。
四、实验题
22.如图所示是实验室制取气体的装置,请回答:
(1)写出有标号仪器的名称:①_____;
(2)实验室用氯酸钾和二氧化锰制取氧气,反应的化学方程式为_____;若用充满水的D装置来收集氧气,气体应从_____(填“a”或“b”)端进入;
(3)实验室制取氢气的化学方程式是_____;用装置C来制备氢气,使用注射器的优点是_____、_____。
(4)用质量分数为37%的浓盐酸配制100g10%的盐酸,除了用到胶头滴管、玻璃棒和两种规格的量筒外,还需补充的一种仪器是_____。需要用量筒取用的水是_____mL(常温下水的密度为1g/mL)。
23.下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图,请回答下列问题:
(1)配制NaCl溶液的正确操作顺序_____(填写字母标号)。
(2)称量NaC1时,天平平衡后的状态如图E所示,游码标尺示数如图,则称取的NaCl质量为_____g。
(3)通过计算求出所需水的体积(mL)用250mL量筒(每一小格代表1mL)量取水的体积,如上图中读取的数值是_____。
五、计算题
24.某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求:
(1)铜锌合金中,铜的质量分数是______.
(2)所用稀硫酸溶液为50g时,反应所得溶液中溶质的质量分数是多少?
25.实验室常用氧气做实验。现将24.5
g氯酸钾与5.6
g二氧化锰混合物加热至反应完全(已知2KClO32KCl+3O2↑,二氧化锰不溶于水)。
请回答:(1)求所制得氧气的质量。
(2)将实验后剩余固体溶于85.1
g水中,求所得溶液中的溶质的质量分数。
参考答案
1.A
2.C
3.A
4.B
5.C
6.C
7.C
8.A
9.C
10.A
11.C
12.D
13.C
14.C
15.不溶解且有固体析出
a、c、b
丙、甲、乙
甲
不一定
16.
能供呼吸
食盐
食用油
涤纶
降低温度到可燃物的着火点以下
①③⑤
17.(1)a;(2)t1℃时,甲乙两物质的溶解度相等;(4)abd
18.B>C>A>D
A
D
t2℃
降温结晶
19.(1)减小;(2)蒸发溶剂;(3)不变;(4)①20;②t2.
20.Fe
+
H2SO4
=
Fe
SO4
+
H2↑
过滤
CO2
7
:
9
1290
21.过滤
此温度下碳酸氢钠的溶解度较小
氯化铵的溶解度受温度的影响较大
Na+、NH4+
CO2
温度高于60℃时,碳酸氢钠开始分解
22.酒精灯
b
能控制反应速率
节约药品
烧杯
73
23.BEADC
18.2
162
24.(1)35%;(2)28.6%
25.9.6g。
14.9%
一、单选题
1.下列有关水或溶液的说法,正确的是(
)
A.用直流电电解水,发现负极与正极上得到的气体体积比约为2
:1
B.自来水厂的净水过程中,加入明矾的作用是杀菌消毒
C.为了节约用水,可以用工业废水直接浇灌农田
D.通过洗洁精的乳化作用,可将食用油溶液解于水形成溶液
2.下列有关实验现象的描述正确的是
A.红磷在空气中燃烧产生白色烟雾
B.铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成四氧化三铁固体
C.黄铜片和铜片互相刻划,铜片上留下的痕迹比黄铜片上的深
D.硝酸铵固体溶于水放出大量的热
3.不同温度下,氧气的溶解度随压强的变化如图所示,图中t1对应的温度为30℃,则t2对应的温度(
)
A.大于30℃
B.小于30℃
C.等于30℃
D.无法确定
4.下列说法不正确的是( )
A.蔗糖水属于溶液
B.物质的溶解度一定随温度的升高而增大
C.在一定条件下,饱和溶液与不饱和溶液之间可以相互转换
D.打开汽水瓶盖,汽水会自动喷出来,证明气体的溶解度和压强有关
5.下列有关溶液的说法中,正确的是( )
A.植物油加入水中,形成无色溶液
B.无色透明的液体一定是溶液
C.硝酸铵溶于水,使溶液的温度降低
D.不饱和溶液降低温度一定会变成饱和溶液
6.已知:KNO3在20℃和60℃时,溶解度分别为31.6
g和110
g。(溶解度是指在一定温度下,固体溶质在100
g溶剂中所溶解的质量)
序号
①
②
③
④
⑤
水温/℃
20
20
60
60
60
KNO3的质量/g
20
60
60
110
150
水的质量/g
100
100
100
100
100
⑤中溶质的质量分数约为
A.25%
B.40%
C.52%
D.60%
7.下列物质不属于溶液的是(
)
A.生理盐水
B.消毒酒精
C.液氧
D.碘酒
8.水是生命之源,下列有关水与溶液的说法错误的是(
)
A.溶液具有均一性和稳定性,因为溶液中各种粒子保持静止不动
B.天然淡水生产自来水需要经过沉降、过滤、杀菌消毒等净化过程
C.水的净化操作中,蒸馏操作净化程度最高
D.用量简量取50
mL水配制溶液,若俯视读数,会导致配制的溶液溶质质量分数偏大
9.如图表示氯化钠、硝酸钾、硫酸镁三种物质的溶解度曲线。下列说法中错误的是
A.t2℃时,硝酸钾和硫酸镁的溶解度相同
B.硝酸钾的溶解度受温度影响比氯化钠大
C.t4℃时,其它条件不变,把硫酸镁溶液升温到t5℃,看到白色沉淀
D.氯化钠溶液中含有少量硝酸钾杂质,提纯的方法是蒸发溶剂
10.天热的时候把半杯糖水(蔗糖已全部溶解)放进冰箱的冷藏室,过一段时间后发现杯底出现了部分蔗糖晶体.对于这一现象的认识不正确的是(
)
A.未放入冰箱前的糖水一定是饱和溶液
B.降低温度可从糖水中获得蔗糖晶体
C.放入冰箱前糖水中蔗糖的质量分数比放入冰箱后大
D.温度降低后蔗糖的溶解度随之变小
11.a,b两种物质的溶解度曲线如图所示。下列说法正确的是( )
A.20℃时,a,b溶液的溶质质量分数一定相等
B.30℃时,a的饱和溶液溶质质量一定等于140g
C.20℃时,a、b两种物质的溶解度相等
D.将30℃时a,b的饱和溶液都降温到20℃,所得溶液溶质质量分数相等
12.a、b、c三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是( )
A.t1℃时,a的饱和溶液65g中含有溶剂50g
B.将t2℃时a、b、c三种物质的饱和溶液,降温至t1℃时,C溶液中溶质的质量分数保持不变
C.要从b溶液中得到b,通常可采用蒸发溶剂使其结晶的方法
D.在t2℃时,a、b两种溶液中溶质的质量分数相同
13.建构模型是学习化学的重要方法,则下列有关模型的建构正确的是( )
A.空气中各物质的体积分数由小到大
B.金属的活动性由弱到强
C.物质的溶解度由小到大
D.物质中硫元素的化合价由高到低
14.右图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是
A.t3℃时,甲、乙、丙的溶解度大小顺序:甲〉乙〉丙
B.丙的溶解度随温度的升高而减小
C.t2℃时甲、乙、丙溶液中溶质的质量分数大小关系是:甲=乙>丙
D.t1℃时,70g丙的饱和溶液中溶解丙的质量为20g
二、填空题
15.如图是甲、乙、丙三种固体物质的溶解度曲线。在20℃时,分别将等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液中分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题:
(1)乙物质的溶解情况是_____;
(2)依次写出甲、乙、丙三种物质的溶解度曲线的序号:_____(用a、b、c填写);
(3)当温度在大于20℃,小于30℃的区间内,三种物质的溶解度由大到小的顺序是_____(用甲、乙、丙填写);
(4)40℃时,等质量的三种饱和溶液中,含水最少的是_____物质(用甲、乙、丙填写);
(5)40℃时,甲溶液中溶质的质量分数_____大于丙溶液中溶质的质量分数(填“一定”或“不一定”)。
16.化学与生产、生活密切相关,请回答下列问题:
(1)人类时刻都离不开空气,因为空气中的氧气________________。
(2)将面粉、食盐、食用油3种物质分别加入水中,能形成溶液的是______,再分别加入洗洁精振荡,能出现乳化现象的是__________。
(3)某服装标签上写着“涤纶20%、棉80%”,其中属于合成纤维的是________。
(4)高层楼房失火,消防员用高压水枪喷水灭火,灭火原理是____。
(5)每年的6月26日是世界禁毒日,我们要“珍惜生命,远离毒品”。下列几种物质:
①海洛因
②甲醛
③摇头丸
④黄曲霉毒素⑤冰毒,属于毒品的是_______(填序号)。
17.t2℃时,将甲,乙各80g分别放到盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图一。甲和乙的溶解度曲线如图二。请结合图示回答下列问题:
(1)固体甲对应的溶解度曲线是__________
(填“a”或“b”)。
(2)M点的含义______________。
(3)向烧杯①的溶液中继续加入15g甲物质,充分搅拌,发现固体先全部溶解,一段时间后又有部分固体甲析出.你认为“全部溶解”的原因是________________。
(4)将t2℃等质量的甲、乙饱和溶液分别降温到们将t1℃时,所得溶液的有关说法正确的是___________(填字母)。
a.甲溶液仍为饱和溶液
b.两溶液质量甲<乙
c.两溶液中溶剂质量甲=乙
d.两溶液溶质质量甲>乙
18.如图是A、B、C、D四种固体物质的溶解度曲线,根据读图,填空:
⑴t1℃时,四种物质溶解度由大到小的顺序是_____。
⑵t3℃时,分别将四种物质的等质量的饱和溶液降温至t1℃,其中,析出溶质的质量最多的是_____,溶液呈不饱和状态的物质是_____。
⑶A、B两种物质的溶解度相等时的温度是_____。
⑷A中含少量C时,可以用_____法提纯A。
19.甲、乙、丙三种固体物质的溶解度曲线如图所示,请根据图示回答下列问题.
(1)丙物质的溶解度随温度的升高而
(填“增大”或“减小”).
(2)若要从乙物质的饱和溶液中得到乙固体,可用
结晶方法.
(3)t1℃时,将甲物质的饱和溶液升温到t3℃所得溶液中溶质的质量分数
(填“变大”、“变小”或“不变”).
(4)t3℃将100g水加入到盛有30g甲物质的烧杯中,充分溶解后得到不饱和溶液,若想使溶液恰好饱和,可采用的方法是:①加入甲物质
g;
②降温到
℃.
三、推断题
20.柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
(1)写出反应1的化学方程式:__________;
(2)操作1的名称为__________;
(3)反应3中会有气体生成,该气体是_________;
(4)柠檬酸亚铁的化学式为FeC6H6O7,柠檬酸亚铁中铁元素和碳元素质量比为________;
(5)若选用的稀硫酸溶质的质量分数为12%,则用100mL98%的浓硫酸(密度为1.8g/cm3)配制该稀硫酸,需加水________g。
21.我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
已知:①母液中有一种铵态氮肥
②
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____
(填离子符号),
流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3的溶解度曲线“消失”了,其原因可能是_____。
四、实验题
22.如图所示是实验室制取气体的装置,请回答:
(1)写出有标号仪器的名称:①_____;
(2)实验室用氯酸钾和二氧化锰制取氧气,反应的化学方程式为_____;若用充满水的D装置来收集氧气,气体应从_____(填“a”或“b”)端进入;
(3)实验室制取氢气的化学方程式是_____;用装置C来制备氢气,使用注射器的优点是_____、_____。
(4)用质量分数为37%的浓盐酸配制100g10%的盐酸,除了用到胶头滴管、玻璃棒和两种规格的量筒外,还需补充的一种仪器是_____。需要用量筒取用的水是_____mL(常温下水的密度为1g/mL)。
23.下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图,请回答下列问题:
(1)配制NaCl溶液的正确操作顺序_____(填写字母标号)。
(2)称量NaC1时,天平平衡后的状态如图E所示,游码标尺示数如图,则称取的NaCl质量为_____g。
(3)通过计算求出所需水的体积(mL)用250mL量筒(每一小格代表1mL)量取水的体积,如上图中读取的数值是_____。
五、计算题
24.某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求:
(1)铜锌合金中,铜的质量分数是______.
(2)所用稀硫酸溶液为50g时,反应所得溶液中溶质的质量分数是多少?
25.实验室常用氧气做实验。现将24.5
g氯酸钾与5.6
g二氧化锰混合物加热至反应完全(已知2KClO32KCl+3O2↑,二氧化锰不溶于水)。
请回答:(1)求所制得氧气的质量。
(2)将实验后剩余固体溶于85.1
g水中,求所得溶液中的溶质的质量分数。
参考答案
1.A
2.C
3.A
4.B
5.C
6.C
7.C
8.A
9.C
10.A
11.C
12.D
13.C
14.C
15.不溶解且有固体析出
a、c、b
丙、甲、乙
甲
不一定
16.
能供呼吸
食盐
食用油
涤纶
降低温度到可燃物的着火点以下
①③⑤
17.(1)a;(2)t1℃时,甲乙两物质的溶解度相等;(4)abd
18.B>C>A>D
A
D
t2℃
降温结晶
19.(1)减小;(2)蒸发溶剂;(3)不变;(4)①20;②t2.
20.Fe
+
H2SO4
=
Fe
SO4
+
H2↑
过滤
CO2
7
:
9
1290
21.过滤
此温度下碳酸氢钠的溶解度较小
氯化铵的溶解度受温度的影响较大
Na+、NH4+
CO2
温度高于60℃时,碳酸氢钠开始分解
22.酒精灯
b
能控制反应速率
节约药品
烧杯
73
23.BEADC
18.2
162
24.(1)35%;(2)28.6%
25.9.6g。
14.9%
同课章节目录
