人教版高中化学必修第1册“物质的量” 课件(共27张ppt)
文档属性
| 名称 | 人教版高中化学必修第1册“物质的量” 课件(共27张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-03 21:19:42 | ||
图片预览








文档简介
(共27张PPT)
物质的量——微观世界的精彩
古时候,有一个勇敢的小伙子想娶国王美丽的公主,
国王出题刁难,问了一个问题:
?
10kg米有多少粒?
李明
我一口气能喝36克水,我才厉害!
王健
我一口气能喝下12.04X1023个水分子,有多厉害!
提出问题
质
量
微粒数目
?
思
维
启
示
大米颗粒又小又多
分袋计量
微观粒子极小极多
分堆计量
计量“袋”数
计量“堆”数
科学方便
结论
人们习惯以集体为单位统计个体数量
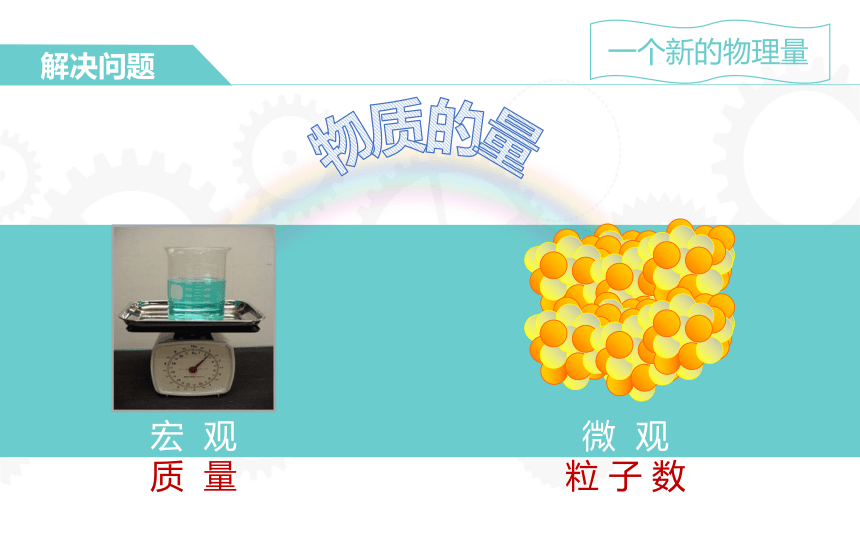
解决问题
宏
观
质
量
微
观
粒
子
数
物质的量
一个新的物理量
你认识几个?
物
理
量/符号
单位名称/单位符号
√
长
度
/
L
米
/
m
√
质
量
/
m
千克
/
kg
√
时
间
/
t
秒
/
s
√
电
流
/
I
安培
/
A
热力学温度
/
T
开尔文
/
K
发光强度
/
I
坎德拉
/
cd
物质的量
/
n
摩尔
/
mol
七个基本物理量的名称、单位及单位符号
什么是物质的量?
概念:表示含有一定数目粒子的集合体
符号
注意:物质的量是一个专有名词
不可以分开理解
单位:摩尔(简称:摩)
符号:mol
物质的量—n
集合体中的微粒数
科学上将12g12C所含有的碳原子数作为一定数量粒子集体的标准,定义为1mol
<问题探究>
:1mol(12g
这种碳)中所含的
碳原子数所含的粒子数是多少呢?
计
算
已知:
一个碳原子的质量为
1.993
×
10-23g
求:
12g
这种碳中所含的碳原子数?
解:
12g
1.993
×
10-23g
碳原子数=
≈
6.02×1023
个
阿伏伽德罗常数
意义:1mol的任何物质都含有约_______ _
个微粒
6.02×1023
阿伏加德罗常数:
0.012kg12C中所含的C原子数目
符号:NA
NA
≈
6.02×1023/mol
阿伏伽德罗常数
数
据
1
将6.02
?
1023个硬币排起来,可来回地球和太阳间
次之多
数
据
2
假如现有6.02
?
1023个鸡蛋平均分给全世界的人(约60亿),每人每天吃一个,可以吃
年
400亿
27亿
探
究
1mol物质能叙述成1mol铅笔、大米、纸张、硬币等吗?
结论
物质的量只适用于微观粒子
微观粒子:
分子、原子、离子、电子、质子等
特
别
提
示
适用范围
微观粒子(如分子、原子、离子等)或它们的特定组合。
不能用于宏观物体。
eg.1mol小米(
)
使用准则
必须指明微粒的种类(分子、原子、离子等),
并规定用该粒子的符号(化学式),不使用中文名称。
eg.1mol氢(
)
×
×
探
究
微粒数与“物质的量”之间的关系
微粒
(个)
物质的量
(摩尔)
?1molH2
?
2molO2
3molH2O
1×(6.02×1023)
3×(6.02×1023)
2×(6.02×1023)
?
微粒数=
物质的量
探
究
“物质的量”与微粒数之间的换算
微粒数=
物质的量×(6.02×1023/mol)
1.已知物质的量(n),求微粒数(N)
eg.
1
mol碳约含__________个碳原子
6.02×1023
探
究
“物质的量”与微粒数之间的换算
2.已知微粒数(N),求物质的量(n)
物质的量
=
微粒数÷(6.02×1023/mol)
eg.
6.02×1023个氦原子是_____mol氦原子
3.01×1023个氦原子的物质的量是_______mol
1
0.5
练一练
1mol氧原子中质子数为_____个
8NA
1mol水中的质子数为_____个
10NA
1.5mol水中的中子数为_____个
12NA
中和1molHCl需要NaOH为_____1mol
1
2molNaCl中的电子数为_____个
56NA
3molH2SO4总原子数为为_____NA
21
思
考
1mol
H2O
约含有6.02×1023个水分子,
质量是18g
1mol
Al
约含有6.02×1023
个铝原子,质量是27g
1mol不同物质所含的粒子数是相同的,但由于不同粒子的质量不同,
1mol不同物质的质量也不同。
1mol物质的质量到底有多大?
实
践
体
验
粒子符号
物质的式量
每个粒子的质量(g/个)
1摩物质含有的粒子数(个)
1摩物质质量(g)
C
12
1.993×10-23
Fe
56
9.032×10-23
H2SO4
98
1.628×10-22
H2O
18
2.990×10-23
Na+
23
3.821×10-23
OH-
17
2.824×10-23
NA
NA
NA
NA
NA
NA
12
56
98
18
23
17
讨
论
分析以上计算结果可得出什么规律?
1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量
1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量
1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量
结论
1mol任何微粒或物质的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
摩尔质量
摩
尔
质
量
概
念
单位物质的量的物质所具有的质量叫做摩尔质量
符号:M
常用单位:g/mol
、kg/mol
理
解
1mol物质的质量
数值上等于物质的相对原子(分子)质量
单位:g/mol(克/摩尔)
、Kg/mol
定义式
M
=
m
n
练
一
练
Na的摩尔质量为
Na+的摩尔质量为
H2SO4的摩尔质量为
HNO3的摩尔质量为
1molFe的质量是
1molO2的质量是
1molH2SO4的质量是
1molFe2+的质量是
56g
32g
98g
56g
23g/mol
23g/mol
98g/mol
63g/mol
物质的量
(n)
质量
(m)
粒子数
(N)
M×
÷M
×NA
NA÷
m、n、M、NA、N之间的关系
思
考
m(H2SO4)
n(H2SO4)
=
解:M(H2SO4)=98g/mol
M(H2SO4)
49g
98g/mol
=0.5mol
N(H2SO4)=
=0.5mol×6.02×1023/mol
n(H2SO4)×NA
=3.01×1023
49gH2SO4的物质的量是多少?所含H2SO4分子的个数是多少?
=
练
一
练
24.5克H2SO4的物质的量是
11克CO2的物质的量是
2.5molNa2CO3的质量是
1.5molH2O的质量是
19.6
g硫酸是
molH2SO4
,
含有
个硫酸分子,
其中含有
molH,计
个氢原子,含有
molO
,计
个氧原子
。
0.25mol
0.25mol
265g
27g
0.2
0.2NA
0.4
0.4NA
0.8
0.8NA
课
堂
小
结
一、物质的量(n):表示含有一定数目粒子的集合体
是国际单位制七个基本物理量之一
物质的量的单位是
摩尔、简称摩,符号:mol
二、阿伏加德罗常数:1
mol
任何粒子所含有的粒子数。
符号:
NA
单位:
mol-1,数值:约为6.02×1023
科学上规定为:
0.012
Kg
12C
中所含的碳原子数
三、摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量
数值上等于物质的相对原子/分子质量(以g/mol为单位时)
符号:M
常用单位:g/mol
、Kg/mol
物质的量
(n)
质量
(m)
粒子数
(N)
M×
÷M
×NA
NA÷
物质的量——微观世界的精彩
古时候,有一个勇敢的小伙子想娶国王美丽的公主,
国王出题刁难,问了一个问题:
?
10kg米有多少粒?
李明
我一口气能喝36克水,我才厉害!
王健
我一口气能喝下12.04X1023个水分子,有多厉害!
提出问题
质
量
微粒数目
?
思
维
启
示
大米颗粒又小又多
分袋计量
微观粒子极小极多
分堆计量
计量“袋”数
计量“堆”数
科学方便
结论
人们习惯以集体为单位统计个体数量
解决问题
宏
观
质
量
微
观
粒
子
数
物质的量
一个新的物理量
你认识几个?
物
理
量/符号
单位名称/单位符号
√
长
度
/
L
米
/
m
√
质
量
/
m
千克
/
kg
√
时
间
/
t
秒
/
s
√
电
流
/
I
安培
/
A
热力学温度
/
T
开尔文
/
K
发光强度
/
I
坎德拉
/
cd
物质的量
/
n
摩尔
/
mol
七个基本物理量的名称、单位及单位符号
什么是物质的量?
概念:表示含有一定数目粒子的集合体
符号
注意:物质的量是一个专有名词
不可以分开理解
单位:摩尔(简称:摩)
符号:mol
物质的量—n
集合体中的微粒数
科学上将12g12C所含有的碳原子数作为一定数量粒子集体的标准,定义为1mol
<问题探究>
:1mol(12g
这种碳)中所含的
碳原子数所含的粒子数是多少呢?
计
算
已知:
一个碳原子的质量为
1.993
×
10-23g
求:
12g
这种碳中所含的碳原子数?
解:
12g
1.993
×
10-23g
碳原子数=
≈
6.02×1023
个
阿伏伽德罗常数
意义:1mol的任何物质都含有约_______ _
个微粒
6.02×1023
阿伏加德罗常数:
0.012kg12C中所含的C原子数目
符号:NA
NA
≈
6.02×1023/mol
阿伏伽德罗常数
数
据
1
将6.02
?
1023个硬币排起来,可来回地球和太阳间
次之多
数
据
2
假如现有6.02
?
1023个鸡蛋平均分给全世界的人(约60亿),每人每天吃一个,可以吃
年
400亿
27亿
探
究
1mol物质能叙述成1mol铅笔、大米、纸张、硬币等吗?
结论
物质的量只适用于微观粒子
微观粒子:
分子、原子、离子、电子、质子等
特
别
提
示
适用范围
微观粒子(如分子、原子、离子等)或它们的特定组合。
不能用于宏观物体。
eg.1mol小米(
)
使用准则
必须指明微粒的种类(分子、原子、离子等),
并规定用该粒子的符号(化学式),不使用中文名称。
eg.1mol氢(
)
×
×
探
究
微粒数与“物质的量”之间的关系
微粒
(个)
物质的量
(摩尔)
?1molH2
?
2molO2
3molH2O
1×(6.02×1023)
3×(6.02×1023)
2×(6.02×1023)
?
微粒数=
物质的量
探
究
“物质的量”与微粒数之间的换算
微粒数=
物质的量×(6.02×1023/mol)
1.已知物质的量(n),求微粒数(N)
eg.
1
mol碳约含__________个碳原子
6.02×1023
探
究
“物质的量”与微粒数之间的换算
2.已知微粒数(N),求物质的量(n)
物质的量
=
微粒数÷(6.02×1023/mol)
eg.
6.02×1023个氦原子是_____mol氦原子
3.01×1023个氦原子的物质的量是_______mol
1
0.5
练一练
1mol氧原子中质子数为_____个
8NA
1mol水中的质子数为_____个
10NA
1.5mol水中的中子数为_____个
12NA
中和1molHCl需要NaOH为_____1mol
1
2molNaCl中的电子数为_____个
56NA
3molH2SO4总原子数为为_____NA
21
思
考
1mol
H2O
约含有6.02×1023个水分子,
质量是18g
1mol
Al
约含有6.02×1023
个铝原子,质量是27g
1mol不同物质所含的粒子数是相同的,但由于不同粒子的质量不同,
1mol不同物质的质量也不同。
1mol物质的质量到底有多大?
实
践
体
验
粒子符号
物质的式量
每个粒子的质量(g/个)
1摩物质含有的粒子数(个)
1摩物质质量(g)
C
12
1.993×10-23
Fe
56
9.032×10-23
H2SO4
98
1.628×10-22
H2O
18
2.990×10-23
Na+
23
3.821×10-23
OH-
17
2.824×10-23
NA
NA
NA
NA
NA
NA
12
56
98
18
23
17
讨
论
分析以上计算结果可得出什么规律?
1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量
1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量
1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量
结论
1mol任何微粒或物质的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
摩尔质量
摩
尔
质
量
概
念
单位物质的量的物质所具有的质量叫做摩尔质量
符号:M
常用单位:g/mol
、kg/mol
理
解
1mol物质的质量
数值上等于物质的相对原子(分子)质量
单位:g/mol(克/摩尔)
、Kg/mol
定义式
M
=
m
n
练
一
练
Na的摩尔质量为
Na+的摩尔质量为
H2SO4的摩尔质量为
HNO3的摩尔质量为
1molFe的质量是
1molO2的质量是
1molH2SO4的质量是
1molFe2+的质量是
56g
32g
98g
56g
23g/mol
23g/mol
98g/mol
63g/mol
物质的量
(n)
质量
(m)
粒子数
(N)
M×
÷M
×NA
NA÷
m、n、M、NA、N之间的关系
思
考
m(H2SO4)
n(H2SO4)
=
解:M(H2SO4)=98g/mol
M(H2SO4)
49g
98g/mol
=0.5mol
N(H2SO4)=
=0.5mol×6.02×1023/mol
n(H2SO4)×NA
=3.01×1023
49gH2SO4的物质的量是多少?所含H2SO4分子的个数是多少?
=
练
一
练
24.5克H2SO4的物质的量是
11克CO2的物质的量是
2.5molNa2CO3的质量是
1.5molH2O的质量是
19.6
g硫酸是
molH2SO4
,
含有
个硫酸分子,
其中含有
molH,计
个氢原子,含有
molO
,计
个氧原子
。
0.25mol
0.25mol
265g
27g
0.2
0.2NA
0.4
0.4NA
0.8
0.8NA
课
堂
小
结
一、物质的量(n):表示含有一定数目粒子的集合体
是国际单位制七个基本物理量之一
物质的量的单位是
摩尔、简称摩,符号:mol
二、阿伏加德罗常数:1
mol
任何粒子所含有的粒子数。
符号:
NA
单位:
mol-1,数值:约为6.02×1023
科学上规定为:
0.012
Kg
12C
中所含的碳原子数
三、摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量
数值上等于物质的相对原子/分子质量(以g/mol为单位时)
符号:M
常用单位:g/mol
、Kg/mol
物质的量
(n)
质量
(m)
粒子数
(N)
M×
÷M
×NA
NA÷
