金属的化学性质
图片预览





文档简介
(共22张PPT)
化学性质
课题 2.
金属
de
Fe
Cu
Mg
Zn
1、你知道那些金属可以和氧气反应吗?
镁、铝比较活泼,铁、铜次之,金最不活泼。
2、你知道它们和氧气反应的条件吗?
一.金属与氧气的反应
结论:1.不同的金属与氧气的反应条
件不同.
2.与氧气反应条件的不同,说明金属
的化学活动性不同.
通过金属与氧气反应的条件的难易,可以得出金属的
活动性不同,那么还有其他的方法判断金属的活动性
吗
资料:
16世纪中叶,瑞士化学家帕拉塞斯和17世纪的一些
化学家,都发现了有些金属和酸可以反应生成一种可
燃性气体---氢气.并且发现不同的金属反应的剧烈
程度不同.
如何判断Mg Zn Fe Cu 的活动性
2
3
设计的实验
观察到的现象
得到的结论
2
3
4
1
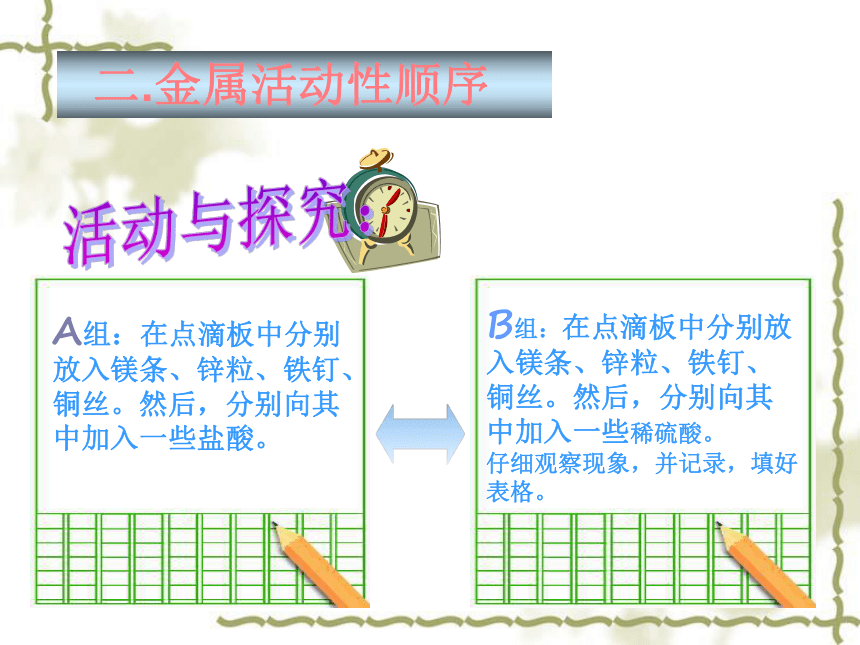
B组:在点滴板中分别放入镁条、锌粒、铁钉、铜丝。然后,分别向其中加入一些稀硫酸。
仔细观察现象,并记录,填好表格。
A组:在点滴板中分别放入镁条、锌粒、铁钉、铜丝。然后,分别向其中加入一些盐酸。
二.金属活动性顺序
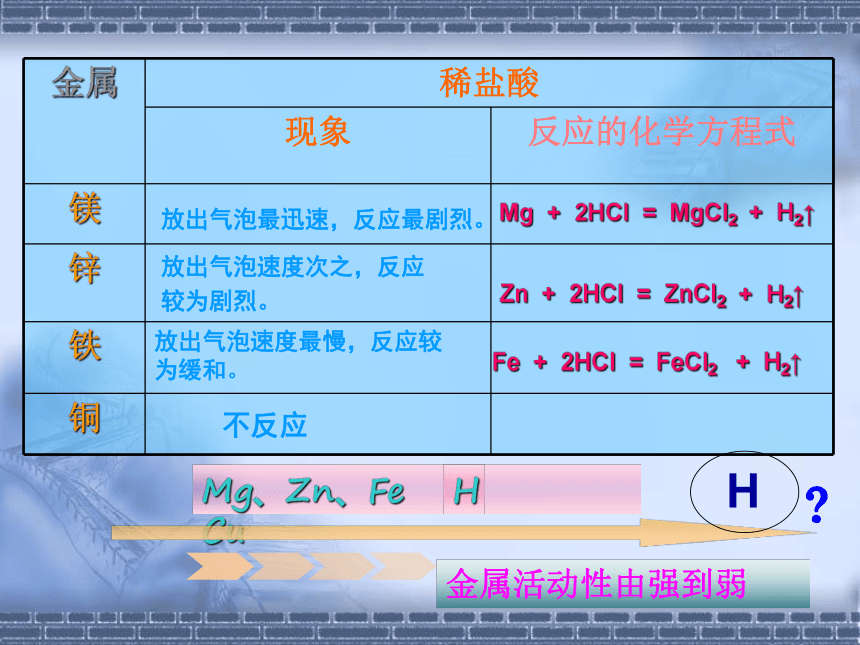
金属 稀盐酸
现象 反应的化学方程式
镁
锌
铁
铜
放出气泡最迅速,反应最剧烈。
放出气泡速度次之,反应
较为剧烈。
放出气泡速度最慢,反应较为缓和。
不反应
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
金属活动性由强到弱
Mg、Zn、Fe Cu
﹖
H
H
说明:铁能把铜从硫酸铜溶液中反应出来,这也是比较金属活动性的依据之一。
现象:_________________________________________________
________________________________________________________
将铁钉投入到硫酸铜溶液中有何现象?
铁钉表面会有红色物质析出,若时间足够
长,则溶液会从蓝色变为浅绿色。
Fe + CuSO4 = Cu + FeSO4
该反应的化学方程式:
活动性:Fe﹥Cu
1
2
3
设计的实验
观察到的现象
得到的结论
利用Al片Cu丝及 CuSO4 AgNO3 Al2(SO4)3溶液判断Al Cu Ag的活动性
铝与硫酸铜溶液的反应
铜与硝酸银溶液的反应
实验 现象 反应的化学方程式
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
铜丝浸入硫酸铝溶液中
浸入溶液中的铝丝
表面覆盖一层紫红
色物质,溶液由蓝
色逐渐变为无色。
浸入溶液中的铜丝
表面覆盖一层银白
色物质,溶液由无
色逐渐变为蓝色。
不反应
2Al + 3CuSO4= Al2(SO4)3 + 3Cu
Cu +2Ag NO3 =Cu(NO3)2 + 2Ag
根据刚才的实验填写表格
以上三种金属活动性顺序为:
Al Cu Ag
金属活动性由强到弱
常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性顺序由强逐渐减弱
3.在金属活动顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液中反应出来.
金属活动性顺序的应用:
1.在金属活动顺序里,金属的位置越靠前,它的活动性
就越强.
2.在金属活动性顺序里,位于氢之前的金属能反应出
盐酸(稀硫酸)中的氢
1.判断下列物质能否发生反应?若能,
写出相关化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液 (4)铝与硝酸银溶液
(5)银与氯化铜溶液 (6)镁与硫酸亚铁溶液
解答:可发生反应的:(2)(4)(6)
化学方程式:
(2)Zn + CuSO4 = Cu + ZnSO4
(4)Al +3AgNO3 = Al(NO3)3 + 3Ag
(6)Mg + FeSO4 = MgSO4 +Fe
2.有X Y Z三种金属,如果把X和Y分别放入
稀硫酸中, X 溶解并产生氢气,Y不反应;如果
把Y和Z分别放入硝酸银溶液中,过一会儿,在Y
的表面有银析出,而Z无变化.根据以上事实,判
断X Y Z的金属活动顺序.
解答: 金属活动性顺序 X>Y>Z
单质
化合物
化合物
单质
小结:
这种由一种单质与一种化合物反应,生成了另一种单质和另一种化合物的反应叫做置换反应。
对于以上的反应,从反应物和生成物的角度
分析,这些反应有何特点?将这一类反应与化合反
应、分解反应进行比较。
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
化合反应
特点:
分解反应
特点:
多变一。
一变多。
盐酸
God Save me!!
无所谓, 我无所谓…
为什么受伤的总是我!
我得意的笑,又得意的笑…
金属与盐酸的反应
化学性质
课题 2.
金属
de
Fe
Cu
Mg
Zn
1、你知道那些金属可以和氧气反应吗?
镁、铝比较活泼,铁、铜次之,金最不活泼。
2、你知道它们和氧气反应的条件吗?
一.金属与氧气的反应
结论:1.不同的金属与氧气的反应条
件不同.
2.与氧气反应条件的不同,说明金属
的化学活动性不同.
通过金属与氧气反应的条件的难易,可以得出金属的
活动性不同,那么还有其他的方法判断金属的活动性
吗
资料:
16世纪中叶,瑞士化学家帕拉塞斯和17世纪的一些
化学家,都发现了有些金属和酸可以反应生成一种可
燃性气体---氢气.并且发现不同的金属反应的剧烈
程度不同.
如何判断Mg Zn Fe Cu 的活动性
2
3
设计的实验
观察到的现象
得到的结论
2
3
4
1
B组:在点滴板中分别放入镁条、锌粒、铁钉、铜丝。然后,分别向其中加入一些稀硫酸。
仔细观察现象,并记录,填好表格。
A组:在点滴板中分别放入镁条、锌粒、铁钉、铜丝。然后,分别向其中加入一些盐酸。
二.金属活动性顺序
金属 稀盐酸
现象 反应的化学方程式
镁
锌
铁
铜
放出气泡最迅速,反应最剧烈。
放出气泡速度次之,反应
较为剧烈。
放出气泡速度最慢,反应较为缓和。
不反应
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
金属活动性由强到弱
Mg、Zn、Fe Cu
﹖
H
H
说明:铁能把铜从硫酸铜溶液中反应出来,这也是比较金属活动性的依据之一。
现象:_________________________________________________
________________________________________________________
将铁钉投入到硫酸铜溶液中有何现象?
铁钉表面会有红色物质析出,若时间足够
长,则溶液会从蓝色变为浅绿色。
Fe + CuSO4 = Cu + FeSO4
该反应的化学方程式:
活动性:Fe﹥Cu
1
2
3
设计的实验
观察到的现象
得到的结论
利用Al片Cu丝及 CuSO4 AgNO3 Al2(SO4)3溶液判断Al Cu Ag的活动性
铝与硫酸铜溶液的反应
铜与硝酸银溶液的反应
实验 现象 反应的化学方程式
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
铜丝浸入硫酸铝溶液中
浸入溶液中的铝丝
表面覆盖一层紫红
色物质,溶液由蓝
色逐渐变为无色。
浸入溶液中的铜丝
表面覆盖一层银白
色物质,溶液由无
色逐渐变为蓝色。
不反应
2Al + 3CuSO4= Al2(SO4)3 + 3Cu
Cu +2Ag NO3 =Cu(NO3)2 + 2Ag
根据刚才的实验填写表格
以上三种金属活动性顺序为:
Al Cu Ag
金属活动性由强到弱
常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性顺序由强逐渐减弱
3.在金属活动顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液中反应出来.
金属活动性顺序的应用:
1.在金属活动顺序里,金属的位置越靠前,它的活动性
就越强.
2.在金属活动性顺序里,位于氢之前的金属能反应出
盐酸(稀硫酸)中的氢
1.判断下列物质能否发生反应?若能,
写出相关化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液 (4)铝与硝酸银溶液
(5)银与氯化铜溶液 (6)镁与硫酸亚铁溶液
解答:可发生反应的:(2)(4)(6)
化学方程式:
(2)Zn + CuSO4 = Cu + ZnSO4
(4)Al +3AgNO3 = Al(NO3)3 + 3Ag
(6)Mg + FeSO4 = MgSO4 +Fe
2.有X Y Z三种金属,如果把X和Y分别放入
稀硫酸中, X 溶解并产生氢气,Y不反应;如果
把Y和Z分别放入硝酸银溶液中,过一会儿,在Y
的表面有银析出,而Z无变化.根据以上事实,判
断X Y Z的金属活动顺序.
解答: 金属活动性顺序 X>Y>Z
单质
化合物
化合物
单质
小结:
这种由一种单质与一种化合物反应,生成了另一种单质和另一种化合物的反应叫做置换反应。
对于以上的反应,从反应物和生成物的角度
分析,这些反应有何特点?将这一类反应与化合反
应、分解反应进行比较。
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
化合反应
特点:
分解反应
特点:
多变一。
一变多。
盐酸
God Save me!!
无所谓, 我无所谓…
为什么受伤的总是我!
我得意的笑,又得意的笑…
金属与盐酸的反应
