高中化学人教版(2019)必修1 第四章 第一节 原子结构与元素周期表(1)
文档属性
| 名称 | 高中化学人教版(2019)必修1 第四章 第一节 原子结构与元素周期表(1) |
|
|
| 格式 | docx | ||
| 文件大小 | 383.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-06 20:38:32 | ||
图片预览




文档简介
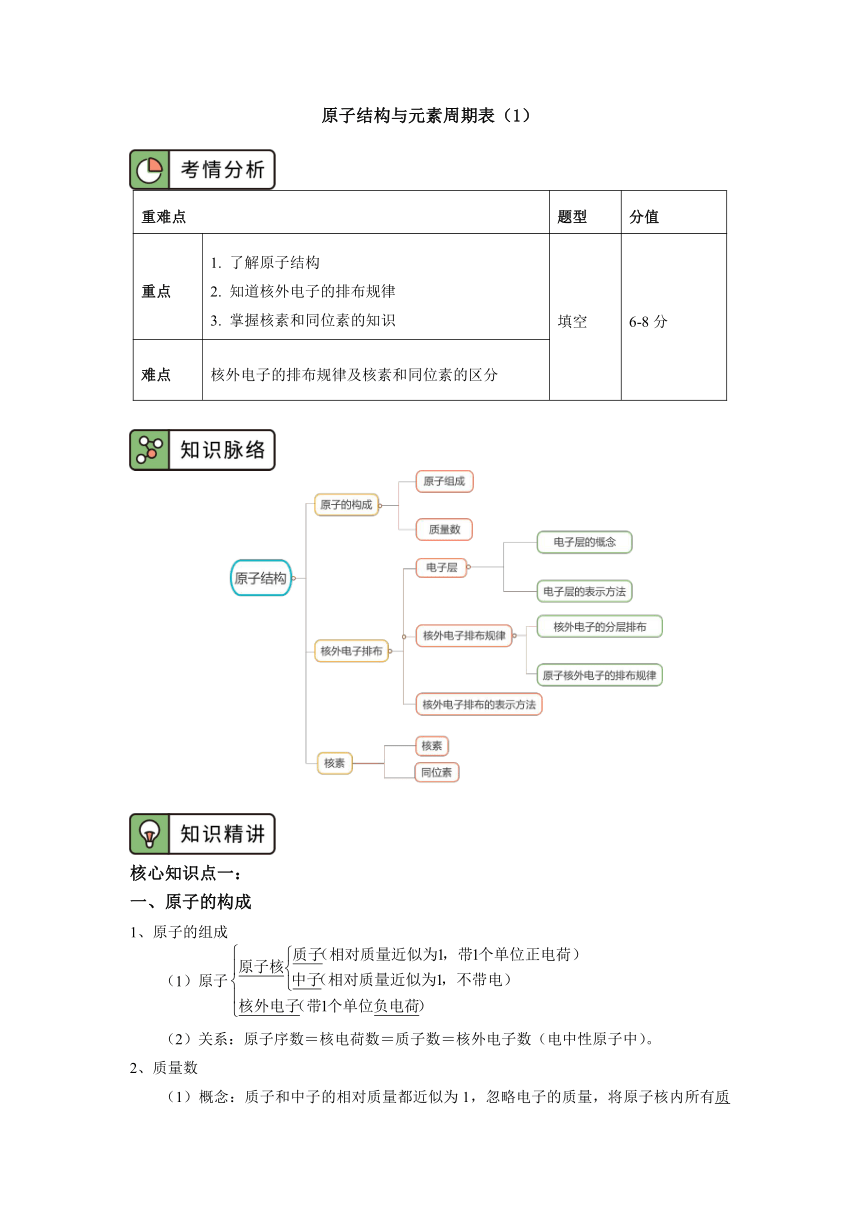
原子结构与元素周期表(1)
重难点
题型
分值
重点
1. 了解原子结构
2. 知道核外电子的排布规律
3. 掌握核素和同位素的知识
填空
6-8分
难点
核外电子的排布规律及核素和同位素的区分
核心知识点一:
一、原子的构成
1、原子的组成
(1)原子
(2)关系:原子序数=核电荷数=质子数=核外电子数(电中性原子中)。
2、质量数
(1)概念:质子和中子的相对质量都近似为1,忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫作质量数。
(2)关系:质量数(A)=质子数(Z)+中子数(N)。
二、核外电子排布
1、电子层
(1)概念:在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层,称作电子层。
(2)、电子层的表示方法
通常把能量最低、离核最近的电子层成为第一层;能量稍高、离核稍远的电子层称为第2层;这样由内向外称为第1、2、3、4、5、6、7···层,或用符号依次表示为K、L、M、N、O、P、Q···层。各电子层的表示符号及离核远近、能量高低关系可表示如下:
各电子层由内到外
电子层数
1
2
3
4
5
6
7
字母代号
K
L
M
N
O
P
Q
离核远近
由近到远
能量高低
由低到高
2、核外电子排布的一般规律
(1) 核外电子的分层排布
在多电子原子中,电子的能量不同,能量较低的在离核较近的区域内运动,能量较高的在离核较远的区域内运动,即电子在核外分层排布。
稀有气体元素原子的核外电子排布:
核电荷数
元素符号
各电子层的电子数
K
L
M
N
O
P
2
He
2
10
Ne
2
8
18
Ar
2
8
8
36
Kr
2
8
18
8
54
Xe
2
8
18
18
8
86
Rn
2
8
18
32
18
8
原子最外层有8个电子(最外层K层时,只有2个电子)的结构是相对比较稳定结构,稀有气体在结构上满足这一条件。
(2)原子核外电子的排布规律
①能量规律
核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
②数量规律
Ⅰ、第n层最多容纳2n2个电子。如K、L、M、N层最多容纳电子数分别为2、8、18、32。
Ⅱ、最外层电子数目最多不能超过8个(K层为最外层时不能超过2个)。
Ⅲ、次外层最多能容纳的电子数不超过18个。
3、核外电子排布的表示方法
(1)原子结构示意图,如下所示
(2)离子结构示意图
原子得到或失去一定数目的电子形成阴离子或阳离子,原子核不发生改变,只有核外电子(一般是最外层电子)数目发生了改变。
原子结构示意图中,核内质子数等于核外电子数,而离子结构示意图中,二者则不相等。如:
阳离子:核外电子数小于核电荷数。
阴离子:核外电子数大于核电荷数。
核心知识点二:
三、核素
1.原子构成及表示方法
(1)原子构成及表示方法:X,X表示元字符号,A表示原子的质量数,Z表示原子核内的质子数为14,质子数为6,中子数为8的碳原子。
(2)构成
原子
2. 核素
把具有一定数目质子和一定数目中子的一种原子叫做核素。如12C、13C、14C就是碳元素的三种不同核素。
3. 同位素
(1)定义:质子数相同而中子数不同的同一元素的不同原子互称为同位素。即同一元素的不同核素之间互为同位素,如三种核素均是氢元素的同位素。
(2)实例——氢元素的同位素:1H、2H、3H
氢元素的原子核
原子名称
原子
符号
质子数(Z)
中子数(N)
1
0
氕
H
1
1
氘
H或D
1
2
氚
H或T
(3)同位素的特征
①位置:因质子数相同,故元素符号相同,在元素周期表里占据同一位置,即同位。
②结构:质子数相同,中子数不同
③性质:同位素的原子核外电子层结构相同,因此化学性质几乎完全相同,因质量数不同,物理性质略有差异
④存在:天然存在的同位素,相互间保持一定的比率。元素的相对原子质量,就是按照该元素各种核素所占的一定百分比计算出来的平均值
(4)同位素的用途
①C在考古工作中用于测定文物的年代。
②H、H用于制造氢弹。
③利用放射性同位素释放的射线育种、给金属探伤、诊断和治疗疾病等。
核心知识点一:
下列各原子结构示意图中所表示的核外电子排布正确的是( )
【答案】C
【解析】A项不符合能量最低原理,应该先排满K层再排L层;B项不符合各层最多排2n2个电子,K层最多排2个电子;D项不符合最外层最多只能排8个电子。
【考点】原子核外电子的排布
(1)A元素原子的核电荷数为8,其原子核内的质子数为______,该元素原子的二价阴离子中,核外电子数为______。
(2)B元素原子的一价阳离子的核外有18个电子,质量数为40,该元素原子的原子核内中子数为________。
【答案】(1)8 10 (2)21
【解析】(1)核电荷数=质子数,阴离子的核外电子数=质子数+所带电荷数=10。(2)B元素质子数是18+1=19,质量数为40,该元素原子的中子数为40-19=21。
【考点】考查原子结构的基本知识
核心知识点二:
下列有关钯原子(Pd)的说法错误的是( )
A. 原子序数为46 B. 质子数为46
C. 电子数为46 D. 中子数为46
【答案】D
【解释】由Pd可知,钯的原子序数为46,核外电子数=原子序数=质子数=46;核内中子数为106-46=60,D选项错误。
【考点】考查原子结构知识点
2. 在Li、N、Na、Mg、Li、C中:
(1)________和________互为同位素。
(2)________和________质量数相等,但不能互称同位素。
(3)________和________的中子数相等,但质子数不相等,所以不是同一种元素。
【答案】(1)Li Li (2)N C (3)Na Mg
【解析】质子数相同,中子数不同的同一元素的不同原子互称为同位素,故Li与Li互为同位素;N与C质量数相等,但因质子数不同,不能互称同位素;Na和Mg的中子数均是12,但质子数不相等,所以不是同一种元素。
【考点】考查同位素相关知识
(答题时间:25分钟)
一、选择题:本题包括12小题,每小题4分,共48分。
1. 下列叙述正确的是( )
A. 电子的能量越低,运动区域离核越远
B. 核外电子的分层排布即是核外电子的分层运动
C. 稀有气体元素原子的最外层都排有8个电子
D. 当M层是最外层时,最多可排布18个电子
2. 核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素种类有( )
A. 1种 B. 2种 C. 3种 D. 4种
3. 下图微粒的结构示意图,正确的是( )
4. 简单原子的原子结构可用下图形象地表示:
其中表示质子或电子,表示中子,则下列有关①②③的叙述正确的是 ( )
A. ①②③互为同素异形体
B. ①②③互为同位素
C. ①②③是三种化学性质不同的粒子
D. ①②③具有相同的质量数
5. 下列说法错误的是( )
A. H、H、H+和H2是氢元素的四种不同粒子
B. Ca和Ca、石墨和金刚石均为同素异形体
C. H和H是不同的核素
D. C和C互为同位素,物理性质不同,但化学性质几乎完全相同
6. Ne是最早发现的Ne元素的稳定同位素,汤姆孙(J.J.Thomson)和阿斯通(F.W.Aston)在1913年发现了Ne。下列有关说法正确的是( )
A. Ne和Ne是同素异形体
B. Ne和Ne属于不同的核素
C. Ne和Ne的性质完全相同
D. Ne转变为Ne为化学变化
7. (1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是________。
(2)已知某粒子的结构示意图为,试回答:
①当x-y=10时,该粒子为________(填“原子”“阳离子”或“阴离子”)。
②当y=8时,粒子可能为(填名称) ________、________、________、________、________。
1. B 解析:电子的能量越低,运动区域离核越近,A错误;氦最外层只有2个电子,C错误;当M层是最外层时,最多可排布8个电子,D错误。
2. B 解析:在1号~18号元素中,符合题给要求的元素是Li和P。
3. A 解析:B中微粒结构示意图是Cl-而不是Cl,C中Ar的原子结构示意图应为,D中K的原子结构示意图应为。
4. B 解析:由题图可知三个原子的质子数、核外电子数相同,而中子数不同,所以应为同位素,同位素的化学性质相同。
5. B 解析:元素的存在形式有游离态和化合态两种,A项中的四种微粒是氢元素的四种不同粒子,H和H是质子数均为1,中子数不等的不同的氢原子,它们是不同的核素;12C和14C由于其质子数均为6,而中子数分别为6和8,故它们互为同位素,同理,Ca和Ca互为同位素其物理性质不同但化学性质几乎完全相同;金刚石与石墨是由碳元素组成的不同的单质,它们互为同素异形体。
6. B 解析:Ne和Ne的质子数相同,中子数不同,互为同位素,A错误;Ne和Ne的质子数相同,中子数不同,属于不同的核素,B正确;Ne和Ne的化学性质完全相同,物理性质不同,C错误;Ne 转变为Ne中没有新物质生成,不是化学变化,D错误。
7.(1) (2)①原子 ②氩原子 氯离子 硫离子 钾离子 钙离子
解析:(1)设:核电荷数=质子数=a,元素原子的电子层数为x,最外层电子数为y,依题意:a=5x,a=3y,则5x=3y,x=3y/5。因原子的最外层电子数不超过8,即y为1~8的正整数,故仅当y=5,x=3合理,该元素的核电荷数为15。
(2)①当x-y=10时,x=10+y,说明核电荷数等于核外电子数,所以该粒子应为原子;②当y=8时,应有18个电子的粒子,所以可能为氩原子、氯离子、硫离子、钾离子、钙离子。
重难点
题型
分值
重点
1. 了解原子结构
2. 知道核外电子的排布规律
3. 掌握核素和同位素的知识
填空
6-8分
难点
核外电子的排布规律及核素和同位素的区分
核心知识点一:
一、原子的构成
1、原子的组成
(1)原子
(2)关系:原子序数=核电荷数=质子数=核外电子数(电中性原子中)。
2、质量数
(1)概念:质子和中子的相对质量都近似为1,忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫作质量数。
(2)关系:质量数(A)=质子数(Z)+中子数(N)。
二、核外电子排布
1、电子层
(1)概念:在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层,称作电子层。
(2)、电子层的表示方法
通常把能量最低、离核最近的电子层成为第一层;能量稍高、离核稍远的电子层称为第2层;这样由内向外称为第1、2、3、4、5、6、7···层,或用符号依次表示为K、L、M、N、O、P、Q···层。各电子层的表示符号及离核远近、能量高低关系可表示如下:
各电子层由内到外
电子层数
1
2
3
4
5
6
7
字母代号
K
L
M
N
O
P
Q
离核远近
由近到远
能量高低
由低到高
2、核外电子排布的一般规律
(1) 核外电子的分层排布
在多电子原子中,电子的能量不同,能量较低的在离核较近的区域内运动,能量较高的在离核较远的区域内运动,即电子在核外分层排布。
稀有气体元素原子的核外电子排布:
核电荷数
元素符号
各电子层的电子数
K
L
M
N
O
P
2
He
2
10
Ne
2
8
18
Ar
2
8
8
36
Kr
2
8
18
8
54
Xe
2
8
18
18
8
86
Rn
2
8
18
32
18
8
原子最外层有8个电子(最外层K层时,只有2个电子)的结构是相对比较稳定结构,稀有气体在结构上满足这一条件。
(2)原子核外电子的排布规律
①能量规律
核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
②数量规律
Ⅰ、第n层最多容纳2n2个电子。如K、L、M、N层最多容纳电子数分别为2、8、18、32。
Ⅱ、最外层电子数目最多不能超过8个(K层为最外层时不能超过2个)。
Ⅲ、次外层最多能容纳的电子数不超过18个。
3、核外电子排布的表示方法
(1)原子结构示意图,如下所示
(2)离子结构示意图
原子得到或失去一定数目的电子形成阴离子或阳离子,原子核不发生改变,只有核外电子(一般是最外层电子)数目发生了改变。
原子结构示意图中,核内质子数等于核外电子数,而离子结构示意图中,二者则不相等。如:
阳离子:核外电子数小于核电荷数。
阴离子:核外电子数大于核电荷数。
核心知识点二:
三、核素
1.原子构成及表示方法
(1)原子构成及表示方法:X,X表示元字符号,A表示原子的质量数,Z表示原子核内的质子数为14,质子数为6,中子数为8的碳原子。
(2)构成
原子
2. 核素
把具有一定数目质子和一定数目中子的一种原子叫做核素。如12C、13C、14C就是碳元素的三种不同核素。
3. 同位素
(1)定义:质子数相同而中子数不同的同一元素的不同原子互称为同位素。即同一元素的不同核素之间互为同位素,如三种核素均是氢元素的同位素。
(2)实例——氢元素的同位素:1H、2H、3H
氢元素的原子核
原子名称
原子
符号
质子数(Z)
中子数(N)
1
0
氕
H
1
1
氘
H或D
1
2
氚
H或T
(3)同位素的特征
①位置:因质子数相同,故元素符号相同,在元素周期表里占据同一位置,即同位。
②结构:质子数相同,中子数不同
③性质:同位素的原子核外电子层结构相同,因此化学性质几乎完全相同,因质量数不同,物理性质略有差异
④存在:天然存在的同位素,相互间保持一定的比率。元素的相对原子质量,就是按照该元素各种核素所占的一定百分比计算出来的平均值
(4)同位素的用途
①C在考古工作中用于测定文物的年代。
②H、H用于制造氢弹。
③利用放射性同位素释放的射线育种、给金属探伤、诊断和治疗疾病等。
核心知识点一:
下列各原子结构示意图中所表示的核外电子排布正确的是( )
【答案】C
【解析】A项不符合能量最低原理,应该先排满K层再排L层;B项不符合各层最多排2n2个电子,K层最多排2个电子;D项不符合最外层最多只能排8个电子。
【考点】原子核外电子的排布
(1)A元素原子的核电荷数为8,其原子核内的质子数为______,该元素原子的二价阴离子中,核外电子数为______。
(2)B元素原子的一价阳离子的核外有18个电子,质量数为40,该元素原子的原子核内中子数为________。
【答案】(1)8 10 (2)21
【解析】(1)核电荷数=质子数,阴离子的核外电子数=质子数+所带电荷数=10。(2)B元素质子数是18+1=19,质量数为40,该元素原子的中子数为40-19=21。
【考点】考查原子结构的基本知识
核心知识点二:
下列有关钯原子(Pd)的说法错误的是( )
A. 原子序数为46 B. 质子数为46
C. 电子数为46 D. 中子数为46
【答案】D
【解释】由Pd可知,钯的原子序数为46,核外电子数=原子序数=质子数=46;核内中子数为106-46=60,D选项错误。
【考点】考查原子结构知识点
2. 在Li、N、Na、Mg、Li、C中:
(1)________和________互为同位素。
(2)________和________质量数相等,但不能互称同位素。
(3)________和________的中子数相等,但质子数不相等,所以不是同一种元素。
【答案】(1)Li Li (2)N C (3)Na Mg
【解析】质子数相同,中子数不同的同一元素的不同原子互称为同位素,故Li与Li互为同位素;N与C质量数相等,但因质子数不同,不能互称同位素;Na和Mg的中子数均是12,但质子数不相等,所以不是同一种元素。
【考点】考查同位素相关知识
(答题时间:25分钟)
一、选择题:本题包括12小题,每小题4分,共48分。
1. 下列叙述正确的是( )
A. 电子的能量越低,运动区域离核越远
B. 核外电子的分层排布即是核外电子的分层运动
C. 稀有气体元素原子的最外层都排有8个电子
D. 当M层是最外层时,最多可排布18个电子
2. 核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素种类有( )
A. 1种 B. 2种 C. 3种 D. 4种
3. 下图微粒的结构示意图,正确的是( )
4. 简单原子的原子结构可用下图形象地表示:
其中表示质子或电子,表示中子,则下列有关①②③的叙述正确的是 ( )
A. ①②③互为同素异形体
B. ①②③互为同位素
C. ①②③是三种化学性质不同的粒子
D. ①②③具有相同的质量数
5. 下列说法错误的是( )
A. H、H、H+和H2是氢元素的四种不同粒子
B. Ca和Ca、石墨和金刚石均为同素异形体
C. H和H是不同的核素
D. C和C互为同位素,物理性质不同,但化学性质几乎完全相同
6. Ne是最早发现的Ne元素的稳定同位素,汤姆孙(J.J.Thomson)和阿斯通(F.W.Aston)在1913年发现了Ne。下列有关说法正确的是( )
A. Ne和Ne是同素异形体
B. Ne和Ne属于不同的核素
C. Ne和Ne的性质完全相同
D. Ne转变为Ne为化学变化
7. (1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是________。
(2)已知某粒子的结构示意图为,试回答:
①当x-y=10时,该粒子为________(填“原子”“阳离子”或“阴离子”)。
②当y=8时,粒子可能为(填名称) ________、________、________、________、________。
1. B 解析:电子的能量越低,运动区域离核越近,A错误;氦最外层只有2个电子,C错误;当M层是最外层时,最多可排布8个电子,D错误。
2. B 解析:在1号~18号元素中,符合题给要求的元素是Li和P。
3. A 解析:B中微粒结构示意图是Cl-而不是Cl,C中Ar的原子结构示意图应为,D中K的原子结构示意图应为。
4. B 解析:由题图可知三个原子的质子数、核外电子数相同,而中子数不同,所以应为同位素,同位素的化学性质相同。
5. B 解析:元素的存在形式有游离态和化合态两种,A项中的四种微粒是氢元素的四种不同粒子,H和H是质子数均为1,中子数不等的不同的氢原子,它们是不同的核素;12C和14C由于其质子数均为6,而中子数分别为6和8,故它们互为同位素,同理,Ca和Ca互为同位素其物理性质不同但化学性质几乎完全相同;金刚石与石墨是由碳元素组成的不同的单质,它们互为同素异形体。
6. B 解析:Ne和Ne的质子数相同,中子数不同,互为同位素,A错误;Ne和Ne的质子数相同,中子数不同,属于不同的核素,B正确;Ne和Ne的化学性质完全相同,物理性质不同,C错误;Ne 转变为Ne中没有新物质生成,不是化学变化,D错误。
7.(1) (2)①原子 ②氩原子 氯离子 硫离子 钾离子 钙离子
解析:(1)设:核电荷数=质子数=a,元素原子的电子层数为x,最外层电子数为y,依题意:a=5x,a=3y,则5x=3y,x=3y/5。因原子的最外层电子数不超过8,即y为1~8的正整数,故仅当y=5,x=3合理,该元素的核电荷数为15。
(2)①当x-y=10时,x=10+y,说明核电荷数等于核外电子数,所以该粒子应为原子;②当y=8时,应有18个电子的粒子,所以可能为氩原子、氯离子、硫离子、钾离子、钙离子。
