高中化学人教版(2019)必修1 第四章 第三节 化学键
文档属性
| 名称 | 高中化学人教版(2019)必修1 第四章 第三节 化学键 |
|
|
| 格式 | docx | ||
| 文件大小 | 638.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-06 00:00:00 | ||
图片预览



文档简介
化学键
重难点
题型
分值
重点
1. 了解化学键的概念和化学反应的本质
2. 理解离子键的概念,能用电子式表示离子键
3. 了解共价键的定义和共价化合物的电子式书写
选择与填空
6-8分
难点
离子键与共价键的判断
核心知识点一:
一、化学键
定义:相邻的两个或多个原子之间强烈的相互作用叫做化学键。
说明:直接相邻的原子间强烈的相互作用,破坏这种作用需较大能量。
二、离子键
1. 从原子结构角度分析NaCl的形成过程
2. 离子键的概念与本质
(1)概念:阴、阳离子间通过静电作用所形成的化学键叫做离子键。
(2)成键微粒:阳离子和阴离子
(3)成键本质:活泼金属原子容易失去电子而形成阳离子,活泼非金属原子容易得到电子形成阴离子。当活泼金属遇到活泼非金属时,电子发生转移,分别形成阳、阴离子,再通过静电作用形成离子键。
(4)成键元素:活泼金属(如:K、Na、Ca、Ba等,主要是ⅠA和ⅡA族元素)和活泼非金属(如:F、Cl、Br、O等,主要是ⅥA族和ⅦA族元素)相互结合时形成离子键。
3. 离子化合物
(1)概念:由离子键构成的化合物。
(2)常见阴离子化合物
①强碱:如NaOH、KOH、Ba(OH)2等
②绝大多数盐:如NaCl、KNO3、NH4Cl等
③金属氧化物:如Na2O、CaO、MgO等
4. 电子式的几种表示方法
(1)离子
单核阳离子符号,即为阳离子的电子式,如H+、K+、Na+、Mg2+;原子团的阳离子;复杂阴、阳离子。
(2)离子化合物
K2S、CaC2、CaO、CaF2、Na2O2、NH4Cl
5. 离子键与离子化合物的关系
(1)三个“一定”
①含有离子键的化合物一定是离子化合物
②离子化合物中一定含有离子键
③离子化合物中一定含有阴离子和阳离子
(2)两个“不一定”
①离子化合物中不一定含有金属元素
②含有金属元素的化合物不一定是离子化合物
核心知识点二:
一、共价键
定义:原子间通过共用电子对所形成的化学键叫共价键。
说明:①成键元素:通常为非金属元素的原子间。②成键原因:同种或不同种元素的原子之间结合成分子时并不发生电子的完全得失,而是通过共用电子对而结合的。③共价键可以形成单质也可形成化合物。
非极性键:同种元素的原子之间形成的共价键称非极性共价键,简称非极性键。
极性键:不同元素的原子之间形成的共价键称极性共价键,简称极性键。
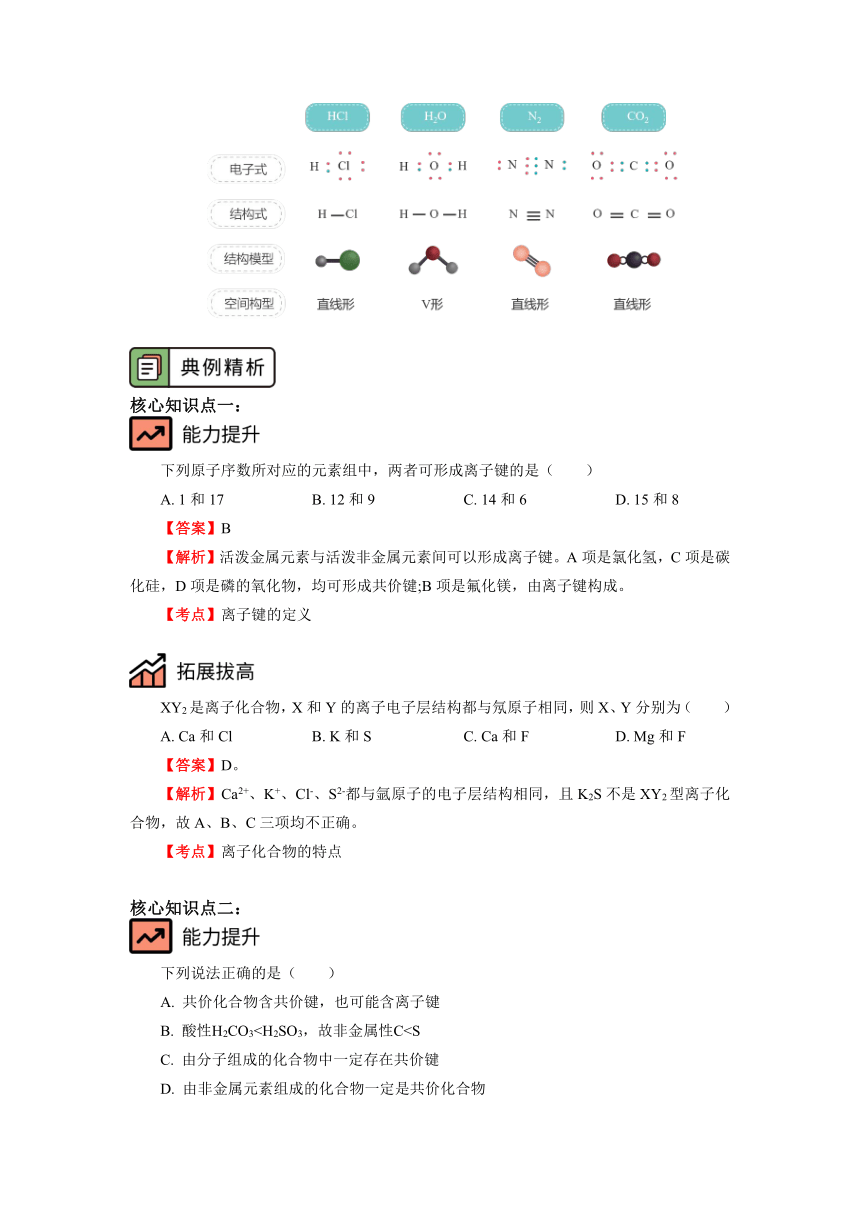
二、常见共价化合物
三、共价化合物的几种表现形式。
核心知识点一:
下列原子序数所对应的元素组中,两者可形成离子键的是( )
A. 1和17 B. 12和9 C. 14和6 D. 15和8
【答案】B
【解析】活泼金属元素与活泼非金属元素间可以形成离子键。A项是氯化氢,C项是碳化硅,D项是磷的氧化物,均可形成共价键;B项是氟化镁,由离子键构成。
【考点】离子键的定义
XY2是离子化合物,X和Y的离子电子层结构都与氖原子相同,则X、Y分别为( )
A. Ca和Cl B. K和S C. Ca和F D. Mg和F
【答案】D。
【解析】Ca2+、K+、Cl-、S2-都与氩原子的电子层结构相同,且K2S不是XY2型离子化合物,故A、B、C三项均不正确。
【考点】离子化合物的特点
核心知识点二:
下列说法正确的是( )
A. 共价化合物含共价键,也可能含离子键
B. 酸性H2CO3C. 由分子组成的化合物中一定存在共价键
D. 由非金属元素组成的化合物一定是共价化合物
【解析】A错,共价化合物中不含离子键;B错,由酸性H2CO3下列说法正确的是( )
A. P4和NO2都是共价化合物
B. CCl4和NH3分子中都含有极性键
C. CaO和SiO2都是离子化合物
D. Na2O2是离子化合物,只含有离子键
【答案】B。
【解析】P4和NO2分子中都含有共价键,但P4是磷的单质,故A项错;CCl4、NH3分子中都含极性键,B正确;CaO是离子化合物,SiO2是共价化合物,C错;Na2O2中O22-是通过共价键形成的,所以Na2O2中既有离子键又有共价键,故D错。
【考点】离子键和共价键的区别
(答题时间:25分钟)
一、选择题
1. 下列说法正确的是( )
A. 离子键就是使阴、阳离子结合成化合物的静电引力
B. 含有离子键的化合物一定是离子化合物
C. 所有金属与所有非金属之间都能形成离子键
D. 在化合物Na2O2中,阴、阳离子的个数比为1∶1
2. 下列化合物中含有离子键的是( )
A. CO2 B. NaCl
C. CH4 D. H3PO4
3. 下列物质的电子式正确的是( )
4. 现有如下各种说法:①在水中氢、氧原子间均以化学键相结合 ②硅晶体熔化需要克服分子间作用力 ③离子键是阳离子和阴离子的相互吸引力 ④根据电离方程式HCl===H++Cl-,判断HCl分子里存在离子键 ⑤有化学键断裂的变化属于化学变化。上述各种说法正确的是( )
A. 都不正确 B. ①②⑤
C. ②④⑤ D. ①②③
5. 下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A. NH4Cl→NH3↑+HCl↑
B. NH3+CO2+H2O→NH4HCO3
C. 2NaOH+Cl2→NaCl+NaClO+H2O
D. 2Na2O2+2CO2→2Na2CO3+O2
6. 短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且简单离子Ym-与Zn+具有相同的核外电子排布。下列化合物中同时存在非极性键和离子键的是( )
A. Z2Y2 B. X2Y4
C. Z2Y D. ZYX
7. 按要求填空:有下列物质:①O2;②CO2;③NH3;④Na2O;⑤Na2O2;⑥NaOH;⑦CaBr2;⑧H2O2;⑨NH4Cl;⑩HBr,回答下列问题:
(1)只含有极性键的是________;
(2)只含有非极性键的是________;
(3)含有极性键和非极性键的是________;
(4)只含有离子键的离子化合物是________;
(5)含有非极性键的离子化合物是________。
1. 【答案】B
【解析】离子键就是使阴、阳离子结合成化合物的静电作用,包括静电吸引和静电排斥,A错误;含有离子键的化合物一定是离子化合物,B正确;有些金属与非金属之间不能形成离子键,如AlCl3,C错误;在化合物Na2O2中阴、阳离子分别是O、Na+,个数比是1∶2,D错误。
2. 【答案】B
【解析】A. CO2只含有共价键,故A错误;B. NaCl是离子化合物,含有离子键,故B正确;C. CH4是共价化合物只含有共价键,故C错误;D. H3PO4是共价化合物,只含有共价键,故D错误,此题选B。
3. 【答案】D
【解析】A项应为Na+[∶H]-;B项应为Na+[∶]-;C项应为[]+[∶∶]-。
4. 【答案】A
【解析】在水分子内部,氢原子与氧原子以共价键结合;硅晶体为原子晶体,熔化时克服原子间的共价键;离子键为阴离子与阳离子间通过静电作用形成的化学键;氯化氢分子中原子间以共价键结合;化学变化分为旧键断裂与新键形成两个过程,只有化学键断裂不一定发生化学变化,例如氯化钠的溶解。
5. 【答案】D
【解析】A. 在NH4Cl→NH3↑+HCl↑中,NH4Cl中含有离子键、极性共价键,发生反应时断裂时只断裂离子键、极性共价键,产生的气体中只含有极性共价键,错误;B. 在发生反应NH3+CO2+H2O→NH4HCO3时,断裂了极性共价键产生的物质中形成了离子键、极性共价键,不符合题意,错误;C. 在发生反应:2NaOH+Cl2→NaCl+NaClO+H2O时,断裂了离子键、极性共价键、非极性共价键,反应形成生成物时,产生了离子键、极性共价键,没有非极性共价键,错误;D. 在发生反应2Na2O2+2CO2→2Na2CO3+O2中,断裂了离子键、非极性共价键、极性共价键,产生生成物时,形成了离子键、极性共价键和非极性共价键,符合题意,正确。
6. 【答案】A
【解析】简单离子Ym-与Zn+具有相同的核外电子排布,推出Z在Y的下一周期,即Y是第二周期,Z是第三周期元素,A:Z2Y2为Na2O2,Y:O,Z:Na,根据原子序数之和为20,则X:H,符合题意,则过氧化钠的电子式:Na+[]2-Na+,含有离子键和极性共价键,正确;B. 找不出符合题意的元素,错误;C. Z2Y为Na2O,符合题意,但是氧化钠的电子式:Na+[]2-Na+,只有离子键,无共价键,错误;D. ZYX为NaOH,符合题意,电子式:Na+[H]-,不含有非极性共价键,错误。
7. 【答案】(1)②③⑩ (2)① (3)⑧ (4)④⑦ (5)⑤
【解析】①O2为非金属单质,只含有非极性键;②CO2为共价化合物只含有极性键;③NH3为共价化合物只含有极性键;④Na2O为离子化合物只含有离子键;⑤Na2O2为离子化合物含有离子键,O与O间存在非极性键;⑥NaOH为离子化合物含有离子键,O与H间存在极性键;⑦CaBr2为离子化合物只含有离子键;⑧H2O2为共价化合物H与O间存在极性键,O与O间存在非极性键;⑨NH4Cl为离子化合物含有离子键,N与H间存在极性键;⑩HBr为共价化合物只含有极性键。
(1)只含有极性键的有②③⑩;
(2)只含有非极性键的有①;
(3)含有极性键和非极性键的有⑧;
(4)只含有离子键的离子化合物的有④⑦;
(5)含有非极性键的离子化合物的有⑤。
重难点
题型
分值
重点
1. 了解化学键的概念和化学反应的本质
2. 理解离子键的概念,能用电子式表示离子键
3. 了解共价键的定义和共价化合物的电子式书写
选择与填空
6-8分
难点
离子键与共价键的判断
核心知识点一:
一、化学键
定义:相邻的两个或多个原子之间强烈的相互作用叫做化学键。
说明:直接相邻的原子间强烈的相互作用,破坏这种作用需较大能量。
二、离子键
1. 从原子结构角度分析NaCl的形成过程
2. 离子键的概念与本质
(1)概念:阴、阳离子间通过静电作用所形成的化学键叫做离子键。
(2)成键微粒:阳离子和阴离子
(3)成键本质:活泼金属原子容易失去电子而形成阳离子,活泼非金属原子容易得到电子形成阴离子。当活泼金属遇到活泼非金属时,电子发生转移,分别形成阳、阴离子,再通过静电作用形成离子键。
(4)成键元素:活泼金属(如:K、Na、Ca、Ba等,主要是ⅠA和ⅡA族元素)和活泼非金属(如:F、Cl、Br、O等,主要是ⅥA族和ⅦA族元素)相互结合时形成离子键。
3. 离子化合物
(1)概念:由离子键构成的化合物。
(2)常见阴离子化合物
①强碱:如NaOH、KOH、Ba(OH)2等
②绝大多数盐:如NaCl、KNO3、NH4Cl等
③金属氧化物:如Na2O、CaO、MgO等
4. 电子式的几种表示方法
(1)离子
单核阳离子符号,即为阳离子的电子式,如H+、K+、Na+、Mg2+;原子团的阳离子;复杂阴、阳离子。
(2)离子化合物
K2S、CaC2、CaO、CaF2、Na2O2、NH4Cl
5. 离子键与离子化合物的关系
(1)三个“一定”
①含有离子键的化合物一定是离子化合物
②离子化合物中一定含有离子键
③离子化合物中一定含有阴离子和阳离子
(2)两个“不一定”
①离子化合物中不一定含有金属元素
②含有金属元素的化合物不一定是离子化合物
核心知识点二:
一、共价键
定义:原子间通过共用电子对所形成的化学键叫共价键。
说明:①成键元素:通常为非金属元素的原子间。②成键原因:同种或不同种元素的原子之间结合成分子时并不发生电子的完全得失,而是通过共用电子对而结合的。③共价键可以形成单质也可形成化合物。
非极性键:同种元素的原子之间形成的共价键称非极性共价键,简称非极性键。
极性键:不同元素的原子之间形成的共价键称极性共价键,简称极性键。
二、常见共价化合物
三、共价化合物的几种表现形式。
核心知识点一:
下列原子序数所对应的元素组中,两者可形成离子键的是( )
A. 1和17 B. 12和9 C. 14和6 D. 15和8
【答案】B
【解析】活泼金属元素与活泼非金属元素间可以形成离子键。A项是氯化氢,C项是碳化硅,D项是磷的氧化物,均可形成共价键;B项是氟化镁,由离子键构成。
【考点】离子键的定义
XY2是离子化合物,X和Y的离子电子层结构都与氖原子相同,则X、Y分别为( )
A. Ca和Cl B. K和S C. Ca和F D. Mg和F
【答案】D。
【解析】Ca2+、K+、Cl-、S2-都与氩原子的电子层结构相同,且K2S不是XY2型离子化合物,故A、B、C三项均不正确。
【考点】离子化合物的特点
核心知识点二:
下列说法正确的是( )
A. 共价化合物含共价键,也可能含离子键
B. 酸性H2CO3
D. 由非金属元素组成的化合物一定是共价化合物
【解析】A错,共价化合物中不含离子键;B错,由酸性H2CO3
A. P4和NO2都是共价化合物
B. CCl4和NH3分子中都含有极性键
C. CaO和SiO2都是离子化合物
D. Na2O2是离子化合物,只含有离子键
【答案】B。
【解析】P4和NO2分子中都含有共价键,但P4是磷的单质,故A项错;CCl4、NH3分子中都含极性键,B正确;CaO是离子化合物,SiO2是共价化合物,C错;Na2O2中O22-是通过共价键形成的,所以Na2O2中既有离子键又有共价键,故D错。
【考点】离子键和共价键的区别
(答题时间:25分钟)
一、选择题
1. 下列说法正确的是( )
A. 离子键就是使阴、阳离子结合成化合物的静电引力
B. 含有离子键的化合物一定是离子化合物
C. 所有金属与所有非金属之间都能形成离子键
D. 在化合物Na2O2中,阴、阳离子的个数比为1∶1
2. 下列化合物中含有离子键的是( )
A. CO2 B. NaCl
C. CH4 D. H3PO4
3. 下列物质的电子式正确的是( )
4. 现有如下各种说法:①在水中氢、氧原子间均以化学键相结合 ②硅晶体熔化需要克服分子间作用力 ③离子键是阳离子和阴离子的相互吸引力 ④根据电离方程式HCl===H++Cl-,判断HCl分子里存在离子键 ⑤有化学键断裂的变化属于化学变化。上述各种说法正确的是( )
A. 都不正确 B. ①②⑤
C. ②④⑤ D. ①②③
5. 下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A. NH4Cl→NH3↑+HCl↑
B. NH3+CO2+H2O→NH4HCO3
C. 2NaOH+Cl2→NaCl+NaClO+H2O
D. 2Na2O2+2CO2→2Na2CO3+O2
6. 短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且简单离子Ym-与Zn+具有相同的核外电子排布。下列化合物中同时存在非极性键和离子键的是( )
A. Z2Y2 B. X2Y4
C. Z2Y D. ZYX
7. 按要求填空:有下列物质:①O2;②CO2;③NH3;④Na2O;⑤Na2O2;⑥NaOH;⑦CaBr2;⑧H2O2;⑨NH4Cl;⑩HBr,回答下列问题:
(1)只含有极性键的是________;
(2)只含有非极性键的是________;
(3)含有极性键和非极性键的是________;
(4)只含有离子键的离子化合物是________;
(5)含有非极性键的离子化合物是________。
1. 【答案】B
【解析】离子键就是使阴、阳离子结合成化合物的静电作用,包括静电吸引和静电排斥,A错误;含有离子键的化合物一定是离子化合物,B正确;有些金属与非金属之间不能形成离子键,如AlCl3,C错误;在化合物Na2O2中阴、阳离子分别是O、Na+,个数比是1∶2,D错误。
2. 【答案】B
【解析】A. CO2只含有共价键,故A错误;B. NaCl是离子化合物,含有离子键,故B正确;C. CH4是共价化合物只含有共价键,故C错误;D. H3PO4是共价化合物,只含有共价键,故D错误,此题选B。
3. 【答案】D
【解析】A项应为Na+[∶H]-;B项应为Na+[∶]-;C项应为[]+[∶∶]-。
4. 【答案】A
【解析】在水分子内部,氢原子与氧原子以共价键结合;硅晶体为原子晶体,熔化时克服原子间的共价键;离子键为阴离子与阳离子间通过静电作用形成的化学键;氯化氢分子中原子间以共价键结合;化学变化分为旧键断裂与新键形成两个过程,只有化学键断裂不一定发生化学变化,例如氯化钠的溶解。
5. 【答案】D
【解析】A. 在NH4Cl→NH3↑+HCl↑中,NH4Cl中含有离子键、极性共价键,发生反应时断裂时只断裂离子键、极性共价键,产生的气体中只含有极性共价键,错误;B. 在发生反应NH3+CO2+H2O→NH4HCO3时,断裂了极性共价键产生的物质中形成了离子键、极性共价键,不符合题意,错误;C. 在发生反应:2NaOH+Cl2→NaCl+NaClO+H2O时,断裂了离子键、极性共价键、非极性共价键,反应形成生成物时,产生了离子键、极性共价键,没有非极性共价键,错误;D. 在发生反应2Na2O2+2CO2→2Na2CO3+O2中,断裂了离子键、非极性共价键、极性共价键,产生生成物时,形成了离子键、极性共价键和非极性共价键,符合题意,正确。
6. 【答案】A
【解析】简单离子Ym-与Zn+具有相同的核外电子排布,推出Z在Y的下一周期,即Y是第二周期,Z是第三周期元素,A:Z2Y2为Na2O2,Y:O,Z:Na,根据原子序数之和为20,则X:H,符合题意,则过氧化钠的电子式:Na+[]2-Na+,含有离子键和极性共价键,正确;B. 找不出符合题意的元素,错误;C. Z2Y为Na2O,符合题意,但是氧化钠的电子式:Na+[]2-Na+,只有离子键,无共价键,错误;D. ZYX为NaOH,符合题意,电子式:Na+[H]-,不含有非极性共价键,错误。
7. 【答案】(1)②③⑩ (2)① (3)⑧ (4)④⑦ (5)⑤
【解析】①O2为非金属单质,只含有非极性键;②CO2为共价化合物只含有极性键;③NH3为共价化合物只含有极性键;④Na2O为离子化合物只含有离子键;⑤Na2O2为离子化合物含有离子键,O与O间存在非极性键;⑥NaOH为离子化合物含有离子键,O与H间存在极性键;⑦CaBr2为离子化合物只含有离子键;⑧H2O2为共价化合物H与O间存在极性键,O与O间存在非极性键;⑨NH4Cl为离子化合物含有离子键,N与H间存在极性键;⑩HBr为共价化合物只含有极性键。
(1)只含有极性键的有②③⑩;
(2)只含有非极性键的有①;
(3)含有极性键和非极性键的有⑧;
(4)只含有离子键的离子化合物的有④⑦;
(5)含有非极性键的离子化合物的有⑤。
