2020-2021学年高一化学人教版(2019)必修第二册5.1.2硫酸和硫酸根的检验 课件(共23张ppt)
文档属性
| 名称 | 2020-2021学年高一化学人教版(2019)必修第二册5.1.2硫酸和硫酸根的检验 课件(共23张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-07 19:51:13 | ||
图片预览






文档简介
第1节 硫及其化合物
第2课时 硫酸和硫酸根的检验
一、稀硫酸
(1)使指示剂变色:
(2)与活泼金属反应放出氢气 (硝酸除外)
(3)与碱发生中和反应:
(4)与碱性氧化物反应:
(5)与某些盐反应:
使紫色石蕊试液变红
H++ OH -= H2O
2H++ CuO = Cu2++ H2O
2H++ CO32- = H2O + CO2↑
1、稀硫酸具有酸的通性
H2SO4=2H++SO42-
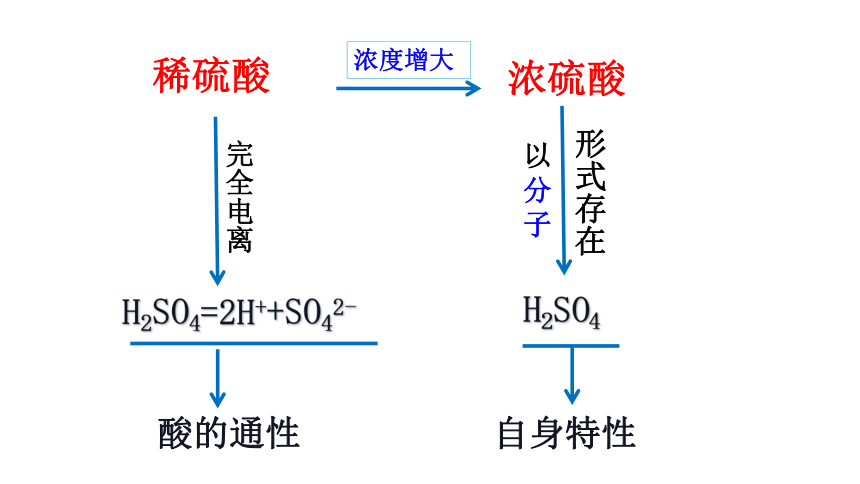
稀硫酸
完全电离
H2SO4=2H++SO42-
酸的通性
浓度增大
浓硫酸
以分子
形式存在
H2SO4
自身特性
1、浓H2SO4的物理性质
色态:无色、粘稠的油状液体
沸点:约338℃——难挥发酸(高沸点酸)
密度:1.84g/cm3——高密度酸
溶解性:跟水任意比互溶,溶解放出大量热
[思考] 浓硫酸应如何稀释?
用于制易挥发
酸,如盐酸。
二、浓硫酸
① 吸水性
用途:可以作干燥剂
浓硫酸吸收物质本来就有的水,直接与水分子结合;
2、 浓硫酸的特性
浓硫酸作干燥剂的注意点
(1)可干燥酸性气体(如CO2、SO2、Cl2等)和中性气体(如O2、N2、CO等)。
(2)不可干燥的气体:碱性气体(如NH3)和某些还原性气体(如HBr、HI、H2S等)。
浓H2SO4能将有机物中的H、O两元素以H2O的形式脱去,具有强脱水性。
C12H22O11 12C + 11H2O
浓硫酸
②脱水性
学会比较
浓硫酸的吸水性和脱水性有什么区别?
吸水性是指浓硫酸直接与水分子结合。
脱水性是指浓硫酸将许多有机物中的氢、氧元素按水的比例脱去。
吸收现成的水(有水则吸)
无中生有,反应生成水(无水则脱)
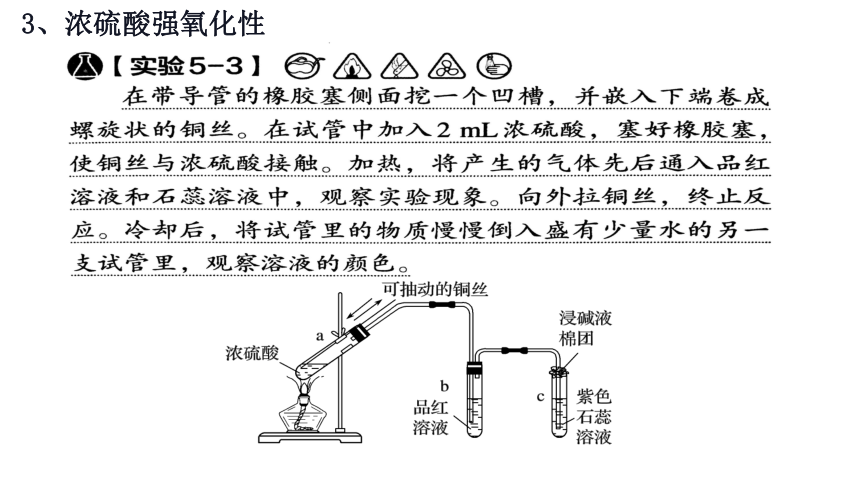
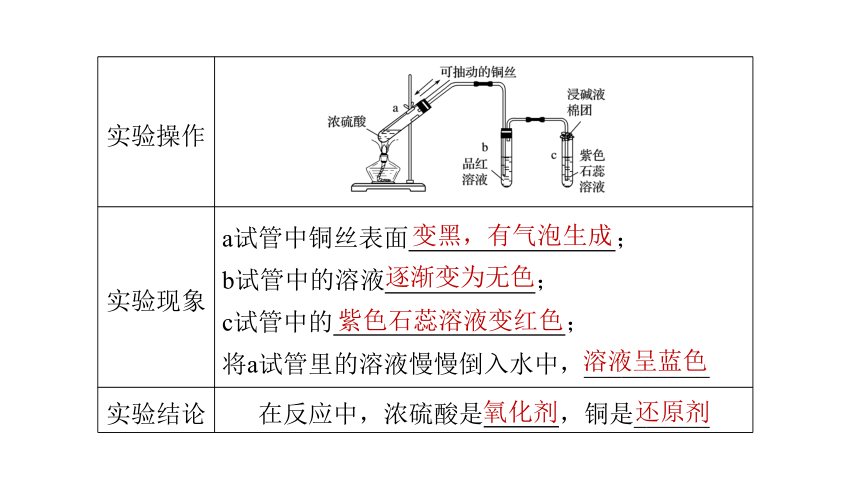
3、浓硫酸强氧化性
实验操作
?
实验现象
a试管中铜丝表面 ;
b试管中的溶液 ;
c试管中的 ;
将a试管里的溶液慢慢倒入水中,__________
实验结论
在反应中,浓硫酸是 ,铜是______
变黑,有气泡生成
逐渐变为无色
紫色石蕊溶液变红色
溶液呈蓝色
氧化剂
还原剂
强氧化性表现
HBr、HI、H2S等
钝化
致密
氧化膜
4、硫酸的用途
化肥、医药、农药的生产,金属矿石的处理,金属材料的表面清洗等。
5、几种常见的硫酸盐
硫酸盐
主要性质
主要应用
硫酸钙
CaSO4·2H2O 2CaSO4·H2O
生石膏 熟石膏
制作模型和医用石膏绷带,调节水泥的硬化速率
硫酸铜
CuSO4 CuSO4·5H2O(胆矾)
白色 蓝色
检验水的存在,与石灰乳混合制备波尔多液
硫酸钡
又称重晶石,不溶于水和酸,且不易被X射线透过
用作消化系统X射线检查的内服药剂,即“钡餐”
6、硫酸的工业制法
(1)三种原料:硫黄或 、 ,98.3%的浓硫酸(代替水)。
(2)三个阶段
①二氧化硫的制取和净化。(造气阶段)
②SO2氧化成SO3。(接触氧化阶段)
③三氧化硫的吸收和硫酸的生成。(生成阶段)
黄铁矿(FeS2 )
空气
(3)三个反应
①_____________________________________________;
②______________________;
③___________________。
注意 工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生酸雾,影响SO3的吸收。
SO3+H2O===H2SO4
实验操作
?
?
?
实验现象
先 ,加入盐酸后______
____
先 ,加入盐酸后__________
先_____________,加入盐酸后_______________
_________
三、硫酸根离子的检验
1.硫酸根离子检验的实验探究
生成白色沉淀
沉淀不
溶解
生成白色沉淀
沉淀不溶解
生成白色沉淀
沉淀溶解,且有
气泡产生
实验结论
与Ba2+反应生成不溶于盐酸的_________,
离子方程式:____________________
与Ba2+反应生成的白色沉淀BaCO3,可溶于盐酸
白色沉淀
+Ba2+===BaSO4↓
白色
(2)理论解释
①先加稀盐酸的目的是排除_____、_____、_____等离子干扰。
②再加入BaCl2溶液,若存在 ,发生反应的离子方程式为__________
____________。
Ag+
===BaSO4↓
2、检验硫酸根的正确操作及解释
(1)若除去粗盐中杂质(硫酸盐、CaCl2、MgCl2),将选用的试剂及反应的离子方程式填入下表:
杂质
加入的试剂
离子方程式
硫酸盐
__________
_____________________
CaCl2
__________
_____________________
MgCl2
_________
___________________________
氯化钡溶液
碳酸钠溶液
烧碱溶液
Mg2++2OH-===Mg(OH)2↓
3、硫酸根检验的应用--粗盐提纯
(2)试剂加入的顺序
为使杂质离子完全除去,通常加入试剂及顺序有如下三种:
①BaCl2溶液→NaOH溶液→ →盐酸;
②NaOH溶液→BaCl2溶液→ →盐酸;
③ → → →盐酸。
总结:为保障杂质离子完全除去,只要 在 之后加入即可。
Na2CO3溶液
Na2CO3溶液
BaCl2溶液
Na2CO3溶液
NaOH溶液
碳酸钠溶液
氯化钡溶液
1.下列有关说法中正确的是( )
A.浓硫酸在常温下能够使铁、铝等金属钝化,因此浓硫酸在常温下不能
与铁、铝发生反应
B.白纸上滴加浓硫酸后变黑体现了浓硫酸的吸水性
C.浓硫酸主要以H2SO4分子存在
D.稀硫酸和浓硫酸性质完全相同
C
随堂演练
2.浓硫酸与下列物质作用时,既表现氧化性,又表现酸性的是( )
①炽热的木炭 ②H2S气体 ③Cu(加热条件下) ④FeO ⑤NH3 ⑥蔗糖 ⑦CuSO4·5H2O ⑧铁、铝(常温下)
A.③④ B.①②⑤⑧ C.①②③④⑦ D.⑥⑦
c
3.全部可用浓硫酸干燥的一组气体是( )
A.CH4、H2、CO、NH3
B.CO2、H2、SO2、Cl2
C.CO、CH4、HCl、HBr
D.SO2、CO2、H2、H2S
c
3.(2020·兰州二中月考)全部可用浓硫酸干燥的一组气体是
A.CH4、H2、CO、NH3
B.CO2、H2、SO2、Cl2
C.CO、CH4、HCl、HBr
D.SO2、CO2、H2、H2S
√
1
2
3
5
4
解析 浓硫酸既具有酸性,又具有强氧化性。故不能用来干燥碱性气体(NH3)和强还原性气体(HBr、HI、H2S等),B项正确。
第2课时 硫酸和硫酸根的检验
一、稀硫酸
(1)使指示剂变色:
(2)与活泼金属反应放出氢气 (硝酸除外)
(3)与碱发生中和反应:
(4)与碱性氧化物反应:
(5)与某些盐反应:
使紫色石蕊试液变红
H++ OH -= H2O
2H++ CuO = Cu2++ H2O
2H++ CO32- = H2O + CO2↑
1、稀硫酸具有酸的通性
H2SO4=2H++SO42-
稀硫酸
完全电离
H2SO4=2H++SO42-
酸的通性
浓度增大
浓硫酸
以分子
形式存在
H2SO4
自身特性
1、浓H2SO4的物理性质
色态:无色、粘稠的油状液体
沸点:约338℃——难挥发酸(高沸点酸)
密度:1.84g/cm3——高密度酸
溶解性:跟水任意比互溶,溶解放出大量热
[思考] 浓硫酸应如何稀释?
用于制易挥发
酸,如盐酸。
二、浓硫酸
① 吸水性
用途:可以作干燥剂
浓硫酸吸收物质本来就有的水,直接与水分子结合;
2、 浓硫酸的特性
浓硫酸作干燥剂的注意点
(1)可干燥酸性气体(如CO2、SO2、Cl2等)和中性气体(如O2、N2、CO等)。
(2)不可干燥的气体:碱性气体(如NH3)和某些还原性气体(如HBr、HI、H2S等)。
浓H2SO4能将有机物中的H、O两元素以H2O的形式脱去,具有强脱水性。
C12H22O11 12C + 11H2O
浓硫酸
②脱水性
学会比较
浓硫酸的吸水性和脱水性有什么区别?
吸水性是指浓硫酸直接与水分子结合。
脱水性是指浓硫酸将许多有机物中的氢、氧元素按水的比例脱去。
吸收现成的水(有水则吸)
无中生有,反应生成水(无水则脱)
3、浓硫酸强氧化性
实验操作
?
实验现象
a试管中铜丝表面 ;
b试管中的溶液 ;
c试管中的 ;
将a试管里的溶液慢慢倒入水中,__________
实验结论
在反应中,浓硫酸是 ,铜是______
变黑,有气泡生成
逐渐变为无色
紫色石蕊溶液变红色
溶液呈蓝色
氧化剂
还原剂
强氧化性表现
HBr、HI、H2S等
钝化
致密
氧化膜
4、硫酸的用途
化肥、医药、农药的生产,金属矿石的处理,金属材料的表面清洗等。
5、几种常见的硫酸盐
硫酸盐
主要性质
主要应用
硫酸钙
CaSO4·2H2O 2CaSO4·H2O
生石膏 熟石膏
制作模型和医用石膏绷带,调节水泥的硬化速率
硫酸铜
CuSO4 CuSO4·5H2O(胆矾)
白色 蓝色
检验水的存在,与石灰乳混合制备波尔多液
硫酸钡
又称重晶石,不溶于水和酸,且不易被X射线透过
用作消化系统X射线检查的内服药剂,即“钡餐”
6、硫酸的工业制法
(1)三种原料:硫黄或 、 ,98.3%的浓硫酸(代替水)。
(2)三个阶段
①二氧化硫的制取和净化。(造气阶段)
②SO2氧化成SO3。(接触氧化阶段)
③三氧化硫的吸收和硫酸的生成。(生成阶段)
黄铁矿(FeS2 )
空气
(3)三个反应
①_____________________________________________;
②______________________;
③___________________。
注意 工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生酸雾,影响SO3的吸收。
SO3+H2O===H2SO4
实验操作
?
?
?
实验现象
先 ,加入盐酸后______
____
先 ,加入盐酸后__________
先_____________,加入盐酸后_______________
_________
三、硫酸根离子的检验
1.硫酸根离子检验的实验探究
生成白色沉淀
沉淀不
溶解
生成白色沉淀
沉淀不溶解
生成白色沉淀
沉淀溶解,且有
气泡产生
实验结论
与Ba2+反应生成不溶于盐酸的_________,
离子方程式:____________________
与Ba2+反应生成的白色沉淀BaCO3,可溶于盐酸
白色沉淀
+Ba2+===BaSO4↓
白色
(2)理论解释
①先加稀盐酸的目的是排除_____、_____、_____等离子干扰。
②再加入BaCl2溶液,若存在 ,发生反应的离子方程式为__________
____________。
Ag+
===BaSO4↓
2、检验硫酸根的正确操作及解释
(1)若除去粗盐中杂质(硫酸盐、CaCl2、MgCl2),将选用的试剂及反应的离子方程式填入下表:
杂质
加入的试剂
离子方程式
硫酸盐
__________
_____________________
CaCl2
__________
_____________________
MgCl2
_________
___________________________
氯化钡溶液
碳酸钠溶液
烧碱溶液
Mg2++2OH-===Mg(OH)2↓
3、硫酸根检验的应用--粗盐提纯
(2)试剂加入的顺序
为使杂质离子完全除去,通常加入试剂及顺序有如下三种:
①BaCl2溶液→NaOH溶液→ →盐酸;
②NaOH溶液→BaCl2溶液→ →盐酸;
③ → → →盐酸。
总结:为保障杂质离子完全除去,只要 在 之后加入即可。
Na2CO3溶液
Na2CO3溶液
BaCl2溶液
Na2CO3溶液
NaOH溶液
碳酸钠溶液
氯化钡溶液
1.下列有关说法中正确的是( )
A.浓硫酸在常温下能够使铁、铝等金属钝化,因此浓硫酸在常温下不能
与铁、铝发生反应
B.白纸上滴加浓硫酸后变黑体现了浓硫酸的吸水性
C.浓硫酸主要以H2SO4分子存在
D.稀硫酸和浓硫酸性质完全相同
C
随堂演练
2.浓硫酸与下列物质作用时,既表现氧化性,又表现酸性的是( )
①炽热的木炭 ②H2S气体 ③Cu(加热条件下) ④FeO ⑤NH3 ⑥蔗糖 ⑦CuSO4·5H2O ⑧铁、铝(常温下)
A.③④ B.①②⑤⑧ C.①②③④⑦ D.⑥⑦
c
3.全部可用浓硫酸干燥的一组气体是( )
A.CH4、H2、CO、NH3
B.CO2、H2、SO2、Cl2
C.CO、CH4、HCl、HBr
D.SO2、CO2、H2、H2S
c
3.(2020·兰州二中月考)全部可用浓硫酸干燥的一组气体是
A.CH4、H2、CO、NH3
B.CO2、H2、SO2、Cl2
C.CO、CH4、HCl、HBr
D.SO2、CO2、H2、H2S
√
1
2
3
5
4
解析 浓硫酸既具有酸性,又具有强氧化性。故不能用来干燥碱性气体(NH3)和强还原性气体(HBr、HI、H2S等),B项正确。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
