【新教材】2020-2021学年人教版(2019)高一化学必修二5.1 硫及其化合物 课时2 硫酸 硫酸根离子的检验 课件(共49张ppt)
文档属性
| 名称 | 【新教材】2020-2021学年人教版(2019)高一化学必修二5.1 硫及其化合物 课时2 硫酸 硫酸根离子的检验 课件(共49张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 890.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-07 19:52:08 | ||
图片预览








文档简介
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
课时2 硫酸 硫酸根离子的检验
学习任务一 硫酸
任务探究·深度学习
旧知回顾
自主学习
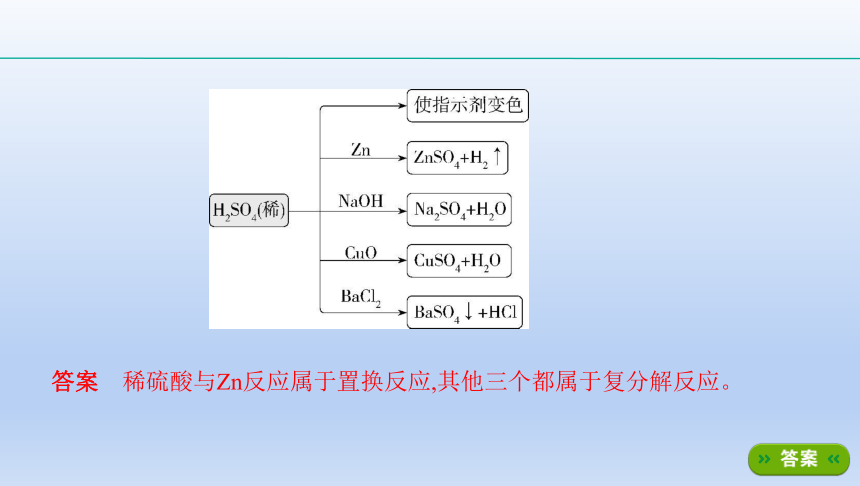
初中学习过硫酸具有酸的通性。下图以稀硫酸为例表示了酸的通性,请你指
出有关稀硫酸的四个反应的反应类型。
?
答案 稀硫酸与Zn反应属于置换反应,其他三个都属于复分解反应。
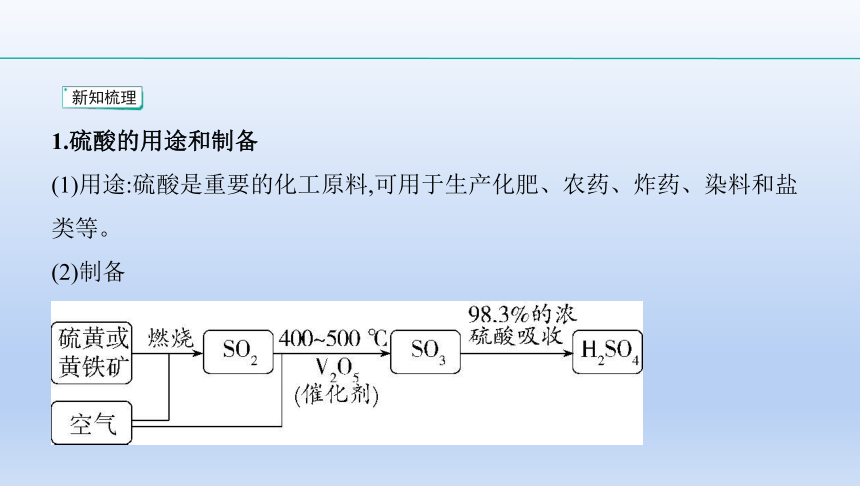
1.硫酸的用途和制备
(1)用途:硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐
类等。
(2)制备
?
新知梳理
2.浓硫酸的特性
(1)吸水性:浓硫酸能吸收存在于周围环境中的① ????,以及混在气体中的水
分子,故常用作干燥剂。
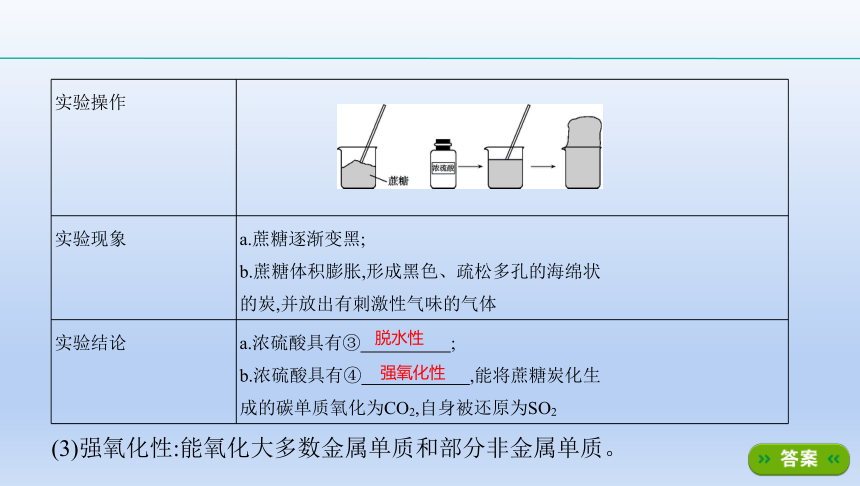
(2)脱水性:浓硫酸能将蔗糖、纸张、棉布和木材等有机物中的氢元素和氧元
素按② ????的组成比脱去。下表为浓硫酸与蔗糖反应的实验操作、实验现
象及实验结论。
水分
水
实验操作
?
实验现象
a.蔗糖逐渐变黑;
b.蔗糖体积膨胀,形成黑色、疏松多孔的海绵状
的炭,并放出有刺激性气味的气体
实验结论
a.浓硫酸具有③ ????;
b.浓硫酸具有④ ????,能将蔗糖炭化生
成的碳单质氧化为CO2,自身被还原为SO2
脱水性
强氧化性
(3)强氧化性:能氧化大多数金属单质和部分非金属单质。
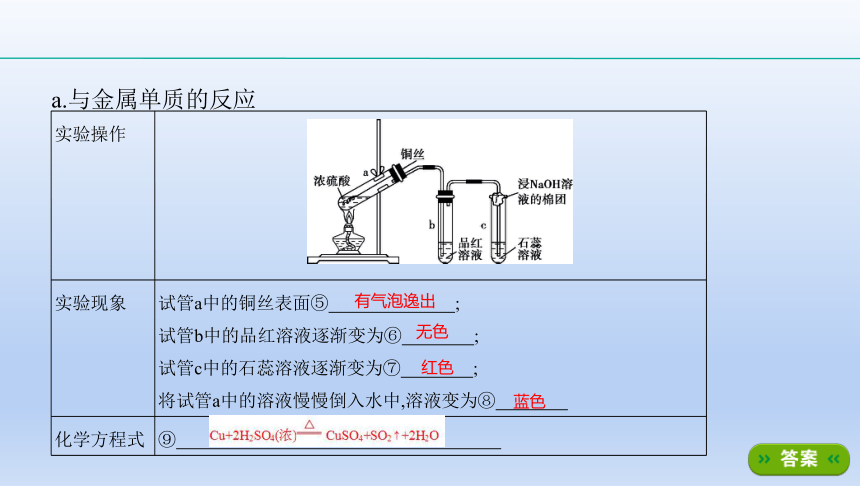
a.与金属单质的反应
实验操作
?
实验现象
试管a中的铜丝表面⑤ ????;
试管b中的品红溶液逐渐变为⑥ ????;
试管c中的石蕊溶液逐渐变为⑦ ????;
将试管a中的溶液慢慢倒入水中,溶液变为⑧ ???? ????
化学方程式
⑨ ????
有气泡逸出
无色
红色
蓝色
b.与非金属单质的反应
在加热时,浓硫酸与木炭发生反应:⑩ ??????。
判断下列说法的正误(正确的画“√”,错误的画“?”)。
易错辨析
1.浓硫酸可用于干燥H2和CO2?( )
2.稀硫酸没有氧化性,一般不能发生氧化还原反应?( )
3.稀释浓硫酸,应将水倒入浓硫酸中并及时搅拌?( )
4.纸张、棉布、木材等遇到浓硫酸会炭化,体现了浓硫酸具有吸水性?( )
5.常温下,铜片能溶于浓硫酸?( )
√
?
?
?
?
1.胆矾也称蓝矾,其化学式为CuSO4·5H2O,常温下为蓝色固体。取少量胆矾于
烧杯中,滴加浓硫酸,发现蓝色固体变成白色,该过程是否属于化学变化?体现
了浓硫酸的什么性质?
互动探究
答案 蓝色固体变成白色,说明胆矾失去结晶水,该过程是化学变化,体现了浓
硫酸的吸水性。
2.将1 mol铜箔加入盛有含2 mol H2SO4的浓硫酸的试管中加热。
(1)上述铜箔能否完全溶解?请解释原因。该实验体现了浓硫酸的哪些性质?
(2)如果将上面的1 mol铜箔改为1 mol锌片,锌片能否完全溶解?请解释原因。
答案 (1)不能。因为随着反应的进行,浓硫酸变为稀硫酸,反应停止,所以铜箔
不能完全溶解,铜和浓硫酸的反应体现了浓硫酸的强氧化性和酸性。(2)能。
锌能与稀硫酸继续反应。
1.浓硫酸的吸水性和脱水性的区别
?
由此看出:二者的根本区别在于物质本身是否存在水分子。
提炼归纳
2.浓硫酸的反应规律
(1)与活泼金属(如Zn)反应:开始产生SO2,硫酸浓度变小后,产生H2。
(2)与某些不活泼金属(如Cu)反应:开始产生SO2(加热),硫酸浓度变小后,稀硫酸
不再与Cu反应。如1 mol Cu与含2 mol H2SO4的浓硫酸充分反应,生成SO2的物
质的量应小于1 mol。
(3)浓硫酸在与金属的反应中既表现强氧化性(生成SO2)又表现酸性(生成硫酸
盐);浓硫酸在与非金属的反应中只表现强氧化性(如浓硫酸与碳的反应)。
1.在如下图所示的实验中,实验开始一段时间后,对观察到的现象叙述错误的
是?( )
A.苹果块会干瘪
典题精练
B.胆矾表面有“白斑”
C.小试管内有晶体析出
D.pH试纸变红
解析???? D项,pH试纸在浓硫酸中先变红后变黑,因为浓硫酸具有酸性和脱
水性,它能使pH试纸先变红然后炭化变黑。
D
2.下列关于浓硫酸与Cu反应的叙述正确的是?( )
A.在反应中,浓硫酸只表现出强氧化性
B.该反应中还原剂与氧化剂的物质的量之比为1∶2
C.在反应中,浓硫酸既表现出强氧化性,又表现出酸性
D.每1 mol Cu参加反应就有2 mol H2SO4被还原,同时生成2 mol SO2
解析???? 题述反应的化学方程式为Cu+2H2SO4(浓)? CuSO4+SO2↑+2H2O,
分析反应前后元素化合价的变化可知,浓硫酸既表现出强氧化性,又表现出酸
性;该反应为氧化还原反应,在反应中,每2 mol H2SO4参加反应只有1 mol H2SO4
被还原,因此还原剂与氧化剂的物质的量之比为1∶1。
C
3.浓硫酸具有:①难挥发性(高沸点);②酸性;③强氧化性;④吸水性;⑤脱水性。
下列各项分别表现了浓硫酸的什么性质,请将序号填于空白处:
(1)浓硫酸与食盐共热,浓硫酸表现的性质是 ????。
(2)浓硫酸与铜共热,反应的化学方程式为 ????,浓
硫酸表现的性质是 ????。
(3)浓硫酸与红热木炭反应,反应的化学方程式为 ????,
浓硫酸表现的性质是 ????。
(4)可用浓硫酸干燥H2、CO2、HCl等气体,浓硫酸表现的性质是 ????。
(5)向蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,浓
硫酸表现的性质是 ????。
①②?
Cu+2H2SO4(浓)? CuSO4+SO2↑+2H2O
②③
C+2H2SO4(浓)? CO2↑+2SO2↑+2H2O
③
④
③⑤
解析 (1)浓硫酸与食盐共热,生成氯化氢气体,浓硫酸表现了酸性和难挥发
性。(2)浓硫酸与铜共热生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+
2H2SO4(浓)? CuSO4+SO2↑+2H2O,体现了浓硫酸的强氧化性和酸性。(3)浓
硫酸与红热木炭反应生成二氧化碳、二氧化硫和水,反应的化学方程式为C+2
H2SO4(浓)? CO2↑+2SO2↑+2H2O,体现了浓硫酸的强氧化性。(4)利用浓硫
酸的吸水性干燥气体。(5)向蔗糖中倒入浓硫酸,浓硫酸先按水的组成比脱去
蔗糖中的H、O元素,使蔗糖炭化,产生大量的热,再与碳单质反应生成二氧化
碳、二氧化硫和水,浓硫酸表现了脱水性和强氧化性。
4.如图为浓硫酸与铜片反应的装置。
?
请回答:
(1)浓硫酸与铜片反应的化学方程式为 ???????。
Cu+2H2SO4(浓)? CuSO4+SO2↑+2H2O
(2)反应一段时间后,试管乙中品红溶液的变化是 ????。
(3)下列有关该实验的说法中,不正确的是 ????。
A.该反应中浓硫酸只体现酸性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯里,溶液显蓝色
D.含0.04 mol溶质的浓硫酸与足量的铜片反应,能收集到448 mL的SO2(标准状
况)
褪色或红色变浅???
AD
解析 (2)二氧化硫具有漂白性,能使品红溶液褪色,则反应一段时间后,试管乙
中品红溶液的变化是褪色或红色变浅。(3)因为有硫酸铜和二氧化硫生成,所
以该反应中浓硫酸体现酸性和强氧化性,A错误;因为随着反应的进行浓硫酸
变为稀硫酸,稀硫酸与铜不反应,所以含0.04 mol溶质的浓硫酸与足量的铜片反
应,不能收集到448 mL的SO2(标准状况),D错误。
学习任务二 硫酸根离子的检验
旧知回顾
自主学习
如图是检验待测液中氯离子的实验过程,请说明可能的实验现象及结论。
?
答案 滴加足量的硝酸酸化后,再加入硝酸银溶液,如果出现白色沉淀,说明溶
液中含有氯离子,如果没有出现白色沉淀,说明溶液中不含有氯离子。
硫酸根离子的检验
新知梳理
1.实验探究
在三支试管中分别加入少量稀硫酸、Na2SO4溶液和Na2CO3溶液,然后各滴入
几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。
项目
稀硫酸
Na2SO4溶液
Na2CO3溶液
滴入几滴BaCl2溶液
有① ????生成
有② ????生成
有③ ????生
成
加入少量稀盐酸并振荡
④ ????????
⑤ ????????
⑥ ????
白色沉淀
白色沉淀
白色沉淀
白色沉淀不溶解
白色沉淀不溶解
白色沉淀溶解
2.实验结论
在溶液中,S?可与Ba2+反应,生成不溶于稀盐酸的白色BaSO4沉淀。反应的离
子方程式为Ba2++S?? BaSO4↓。
3.稀盐酸酸化的作用
用可溶性钡盐检验S?时,C?等可能会对检验造成干扰,通常将溶液先用稀
盐酸酸化,以排除C?等可能造成的干扰,然后加入BaCl2溶液来检验S?的存在。
4.实践应用
除去粗盐中的可溶性杂质(可溶性硫酸盐及CaCl2、MgCl2等杂质)
杂质
加入的试剂
离子方程式
可溶性硫酸盐
过量⑦ ????溶液
⑧ ???????
CaCl2
过量⑨ ????溶液
⑩ ????
????
MgCl2
过量? ????溶液
? ??????
多余的NaOH、Na2CO3
适量? ???
? ????
???? ???????? ????
稀盐酸
判断下列说法的正误(正确的画“√”,错误的画“?”)。
易错辨析
1.向某溶液中加入氯化钡溶液,若有白色沉淀生成,则溶液中一定含有S??
( )
2.能与Ba2+反应产生沉淀的只有S??( )
3.粗盐提纯实验中,最后加入适量稀盐酸的作用是除去多余的OH-和C?(???? )
4.要除去氯化钠溶液中含有的少量氯化镁,可加入适量的氢氧化钠溶液后过滤
?( )
?
?
√
√
1.某同学设计了如下实验来检验某试液中是否含有S?,流程如下:
试液? 白色沉淀? 白色沉淀不溶解
结论是试液中含有S?。该方案是否严密?请说明理由。
互动探究
答案 不严密。因为试液中可能含有Ag+而不含S?,先加入BaCl2溶液,Ag+与
Cl-反应生成的AgCl也是不溶于稀盐酸的白色沉淀。
2.硫酸根离子的检验中,先加入稀盐酸的目的是什么?请结合对应的离子方程
式说明。
答案 先加入稀盐酸的目的是排除C?、S?、Ag+等的干扰。若存在上述
离子,则整个过程中可能发生反应的离子方程式为C?+2H+? CO2↑+H2O、
S?+2H+? SO2↑+H2O、Ag++Cl-? AgCl↓等。
3.粗盐中除含有不溶性的泥沙外,还含有可溶性的CaCl2、MgCl2、硫酸钠等,我
们可以通过分离、提纯等方法制取纯净的氯化钠。
?
(1)请你分析怎样除去粗盐中不溶性的泥沙?
(2)实验过程中为了将可溶性杂质除净,应该怎样操作?这样操作有什么弊端?
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
(4)在粗盐的提纯实验中,为何氯化钡溶液要在碳酸钠溶液之前加入?加入碳酸
钠溶液的目的是什么?
答案 (1)经过溶解、过滤和蒸发可以将不溶性的泥沙除去。
(2)为了将可溶性杂质除净,除杂试剂应稍过量,这样才能将杂质离子全部除去,
但过量的除杂试剂又成为新杂质。
(3)应合理安排除杂试剂的加入顺序,同时保证加入的过量除杂试剂在后续操
作中能够被除去。
(4)加入碳酸钠溶液的目的是除去钙离子,同时还要除去加入的过量氯化钡,所
以氯化钡溶液要在碳酸钠溶液之前加入。
1.S?的检验
(1)原理与试剂
利用Ba2++S?? BaSO4↓(白色),BaSO4具有不溶于盐酸、硝酸的性质。
试剂:稀盐酸和BaCl2溶液。
(2)操作及现象
待测液? 无白色沉淀? 观察是否有白色沉淀
生成
若无白色沉淀生成,说明不含有S?,若有白色沉淀生成,说明含有S?。
提炼归纳
(3)检验的关键:既要注意试剂的选择,又要注意操作顺序,不能颠倒。先加稀盐
酸的目的是排除C?、S?、Ag+等的干扰,无白色沉淀,再加BaCl2溶液,产生
白色沉淀,才能证明存在S?。
2.粗盐中可溶性杂质的提纯
(1)常用试剂的加入顺序
?
为使杂质离子完全除去,要加入过量的试剂,后续加入的试剂要能够将前面所加过量的试剂除去,由此可知,Na2CO3溶液要在BaCl2溶液之后加入,通常加入试
剂的几种顺序为①BaCl2溶液→NaOH溶液→Na2CO3溶液→盐酸;②NaOH溶液
→BaCl2溶液→Na2CO3溶液→盐酸;③BaCl2溶液→Na2CO3溶液→NaOH溶液→
盐酸。
(2)注意:应过滤后再加入盐酸,除去过量的Na2CO3和NaOH。
3.分离、提纯的“三必须”“四原则”
(1)“三必须”
①除杂试剂必须稍过量。
②过量试剂必须除尽,且容易除去。
③除杂途径选最佳,有多种杂质时除杂顺序必须合理。
?
(2)“四原则”
1.检验某溶液中是否含有S?,常用的方法是?( )
A.取样,滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
B.取样,滴加稀盐酸酸化的BaCl2溶液,看是否有不溶于水的白色沉淀生成
C.取样,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,看是否有不溶于水的白色
沉淀生成
D.取样,滴加稀硫酸,再滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
典题精练
解析???? 检验S?时,需要首先加入稀盐酸以排除C?、S?、Ag+等的干
扰,然后加入BaCl2溶液。A项中不能排除C?和Ag+等的干扰,B项中不能排除
Ag+的干扰,D项中引入S?。
C
2.为了除去粗盐中的Ca2+、Mg2+、S?和泥沙,可先将粗盐溶于水,然后进行下
列五项操作:①过滤 ②加过量NaOH溶液????③加适量盐酸 ④加过量Na2CO3
溶液 ⑤加过量BaCl2溶液,正确的操作顺序是?( )
A.①④②⑤③ B.④①②⑤③ C.②④⑤①③ D.⑤②④①③
解析???? 首先要明确除去粗盐中的Ca2+、Mg2+、S?,可分别加入Na2CO3溶
液、NaOH溶液、BaCl2溶液,且三种溶液均过量,才能使杂质离子分别变成
CaCO3、Mg(OH)2、BaSO4沉淀;而过量的BaCl2溶液只能用Na2CO3溶液除去,故
要先加入BaCl2溶液,再加入Na2CO3溶液,才能保证将过量的BaCl2一并除去;而
剩余的NaOH和Na2CO3只需要在过滤后再加入适量盐酸即可被除去,故D正确。
D
3.为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下方案进行实验。
?
(1)沉淀A的化学式为 ????。
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作是 ????。
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,所以固体
物质B的成分为 ????(用化学式表示)。
(4)他们又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气泡为止,然后
加热煮沸。有关反应的化学方程式为 ????。
CaCO3
过滤
NaCl、CaCl2
Na2CO3+2HCl? 2NaCl+H2O+CO2↑
解析 若用过量CaCl2溶液除去Na2CO3,会引入新杂质CaCl2,蒸发后所得固体
物质B应是NaCl和CaCl2的混合物;应用盐酸除去Na2CO3,则溶液中会留下NaCl
和HCl,蒸发结晶可得较纯净的NaCl(HCl挥发)。
1.浓硫酸和2 mol·L-1的稀硫酸,在实验室中敞口放置。它们的质量和放置天数
的关系如图所示。分析a、b曲线变化的原因是?( )
A.a升华、b冷凝
B.a蒸发、b吸水
C.a挥发、b潮解
D.a冷凝、b吸水
评价检测·课堂达标
解析???? 浓硫酸具有吸水性,能够吸收空气中的水蒸气,溶剂增加,溶液的质
量增大;稀硫酸中的水分会蒸发,溶剂减少,溶液的质量减小。
B
2.下列离子的检验方法正确的是?( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
B.某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有S?
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+
D.某溶液中加稀硫酸产生无色气体,将该气体通入澄清石灰水中生成白色沉
淀,说明原溶液中有C?
C
解析???? 与硝酸银溶液反应生成白色沉淀的离子有Cl-、S?等;与BaCl2溶
液反应生成白色沉淀的离子有S?、Ag+等;与NaOH溶液反应生成蓝色沉淀
的离子只有Cu2+;与稀硫酸反应产生能使澄清石灰水变浑浊的无色气体的离子
有C?、HC?、S?、HS?。
3.锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体
33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中氢离子浓度为
0.1 mol·L-1。下列叙述不正确的是?( )
A.反应中共消耗1.8 mol H2SO4
B.生成的气体中SO2与H2的体积比为4∶1
C.反应中共消耗97.5 g Zn
D.反应中共转移3 mol电子
B
解析???? 生成气体的物质的量为?=1.5 mol,溶液剩余硫酸的物质
的量为?×1 L×0.1 mol·L-1=0.05 mol,参加反应的硫酸的物质的量为0.1 L×18.5
mol·L-1-0.05 mol=1.8 mol,随着反应的进行,硫酸的浓度逐渐减小,设反应生成x
mol SO2,y mol H2。
Zn + 2H2SO4(浓)? ZnSO4+SO2↑+2H2O
x mol 2x mol ??? ?x mol
y mol ????y mol ?? ??y mol
x mol+y mol=1.5 mol,2x mol+y mol=1.8 mol,解得x=0.3,y=1.2。由上述分析可
知,A正确;生成的气体中V(SO2)∶V(H2)=1∶4,B错误;反应中共消耗Zn的质量
为(0.3 mol+1.2 mol)×65 g·mol-1=97.5 g,C正确;在Zn和H2SO4(浓)的反应中,生成
0.3 mol SO2转移电子为0.6 mol,在Zn和H2SO4(稀)的反应中,生成1.2 mol H2转移
电子为2.4 mol,所以反应中共转移3 mol电子,D正确。
Zn +H2SO4(稀)? ZnSO4+H2↑
4.在化学课上围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入
烧杯中,加入少量水,搅拌均匀,然后加入浓硫酸,快速搅拌,生成疏松多孔的黑
色物质。
?
请回答下列问题:
(1)根据上述实验步骤①~⑤中,蔗糖与浓硫酸反应的实验现象,浓硫酸表现出
的化学性质有 ????(填字母)。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(2)反应中生成的黑色物质继续与浓硫酸作用,产生两种气体,其中一种气体X
有刺激性气味,另一种气体Y无色无味,写出反应的化学方程式:
???? ????。
BCD????
C+2H2SO4(浓)? CO2↑+2SO2↑+2H2O
(3)为了检验出混合气体中的X、Y这两种气体,提供下列试剂(试剂可多次使
用,不考虑尾气处理):
A.品红溶液 ????
B.澄清石灰水
C.酸性高锰酸钾溶液 ????
D.氢氧化钠溶液
混合气体通过的顺序依次是 ????→ ????→ ????→ ????(填
字母)。证明有气体Y存在的实验现象为 ???。
A
C
A
B
第二个品红溶液不褪色,澄清石灰水变浑浊
解析 (1)将适量的蔗糖放入烧杯中,加入少量水,搅拌均匀,然后加入浓硫酸,
生成黑色物质,体现了浓硫酸的脱水性;浓硫酸吸收水,放出大量的热,碳与浓硫
酸在加热的条件下反应,生成两种气体,体现了浓硫酸的吸水性和强氧化性。
(3)先将混合气体通入品红溶液检验二氧化硫,品红溶液褪色,说明含有二氧化
硫,之后将从品红溶液中出来的气体通入酸性高锰酸钾溶液,酸性高锰酸钾溶
液褪色,这一步是为了除去二氧化硫,将从酸性高锰酸钾溶液中出来的气体再
通入品红溶液,品红溶液不褪色,证明二氧化硫被除尽,最后通入澄清石灰水,若
有白色沉淀生成,则说明含有二氧化碳。故混合气体通过的顺序依次是A→C
→A→B。
第一节 硫及其化合物
课时2 硫酸 硫酸根离子的检验
学习任务一 硫酸
任务探究·深度学习
旧知回顾
自主学习
初中学习过硫酸具有酸的通性。下图以稀硫酸为例表示了酸的通性,请你指
出有关稀硫酸的四个反应的反应类型。
?
答案 稀硫酸与Zn反应属于置换反应,其他三个都属于复分解反应。
1.硫酸的用途和制备
(1)用途:硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐
类等。
(2)制备
?
新知梳理
2.浓硫酸的特性
(1)吸水性:浓硫酸能吸收存在于周围环境中的① ????,以及混在气体中的水
分子,故常用作干燥剂。
(2)脱水性:浓硫酸能将蔗糖、纸张、棉布和木材等有机物中的氢元素和氧元
素按② ????的组成比脱去。下表为浓硫酸与蔗糖反应的实验操作、实验现
象及实验结论。
水分
水
实验操作
?
实验现象
a.蔗糖逐渐变黑;
b.蔗糖体积膨胀,形成黑色、疏松多孔的海绵状
的炭,并放出有刺激性气味的气体
实验结论
a.浓硫酸具有③ ????;
b.浓硫酸具有④ ????,能将蔗糖炭化生
成的碳单质氧化为CO2,自身被还原为SO2
脱水性
强氧化性
(3)强氧化性:能氧化大多数金属单质和部分非金属单质。
a.与金属单质的反应
实验操作
?
实验现象
试管a中的铜丝表面⑤ ????;
试管b中的品红溶液逐渐变为⑥ ????;
试管c中的石蕊溶液逐渐变为⑦ ????;
将试管a中的溶液慢慢倒入水中,溶液变为⑧ ???? ????
化学方程式
⑨ ????
有气泡逸出
无色
红色
蓝色
b.与非金属单质的反应
在加热时,浓硫酸与木炭发生反应:⑩ ??????。
判断下列说法的正误(正确的画“√”,错误的画“?”)。
易错辨析
1.浓硫酸可用于干燥H2和CO2?( )
2.稀硫酸没有氧化性,一般不能发生氧化还原反应?( )
3.稀释浓硫酸,应将水倒入浓硫酸中并及时搅拌?( )
4.纸张、棉布、木材等遇到浓硫酸会炭化,体现了浓硫酸具有吸水性?( )
5.常温下,铜片能溶于浓硫酸?( )
√
?
?
?
?
1.胆矾也称蓝矾,其化学式为CuSO4·5H2O,常温下为蓝色固体。取少量胆矾于
烧杯中,滴加浓硫酸,发现蓝色固体变成白色,该过程是否属于化学变化?体现
了浓硫酸的什么性质?
互动探究
答案 蓝色固体变成白色,说明胆矾失去结晶水,该过程是化学变化,体现了浓
硫酸的吸水性。
2.将1 mol铜箔加入盛有含2 mol H2SO4的浓硫酸的试管中加热。
(1)上述铜箔能否完全溶解?请解释原因。该实验体现了浓硫酸的哪些性质?
(2)如果将上面的1 mol铜箔改为1 mol锌片,锌片能否完全溶解?请解释原因。
答案 (1)不能。因为随着反应的进行,浓硫酸变为稀硫酸,反应停止,所以铜箔
不能完全溶解,铜和浓硫酸的反应体现了浓硫酸的强氧化性和酸性。(2)能。
锌能与稀硫酸继续反应。
1.浓硫酸的吸水性和脱水性的区别
?
由此看出:二者的根本区别在于物质本身是否存在水分子。
提炼归纳
2.浓硫酸的反应规律
(1)与活泼金属(如Zn)反应:开始产生SO2,硫酸浓度变小后,产生H2。
(2)与某些不活泼金属(如Cu)反应:开始产生SO2(加热),硫酸浓度变小后,稀硫酸
不再与Cu反应。如1 mol Cu与含2 mol H2SO4的浓硫酸充分反应,生成SO2的物
质的量应小于1 mol。
(3)浓硫酸在与金属的反应中既表现强氧化性(生成SO2)又表现酸性(生成硫酸
盐);浓硫酸在与非金属的反应中只表现强氧化性(如浓硫酸与碳的反应)。
1.在如下图所示的实验中,实验开始一段时间后,对观察到的现象叙述错误的
是?( )
A.苹果块会干瘪
典题精练
B.胆矾表面有“白斑”
C.小试管内有晶体析出
D.pH试纸变红
解析???? D项,pH试纸在浓硫酸中先变红后变黑,因为浓硫酸具有酸性和脱
水性,它能使pH试纸先变红然后炭化变黑。
D
2.下列关于浓硫酸与Cu反应的叙述正确的是?( )
A.在反应中,浓硫酸只表现出强氧化性
B.该反应中还原剂与氧化剂的物质的量之比为1∶2
C.在反应中,浓硫酸既表现出强氧化性,又表现出酸性
D.每1 mol Cu参加反应就有2 mol H2SO4被还原,同时生成2 mol SO2
解析???? 题述反应的化学方程式为Cu+2H2SO4(浓)? CuSO4+SO2↑+2H2O,
分析反应前后元素化合价的变化可知,浓硫酸既表现出强氧化性,又表现出酸
性;该反应为氧化还原反应,在反应中,每2 mol H2SO4参加反应只有1 mol H2SO4
被还原,因此还原剂与氧化剂的物质的量之比为1∶1。
C
3.浓硫酸具有:①难挥发性(高沸点);②酸性;③强氧化性;④吸水性;⑤脱水性。
下列各项分别表现了浓硫酸的什么性质,请将序号填于空白处:
(1)浓硫酸与食盐共热,浓硫酸表现的性质是 ????。
(2)浓硫酸与铜共热,反应的化学方程式为 ????,浓
硫酸表现的性质是 ????。
(3)浓硫酸与红热木炭反应,反应的化学方程式为 ????,
浓硫酸表现的性质是 ????。
(4)可用浓硫酸干燥H2、CO2、HCl等气体,浓硫酸表现的性质是 ????。
(5)向蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,浓
硫酸表现的性质是 ????。
①②?
Cu+2H2SO4(浓)? CuSO4+SO2↑+2H2O
②③
C+2H2SO4(浓)? CO2↑+2SO2↑+2H2O
③
④
③⑤
解析 (1)浓硫酸与食盐共热,生成氯化氢气体,浓硫酸表现了酸性和难挥发
性。(2)浓硫酸与铜共热生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+
2H2SO4(浓)? CuSO4+SO2↑+2H2O,体现了浓硫酸的强氧化性和酸性。(3)浓
硫酸与红热木炭反应生成二氧化碳、二氧化硫和水,反应的化学方程式为C+2
H2SO4(浓)? CO2↑+2SO2↑+2H2O,体现了浓硫酸的强氧化性。(4)利用浓硫
酸的吸水性干燥气体。(5)向蔗糖中倒入浓硫酸,浓硫酸先按水的组成比脱去
蔗糖中的H、O元素,使蔗糖炭化,产生大量的热,再与碳单质反应生成二氧化
碳、二氧化硫和水,浓硫酸表现了脱水性和强氧化性。
4.如图为浓硫酸与铜片反应的装置。
?
请回答:
(1)浓硫酸与铜片反应的化学方程式为 ???????。
Cu+2H2SO4(浓)? CuSO4+SO2↑+2H2O
(2)反应一段时间后,试管乙中品红溶液的变化是 ????。
(3)下列有关该实验的说法中,不正确的是 ????。
A.该反应中浓硫酸只体现酸性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯里,溶液显蓝色
D.含0.04 mol溶质的浓硫酸与足量的铜片反应,能收集到448 mL的SO2(标准状
况)
褪色或红色变浅???
AD
解析 (2)二氧化硫具有漂白性,能使品红溶液褪色,则反应一段时间后,试管乙
中品红溶液的变化是褪色或红色变浅。(3)因为有硫酸铜和二氧化硫生成,所
以该反应中浓硫酸体现酸性和强氧化性,A错误;因为随着反应的进行浓硫酸
变为稀硫酸,稀硫酸与铜不反应,所以含0.04 mol溶质的浓硫酸与足量的铜片反
应,不能收集到448 mL的SO2(标准状况),D错误。
学习任务二 硫酸根离子的检验
旧知回顾
自主学习
如图是检验待测液中氯离子的实验过程,请说明可能的实验现象及结论。
?
答案 滴加足量的硝酸酸化后,再加入硝酸银溶液,如果出现白色沉淀,说明溶
液中含有氯离子,如果没有出现白色沉淀,说明溶液中不含有氯离子。
硫酸根离子的检验
新知梳理
1.实验探究
在三支试管中分别加入少量稀硫酸、Na2SO4溶液和Na2CO3溶液,然后各滴入
几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。
项目
稀硫酸
Na2SO4溶液
Na2CO3溶液
滴入几滴BaCl2溶液
有① ????生成
有② ????生成
有③ ????生
成
加入少量稀盐酸并振荡
④ ????????
⑤ ????????
⑥ ????
白色沉淀
白色沉淀
白色沉淀
白色沉淀不溶解
白色沉淀不溶解
白色沉淀溶解
2.实验结论
在溶液中,S?可与Ba2+反应,生成不溶于稀盐酸的白色BaSO4沉淀。反应的离
子方程式为Ba2++S?? BaSO4↓。
3.稀盐酸酸化的作用
用可溶性钡盐检验S?时,C?等可能会对检验造成干扰,通常将溶液先用稀
盐酸酸化,以排除C?等可能造成的干扰,然后加入BaCl2溶液来检验S?的存在。
4.实践应用
除去粗盐中的可溶性杂质(可溶性硫酸盐及CaCl2、MgCl2等杂质)
杂质
加入的试剂
离子方程式
可溶性硫酸盐
过量⑦ ????溶液
⑧ ???????
CaCl2
过量⑨ ????溶液
⑩ ????
????
MgCl2
过量? ????溶液
? ??????
多余的NaOH、Na2CO3
适量? ???
? ????
???? ???????? ????
稀盐酸
判断下列说法的正误(正确的画“√”,错误的画“?”)。
易错辨析
1.向某溶液中加入氯化钡溶液,若有白色沉淀生成,则溶液中一定含有S??
( )
2.能与Ba2+反应产生沉淀的只有S??( )
3.粗盐提纯实验中,最后加入适量稀盐酸的作用是除去多余的OH-和C?(???? )
4.要除去氯化钠溶液中含有的少量氯化镁,可加入适量的氢氧化钠溶液后过滤
?( )
?
?
√
√
1.某同学设计了如下实验来检验某试液中是否含有S?,流程如下:
试液? 白色沉淀? 白色沉淀不溶解
结论是试液中含有S?。该方案是否严密?请说明理由。
互动探究
答案 不严密。因为试液中可能含有Ag+而不含S?,先加入BaCl2溶液,Ag+与
Cl-反应生成的AgCl也是不溶于稀盐酸的白色沉淀。
2.硫酸根离子的检验中,先加入稀盐酸的目的是什么?请结合对应的离子方程
式说明。
答案 先加入稀盐酸的目的是排除C?、S?、Ag+等的干扰。若存在上述
离子,则整个过程中可能发生反应的离子方程式为C?+2H+? CO2↑+H2O、
S?+2H+? SO2↑+H2O、Ag++Cl-? AgCl↓等。
3.粗盐中除含有不溶性的泥沙外,还含有可溶性的CaCl2、MgCl2、硫酸钠等,我
们可以通过分离、提纯等方法制取纯净的氯化钠。
?
(1)请你分析怎样除去粗盐中不溶性的泥沙?
(2)实验过程中为了将可溶性杂质除净,应该怎样操作?这样操作有什么弊端?
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
(4)在粗盐的提纯实验中,为何氯化钡溶液要在碳酸钠溶液之前加入?加入碳酸
钠溶液的目的是什么?
答案 (1)经过溶解、过滤和蒸发可以将不溶性的泥沙除去。
(2)为了将可溶性杂质除净,除杂试剂应稍过量,这样才能将杂质离子全部除去,
但过量的除杂试剂又成为新杂质。
(3)应合理安排除杂试剂的加入顺序,同时保证加入的过量除杂试剂在后续操
作中能够被除去。
(4)加入碳酸钠溶液的目的是除去钙离子,同时还要除去加入的过量氯化钡,所
以氯化钡溶液要在碳酸钠溶液之前加入。
1.S?的检验
(1)原理与试剂
利用Ba2++S?? BaSO4↓(白色),BaSO4具有不溶于盐酸、硝酸的性质。
试剂:稀盐酸和BaCl2溶液。
(2)操作及现象
待测液? 无白色沉淀? 观察是否有白色沉淀
生成
若无白色沉淀生成,说明不含有S?,若有白色沉淀生成,说明含有S?。
提炼归纳
(3)检验的关键:既要注意试剂的选择,又要注意操作顺序,不能颠倒。先加稀盐
酸的目的是排除C?、S?、Ag+等的干扰,无白色沉淀,再加BaCl2溶液,产生
白色沉淀,才能证明存在S?。
2.粗盐中可溶性杂质的提纯
(1)常用试剂的加入顺序
?
为使杂质离子完全除去,要加入过量的试剂,后续加入的试剂要能够将前面所加过量的试剂除去,由此可知,Na2CO3溶液要在BaCl2溶液之后加入,通常加入试
剂的几种顺序为①BaCl2溶液→NaOH溶液→Na2CO3溶液→盐酸;②NaOH溶液
→BaCl2溶液→Na2CO3溶液→盐酸;③BaCl2溶液→Na2CO3溶液→NaOH溶液→
盐酸。
(2)注意:应过滤后再加入盐酸,除去过量的Na2CO3和NaOH。
3.分离、提纯的“三必须”“四原则”
(1)“三必须”
①除杂试剂必须稍过量。
②过量试剂必须除尽,且容易除去。
③除杂途径选最佳,有多种杂质时除杂顺序必须合理。
?
(2)“四原则”
1.检验某溶液中是否含有S?,常用的方法是?( )
A.取样,滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
B.取样,滴加稀盐酸酸化的BaCl2溶液,看是否有不溶于水的白色沉淀生成
C.取样,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,看是否有不溶于水的白色
沉淀生成
D.取样,滴加稀硫酸,再滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
典题精练
解析???? 检验S?时,需要首先加入稀盐酸以排除C?、S?、Ag+等的干
扰,然后加入BaCl2溶液。A项中不能排除C?和Ag+等的干扰,B项中不能排除
Ag+的干扰,D项中引入S?。
C
2.为了除去粗盐中的Ca2+、Mg2+、S?和泥沙,可先将粗盐溶于水,然后进行下
列五项操作:①过滤 ②加过量NaOH溶液????③加适量盐酸 ④加过量Na2CO3
溶液 ⑤加过量BaCl2溶液,正确的操作顺序是?( )
A.①④②⑤③ B.④①②⑤③ C.②④⑤①③ D.⑤②④①③
解析???? 首先要明确除去粗盐中的Ca2+、Mg2+、S?,可分别加入Na2CO3溶
液、NaOH溶液、BaCl2溶液,且三种溶液均过量,才能使杂质离子分别变成
CaCO3、Mg(OH)2、BaSO4沉淀;而过量的BaCl2溶液只能用Na2CO3溶液除去,故
要先加入BaCl2溶液,再加入Na2CO3溶液,才能保证将过量的BaCl2一并除去;而
剩余的NaOH和Na2CO3只需要在过滤后再加入适量盐酸即可被除去,故D正确。
D
3.为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下方案进行实验。
?
(1)沉淀A的化学式为 ????。
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作是 ????。
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,所以固体
物质B的成分为 ????(用化学式表示)。
(4)他们又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气泡为止,然后
加热煮沸。有关反应的化学方程式为 ????。
CaCO3
过滤
NaCl、CaCl2
Na2CO3+2HCl? 2NaCl+H2O+CO2↑
解析 若用过量CaCl2溶液除去Na2CO3,会引入新杂质CaCl2,蒸发后所得固体
物质B应是NaCl和CaCl2的混合物;应用盐酸除去Na2CO3,则溶液中会留下NaCl
和HCl,蒸发结晶可得较纯净的NaCl(HCl挥发)。
1.浓硫酸和2 mol·L-1的稀硫酸,在实验室中敞口放置。它们的质量和放置天数
的关系如图所示。分析a、b曲线变化的原因是?( )
A.a升华、b冷凝
B.a蒸发、b吸水
C.a挥发、b潮解
D.a冷凝、b吸水
评价检测·课堂达标
解析???? 浓硫酸具有吸水性,能够吸收空气中的水蒸气,溶剂增加,溶液的质
量增大;稀硫酸中的水分会蒸发,溶剂减少,溶液的质量减小。
B
2.下列离子的检验方法正确的是?( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
B.某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有S?
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+
D.某溶液中加稀硫酸产生无色气体,将该气体通入澄清石灰水中生成白色沉
淀,说明原溶液中有C?
C
解析???? 与硝酸银溶液反应生成白色沉淀的离子有Cl-、S?等;与BaCl2溶
液反应生成白色沉淀的离子有S?、Ag+等;与NaOH溶液反应生成蓝色沉淀
的离子只有Cu2+;与稀硫酸反应产生能使澄清石灰水变浑浊的无色气体的离子
有C?、HC?、S?、HS?。
3.锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体
33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中氢离子浓度为
0.1 mol·L-1。下列叙述不正确的是?( )
A.反应中共消耗1.8 mol H2SO4
B.生成的气体中SO2与H2的体积比为4∶1
C.反应中共消耗97.5 g Zn
D.反应中共转移3 mol电子
B
解析???? 生成气体的物质的量为?=1.5 mol,溶液剩余硫酸的物质
的量为?×1 L×0.1 mol·L-1=0.05 mol,参加反应的硫酸的物质的量为0.1 L×18.5
mol·L-1-0.05 mol=1.8 mol,随着反应的进行,硫酸的浓度逐渐减小,设反应生成x
mol SO2,y mol H2。
Zn + 2H2SO4(浓)? ZnSO4+SO2↑+2H2O
x mol 2x mol ??? ?x mol
y mol ????y mol ?? ??y mol
x mol+y mol=1.5 mol,2x mol+y mol=1.8 mol,解得x=0.3,y=1.2。由上述分析可
知,A正确;生成的气体中V(SO2)∶V(H2)=1∶4,B错误;反应中共消耗Zn的质量
为(0.3 mol+1.2 mol)×65 g·mol-1=97.5 g,C正确;在Zn和H2SO4(浓)的反应中,生成
0.3 mol SO2转移电子为0.6 mol,在Zn和H2SO4(稀)的反应中,生成1.2 mol H2转移
电子为2.4 mol,所以反应中共转移3 mol电子,D正确。
Zn +H2SO4(稀)? ZnSO4+H2↑
4.在化学课上围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入
烧杯中,加入少量水,搅拌均匀,然后加入浓硫酸,快速搅拌,生成疏松多孔的黑
色物质。
?
请回答下列问题:
(1)根据上述实验步骤①~⑤中,蔗糖与浓硫酸反应的实验现象,浓硫酸表现出
的化学性质有 ????(填字母)。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(2)反应中生成的黑色物质继续与浓硫酸作用,产生两种气体,其中一种气体X
有刺激性气味,另一种气体Y无色无味,写出反应的化学方程式:
???? ????。
BCD????
C+2H2SO4(浓)? CO2↑+2SO2↑+2H2O
(3)为了检验出混合气体中的X、Y这两种气体,提供下列试剂(试剂可多次使
用,不考虑尾气处理):
A.品红溶液 ????
B.澄清石灰水
C.酸性高锰酸钾溶液 ????
D.氢氧化钠溶液
混合气体通过的顺序依次是 ????→ ????→ ????→ ????(填
字母)。证明有气体Y存在的实验现象为 ???。
A
C
A
B
第二个品红溶液不褪色,澄清石灰水变浑浊
解析 (1)将适量的蔗糖放入烧杯中,加入少量水,搅拌均匀,然后加入浓硫酸,
生成黑色物质,体现了浓硫酸的脱水性;浓硫酸吸收水,放出大量的热,碳与浓硫
酸在加热的条件下反应,生成两种气体,体现了浓硫酸的吸水性和强氧化性。
(3)先将混合气体通入品红溶液检验二氧化硫,品红溶液褪色,说明含有二氧化
硫,之后将从品红溶液中出来的气体通入酸性高锰酸钾溶液,酸性高锰酸钾溶
液褪色,这一步是为了除去二氧化硫,将从酸性高锰酸钾溶液中出来的气体再
通入品红溶液,品红溶液不褪色,证明二氧化硫被除尽,最后通入澄清石灰水,若
有白色沉淀生成,则说明含有二氧化碳。故混合气体通过的顺序依次是A→C
→A→B。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
