【新教材】2020-2021学年高一化学人教版(2019)必修第二册5.2.2氨和铵盐 课件(共22张ppt)
文档属性
| 名称 | 【新教材】2020-2021学年高一化学人教版(2019)必修第二册5.2.2氨和铵盐 课件(共22张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-07 19:53:13 | ||
图片预览






文档简介
第五章 化工生产中的重要非金属元素
第二节氮及其化合物
第二课时 氨和铵盐
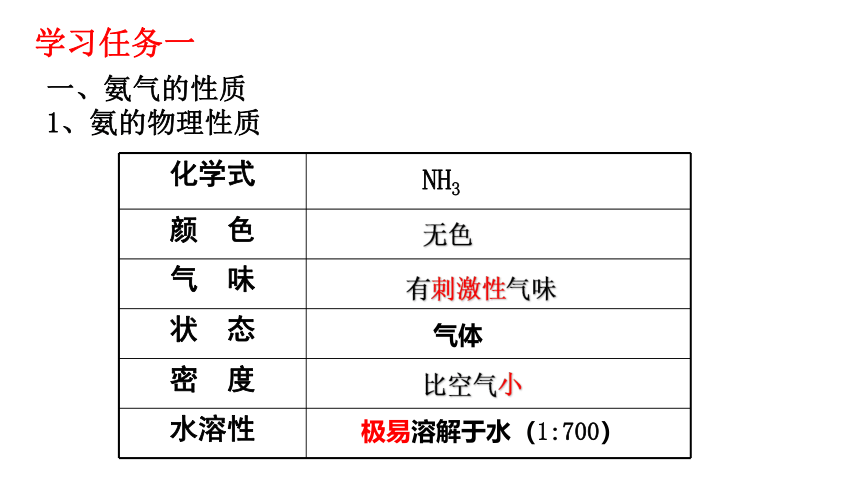
一、氨气的性质
1、氨的物理性质
化学式
颜 色
气 味
状 态
密 度
水溶性
无色
有刺激性气味
气体
比空气小
极易溶解于水(1:700)
NH3
学习任务一
实验现象:烧杯中的溶液由玻璃管进入烧瓶,形成 ,烧瓶内液体颜色呈 。
实验结论:氨 溶于水,水溶液呈 性。
原理解释:氨 溶于水,使烧瓶内的压强 ,导致烧杯中的水在大气压的作用下进入烧瓶。
喷泉
红色
极易
碱
极易
迅速减小
1.原理
使瓶内压强小于瓶外压强,产生压强差。产生压强差的方法
①减小瓶内压强(液体将气体吸收或反应)
②增大瓶外压强
2.喷泉实验成功的关键
①装置的气密性良好②烧瓶干燥③瓶内充满气体
3.常见的能形成喷泉的物质组合
喷泉实验
{5940675A-B579-460E-94D1-54222C63F5DA}气体
NH3
HCl
SO2 CO2
NO2与O2
吸收剂
水或盐酸
水或氢氧化钠溶液
浓氢氧化钠溶液
水
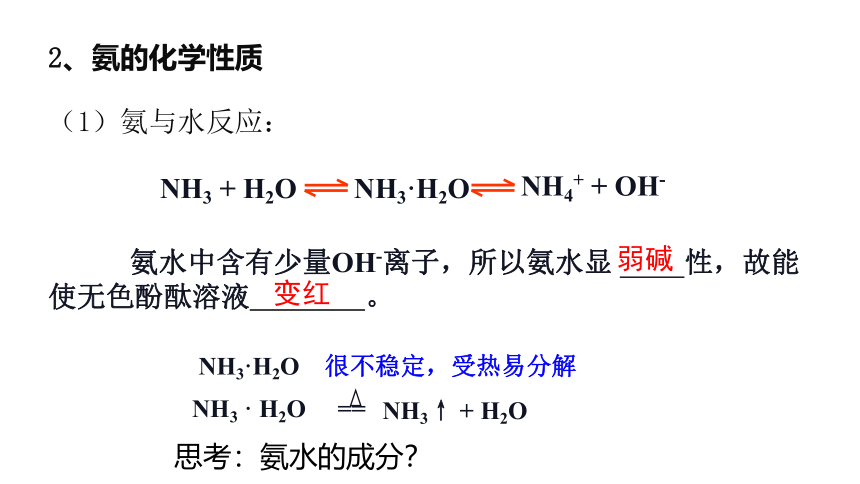
2、氨的化学性质
(1)氨与水反应:
NH3 + H2O NH3·H2O
NH4+ + OH-
NH3·H2O 很不稳定,受热易分解
NH3 · H2O ==
NH3↑ + H2O
氨水中含有少量OH-离子,所以氨水显 性,故能使无色酚酞溶液 。
弱碱
变红
思考:氨水的成分?
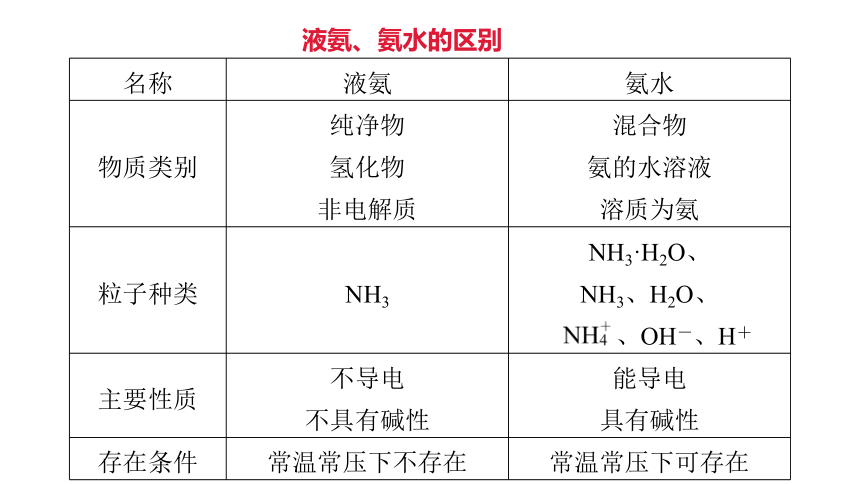
液氨、氨水的区别
名称
液氨
氨水
物质类别
纯净物
氢化物
非电解质
混合物
氨的水溶液
溶质为氨
粒子种类
NH3
NH3·H2O、
NH3、H2O、
、OH-、H+
主要性质
不导电
不具有碱性
能导电
具有碱性
存在条件
常温常压下不存在
常温常压下可存在
取两支玻璃棒,分别蘸取浓氨水和浓盐酸后,再将两支玻璃棒
相互靠近但不要接触,发现产生大量白烟
(2)氨与酸反应:
NH3+HCl=NH4Cl (白烟)
NH3+HNO3=NH4NO3 (白烟)
2NH3+H2SO4=(NH4)2SO4
不能用浓硫酸干燥NH3
氨与挥发性的酸反应有白烟
分析:
NH3
-3
氨中氮元素化合价为 价,因此氨具有 性,能与具有
性的物质发生反应。
(3)氨与氧气反应(氨的催化氧化)
工业制硝酸的基础
最低
还原
氧化
除了和氧气反应还可以和氯气、氧化铜等氧化剂反应
8NH3 + 3Cl2 = 6NH4Cl + N2 (氨气过量)
2NH3 + 3Cl2 = 6HCl + N2 (氨气不足)
2NH3 + 3CuO = 3H2O + 3Cu + N2 (可用于实验室制氮气)
3、氨的用途
制铵盐
制硝酸
制纤维、 塑料、染料
制纯碱
制尿素
做致冷剂
制医用氨水
氨
任务评价一
1.下列关于氨的叙述中,错误的是( )
A.氨易液化,因此可用作制冷剂
B.氨极易溶于水,因此可用来做喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(不容易分解)
D.氨溶于水显弱碱性,因此可使酚酞试剂变为红色
C
2.通常情况下,既能用无水CaCl2干燥,又能用碱石灰干燥的是( )
A.NH3 B.Cl2 C.NO D.HCl
C
二、铵盐
概念:由铵根离子和酸根离子构成的盐。
1、铵盐的物理性质:
铵盐多为无色或白色的离子晶体、易溶于水。
学习任务二
2、化学性质:
(1)不稳定性,受热易分解
NH4HCO3 === NH3↑+ CO2↑+ H2O
NH3 + HCl = NH4Cl
管底分解成气体
NH4Cl === NH3↑ + HCl↑
管口又形成 无色晶体
(2)与强碱反应,加热产生氨气
NH4NO3+ NaOH === NaNO3 + NH3 ↑+ H2O
(NH4)2SO4 + 2NaOH === Na2SO4+ 2NH3 ↑+ 2H2O
铵盐溶液与强碱溶液共热反应的离子方程式为:
NH4+ +OH-=== NH3↑ + H2O
△
实验操作
实验现象
三支试管中均有无色气体放出,湿润的红色石蕊试纸变____
实验原理
离子方程式:
应用
检验 和制取氨
①实验探究
蓝色
(3)铵根离子的检验
红色
石蕊试纸
变蓝
②
3、NH3的实验室制法
(1)原理:
铵盐 + 碱——NH3
(2)装置:
固固加热制气装置
(3)集气方法:
向下排空气法
(4)验满方法:
①将湿润的红色石蕊试纸置于试管口(试纸变蓝)
②将蘸有浓盐酸的玻璃棒靠近试管口(白烟)
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑
△
(5)干燥方法:碱石灰
(6)尾气处理:水或酸(防倒吸)
氨是化学实验室常需制取的气体。实验室也可以用下列两种方法快速制备NH3:
方法一:加热浓氨水。
方法二:将浓氨水滴入生石灰(或碱石灰)固体中。
方法二:NH3·H2O+CaO===NH3↑+Ca(OH)2
任务评价二
1.下列关于氨水的叙述正确的是( )
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1 mol·L-1的氨水指在1 L溶液中含NH3、NH3·H2O、 物质的量之和
为1 mol
D
2.下图是NH3的两个性质实验,下列有关说法中正确的是( )
A.两个实验均表现了NH3易溶于水
B.两个实验均表现了NH3易挥发
C.两个实验均表现了NH3是碱性气体
D.两个实验均表现了NH3是还原性气体
D
第二节氮及其化合物
第二课时 氨和铵盐
一、氨气的性质
1、氨的物理性质
化学式
颜 色
气 味
状 态
密 度
水溶性
无色
有刺激性气味
气体
比空气小
极易溶解于水(1:700)
NH3
学习任务一
实验现象:烧杯中的溶液由玻璃管进入烧瓶,形成 ,烧瓶内液体颜色呈 。
实验结论:氨 溶于水,水溶液呈 性。
原理解释:氨 溶于水,使烧瓶内的压强 ,导致烧杯中的水在大气压的作用下进入烧瓶。
喷泉
红色
极易
碱
极易
迅速减小
1.原理
使瓶内压强小于瓶外压强,产生压强差。产生压强差的方法
①减小瓶内压强(液体将气体吸收或反应)
②增大瓶外压强
2.喷泉实验成功的关键
①装置的气密性良好②烧瓶干燥③瓶内充满气体
3.常见的能形成喷泉的物质组合
喷泉实验
{5940675A-B579-460E-94D1-54222C63F5DA}气体
NH3
HCl
SO2 CO2
NO2与O2
吸收剂
水或盐酸
水或氢氧化钠溶液
浓氢氧化钠溶液
水
2、氨的化学性质
(1)氨与水反应:
NH3 + H2O NH3·H2O
NH4+ + OH-
NH3·H2O 很不稳定,受热易分解
NH3 · H2O ==
NH3↑ + H2O
氨水中含有少量OH-离子,所以氨水显 性,故能使无色酚酞溶液 。
弱碱
变红
思考:氨水的成分?
液氨、氨水的区别
名称
液氨
氨水
物质类别
纯净物
氢化物
非电解质
混合物
氨的水溶液
溶质为氨
粒子种类
NH3
NH3·H2O、
NH3、H2O、
、OH-、H+
主要性质
不导电
不具有碱性
能导电
具有碱性
存在条件
常温常压下不存在
常温常压下可存在
取两支玻璃棒,分别蘸取浓氨水和浓盐酸后,再将两支玻璃棒
相互靠近但不要接触,发现产生大量白烟
(2)氨与酸反应:
NH3+HCl=NH4Cl (白烟)
NH3+HNO3=NH4NO3 (白烟)
2NH3+H2SO4=(NH4)2SO4
不能用浓硫酸干燥NH3
氨与挥发性的酸反应有白烟
分析:
NH3
-3
氨中氮元素化合价为 价,因此氨具有 性,能与具有
性的物质发生反应。
(3)氨与氧气反应(氨的催化氧化)
工业制硝酸的基础
最低
还原
氧化
除了和氧气反应还可以和氯气、氧化铜等氧化剂反应
8NH3 + 3Cl2 = 6NH4Cl + N2 (氨气过量)
2NH3 + 3Cl2 = 6HCl + N2 (氨气不足)
2NH3 + 3CuO = 3H2O + 3Cu + N2 (可用于实验室制氮气)
3、氨的用途
制铵盐
制硝酸
制纤维、 塑料、染料
制纯碱
制尿素
做致冷剂
制医用氨水
氨
任务评价一
1.下列关于氨的叙述中,错误的是( )
A.氨易液化,因此可用作制冷剂
B.氨极易溶于水,因此可用来做喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(不容易分解)
D.氨溶于水显弱碱性,因此可使酚酞试剂变为红色
C
2.通常情况下,既能用无水CaCl2干燥,又能用碱石灰干燥的是( )
A.NH3 B.Cl2 C.NO D.HCl
C
二、铵盐
概念:由铵根离子和酸根离子构成的盐。
1、铵盐的物理性质:
铵盐多为无色或白色的离子晶体、易溶于水。
学习任务二
2、化学性质:
(1)不稳定性,受热易分解
NH4HCO3 === NH3↑+ CO2↑+ H2O
NH3 + HCl = NH4Cl
管底分解成气体
NH4Cl === NH3↑ + HCl↑
管口又形成 无色晶体
(2)与强碱反应,加热产生氨气
NH4NO3+ NaOH === NaNO3 + NH3 ↑+ H2O
(NH4)2SO4 + 2NaOH === Na2SO4+ 2NH3 ↑+ 2H2O
铵盐溶液与强碱溶液共热反应的离子方程式为:
NH4+ +OH-=== NH3↑ + H2O
△
实验操作
实验现象
三支试管中均有无色气体放出,湿润的红色石蕊试纸变____
实验原理
离子方程式:
应用
检验 和制取氨
①实验探究
蓝色
(3)铵根离子的检验
红色
石蕊试纸
变蓝
②
3、NH3的实验室制法
(1)原理:
铵盐 + 碱——NH3
(2)装置:
固固加热制气装置
(3)集气方法:
向下排空气法
(4)验满方法:
①将湿润的红色石蕊试纸置于试管口(试纸变蓝)
②将蘸有浓盐酸的玻璃棒靠近试管口(白烟)
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑
△
(5)干燥方法:碱石灰
(6)尾气处理:水或酸(防倒吸)
氨是化学实验室常需制取的气体。实验室也可以用下列两种方法快速制备NH3:
方法一:加热浓氨水。
方法二:将浓氨水滴入生石灰(或碱石灰)固体中。
方法二:NH3·H2O+CaO===NH3↑+Ca(OH)2
任务评价二
1.下列关于氨水的叙述正确的是( )
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1 mol·L-1的氨水指在1 L溶液中含NH3、NH3·H2O、 物质的量之和
为1 mol
D
2.下图是NH3的两个性质实验,下列有关说法中正确的是( )
A.两个实验均表现了NH3易溶于水
B.两个实验均表现了NH3易挥发
C.两个实验均表现了NH3是碱性气体
D.两个实验均表现了NH3是还原性气体
D
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
