【新教材】2020-2021学年高一化学人教版(2019)必修第二册5.2.1氮气和氮的氧化物 课件(共22张ppt)
文档属性
| 名称 | 【新教材】2020-2021学年高一化学人教版(2019)必修第二册5.2.1氮气和氮的氧化物 课件(共22张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 936.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-07 19:58:15 | ||
图片预览







文档简介
第五章 化工生产中的重要非金属元素
第二节氮及其化合物
第一课时 氮气和氮的氧化物
揭秘自然
谚语“雷雨发庄稼”
在新疆与青海交界处有一山谷,人称“魔鬼谷”。经常电闪雷鸣,狂风暴雨,把人畜击毙。然而谷内却是牧草茂盛,四季常青。你知道这是为什么吗?
1.氮元素的结构及存在
(1)氮元素位于元素周期表的第 周期、第 族。氮原子最外层有 个电子,既不容易 3个电子,也不容易 5个电子。一般通过______
与其他原子相互结合成物质。
(2)氮元素在自然界中的存在
氮元素主要以 分子的形式存在于空气中,部分氮元素以化合物的形式存在于动植物体内的 中,还有部分存在于土壤、海洋里的______
和 中。
一、氮气与氮的固定
二
ⅤA
得到
失去
共用电
5
子对
N2
蛋白质
硝酸盐
铵盐
学习任务一
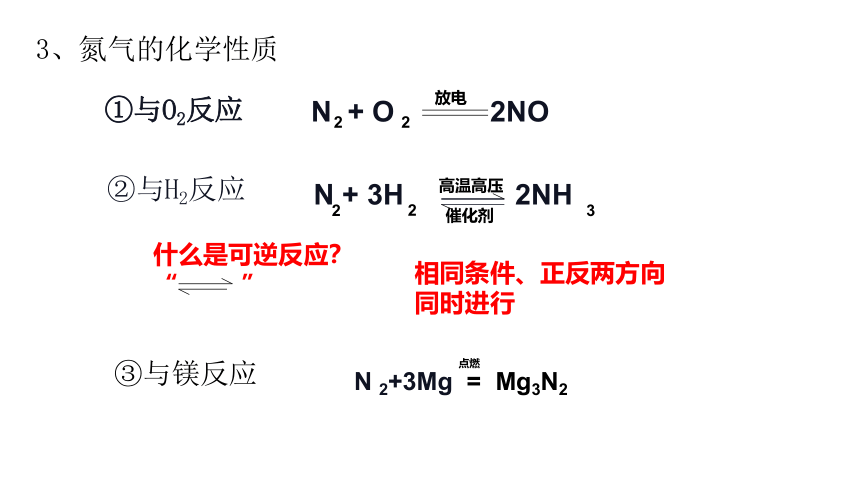
因形成3对共用电子,因此不活泼,很难与其他物质发生反应。但在一定条件下,氮气能与氧气、氢气、镁等物质反应。
2、物理性质 :
化学性质:电子式:
无色、无味的气体,难溶于水,密度比空略小
:N N:
… …
N + O 2NO
放电
2
2
①与O2反应
②与H2反应
高温高压
催化剂
N + 3H 2NH
2
2
3
相同条件、正反两方向同时进行
什么是可逆反应?
“ ”
③与镁反应
3、氮气的化学性质
N 2+3Mg = Mg3N2
点燃
人工固氮: 如工业合成氨;仿生固氮
自然固氮: 高能固氮——闪电条件下氮气转化为NO
生物固氮——豆科根瘤菌吸收空气中N2
转化为含氮化合物。
4、氮的固定
使空气中游离态的氮转化为可利用的含氮化合物的过程叫做氮的固定,简称固氮。
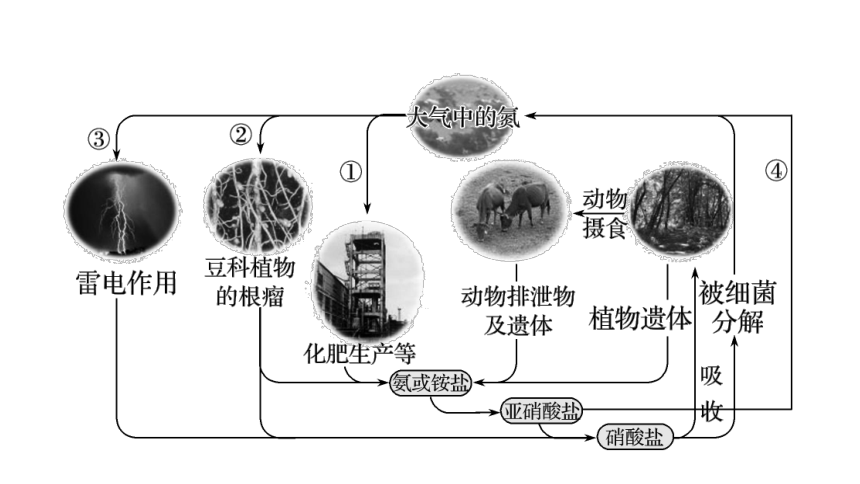
5、自然界中氮的循环
(1)自然界:
①豆科植物根部的根瘤菌,把氮气转变为硝酸盐等含氮的化合物。
②在放电条件下,空气中N2与氧气化合为氮的氧化物,并随降雨进入水体和土壤中。
③微生物分解动植物中的蛋白质生成小分子的含氮化合物,回到水体和土壤中。
(2)人类活动:
①将空气中N2合成氨,再进一步转化为其他含氮化合物,进入水体和土壤中。
②化石燃料燃烧、森林和农作物的枝叶燃烧所产生的氮氧化物通过大气进入陆地和海洋。
6、氮气的用途
1.下列关于N2的说法错误的是( )
评价任务一
C
(1)氮元素有多种化合价,其最高正价为+5价( )
(2)氮原子与其他原子只能形成共价键,不能形成离子键( )
(3)氮气常用作焊接金属、填充灯泡、保存食品的保护气( )
(4)氮的固定中氮元素一定被氧化( )
(5)豆科植物的根瘤菌固氮属于自然固氮中的高能固氮( )
(6)工业上将NH3转化为其他铵态化肥属于人工固氮( )
(7)N2和O2在放电条件下会生成NO2( )
(8)N2中N元素价态为0价,处于中间价态,因此既有氧化性,又有还原性( )
√
×
√
×
×
×
×
√
2、正误判断
二、NO和NO2
{5940675A-B579-460E-94D1-54222C63F5DA}化合价
+1
+2
+3
+4
+5
对应氧化物
N2O笑气
NO
N2O3
NO2 、N2O4
N2O5
1、氮的氧化物
注意:这些氧化物中只有N2O3 、N2O5是酸性氧化物,其余为不成盐氧化物。
学习任务二
NO:无色无味气体,难溶于水,有毒。
NO2:红棕色、刺激性气味有毒气体,密度比空气大,易溶于水。
(1)物理性质:
2、NO和NO2
(2)化学性质
2NO+O2 2NO2
1、NO
在常温下能与氧气反应
生成易溶于水的二氧化
氮气体。
思考:
如何收集NO气体?
收集NO不能用排空气法,只能用排水法
2、NO2
现象:红棕色逐渐变浅
(2) 强氧化性 因此有漂白能力
(1)转化:在NO2中存在着这样一个反应
2NO2 N2O4(无色气体)
【实验5-5】
操作一:在一支50 mL的注射器里充入20 mL NO,观察颜色,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器。
现象:一氧化氮为无色气体,注射器内无明显变化。
结论:NO难溶于水
操作二:打开弹簧夹,快速吸入10 mL空气,夹上弹簧夹。
现象: 。
结论:NO和O2反应生成 。
操作三:振荡注射器
现象:气体红棕色 ,得到 溶液。
结论:NO2和H2O反应生成了 。
写出下列转化的化学方程式:
(1)NO―→NO2:_________________。
(2)NO2―→NO:3NO2+H2O===2HNO3+NO,该反应中NO2既表现 ,又表现 。
注射器内气体变为红棕色
NO2
消失
无色
HNO3和NO
2NO+O2===2NO2
氧化性
还原性
思考
1、如何收集NO2呢?
2、在二氧化氮与水的反应中的氧化剂和还原剂?物质的量之比?
只能用向上排空气法
氧化剂(NO2):还原剂( NO2 )=1:2
(1)由于NO极易与O2反应,并且其密度与空气相差不多,因此收集NO只能用排水法( )
(2)由于NO2极易与水反应且密度比空气大,因此收集NO2只能用向上排空气法( )
(3)NO2易溶于水生成HNO3,故NO2是酸性氧化物( )
(4)N2与O2反应时,不论O2是否足量,其一步反应都只能得到NO,不能生成NO2( )
(5)NO和NO2都是有刺激性气味的有毒气体,它们都是大气污染物( )
√
√
×
√
×
判断正误
评价任务二
2.将一支充有12 mL NO2气体的试管倒置于水槽中,充分反应。
(1)下列图示正确的是__。
C
(2)如水不能充满试管,需再向试管中缓缓充入O2,现象为_____________
____________________,最终充入__ mL氧气,才能使水全部充满。
红棕色,液面逐渐上升
无色气体变为
3
【课堂小结】下图表示含氮物质的转化关系
N2
NO
NO2
HNO3
NH3
N2O4
Mg3N2
高温、高压、催化剂
放电
点燃
请用化学方程式表示上述各个过程。
第二节氮及其化合物
第一课时 氮气和氮的氧化物
揭秘自然
谚语“雷雨发庄稼”
在新疆与青海交界处有一山谷,人称“魔鬼谷”。经常电闪雷鸣,狂风暴雨,把人畜击毙。然而谷内却是牧草茂盛,四季常青。你知道这是为什么吗?
1.氮元素的结构及存在
(1)氮元素位于元素周期表的第 周期、第 族。氮原子最外层有 个电子,既不容易 3个电子,也不容易 5个电子。一般通过______
与其他原子相互结合成物质。
(2)氮元素在自然界中的存在
氮元素主要以 分子的形式存在于空气中,部分氮元素以化合物的形式存在于动植物体内的 中,还有部分存在于土壤、海洋里的______
和 中。
一、氮气与氮的固定
二
ⅤA
得到
失去
共用电
5
子对
N2
蛋白质
硝酸盐
铵盐
学习任务一
因形成3对共用电子,因此不活泼,很难与其他物质发生反应。但在一定条件下,氮气能与氧气、氢气、镁等物质反应。
2、物理性质 :
化学性质:电子式:
无色、无味的气体,难溶于水,密度比空略小
:N N:
… …
N + O 2NO
放电
2
2
①与O2反应
②与H2反应
高温高压
催化剂
N + 3H 2NH
2
2
3
相同条件、正反两方向同时进行
什么是可逆反应?
“ ”
③与镁反应
3、氮气的化学性质
N 2+3Mg = Mg3N2
点燃
人工固氮: 如工业合成氨;仿生固氮
自然固氮: 高能固氮——闪电条件下氮气转化为NO
生物固氮——豆科根瘤菌吸收空气中N2
转化为含氮化合物。
4、氮的固定
使空气中游离态的氮转化为可利用的含氮化合物的过程叫做氮的固定,简称固氮。
5、自然界中氮的循环
(1)自然界:
①豆科植物根部的根瘤菌,把氮气转变为硝酸盐等含氮的化合物。
②在放电条件下,空气中N2与氧气化合为氮的氧化物,并随降雨进入水体和土壤中。
③微生物分解动植物中的蛋白质生成小分子的含氮化合物,回到水体和土壤中。
(2)人类活动:
①将空气中N2合成氨,再进一步转化为其他含氮化合物,进入水体和土壤中。
②化石燃料燃烧、森林和农作物的枝叶燃烧所产生的氮氧化物通过大气进入陆地和海洋。
6、氮气的用途
1.下列关于N2的说法错误的是( )
评价任务一
C
(1)氮元素有多种化合价,其最高正价为+5价( )
(2)氮原子与其他原子只能形成共价键,不能形成离子键( )
(3)氮气常用作焊接金属、填充灯泡、保存食品的保护气( )
(4)氮的固定中氮元素一定被氧化( )
(5)豆科植物的根瘤菌固氮属于自然固氮中的高能固氮( )
(6)工业上将NH3转化为其他铵态化肥属于人工固氮( )
(7)N2和O2在放电条件下会生成NO2( )
(8)N2中N元素价态为0价,处于中间价态,因此既有氧化性,又有还原性( )
√
×
√
×
×
×
×
√
2、正误判断
二、NO和NO2
{5940675A-B579-460E-94D1-54222C63F5DA}化合价
+1
+2
+3
+4
+5
对应氧化物
N2O笑气
NO
N2O3
NO2 、N2O4
N2O5
1、氮的氧化物
注意:这些氧化物中只有N2O3 、N2O5是酸性氧化物,其余为不成盐氧化物。
学习任务二
NO:无色无味气体,难溶于水,有毒。
NO2:红棕色、刺激性气味有毒气体,密度比空气大,易溶于水。
(1)物理性质:
2、NO和NO2
(2)化学性质
2NO+O2 2NO2
1、NO
在常温下能与氧气反应
生成易溶于水的二氧化
氮气体。
思考:
如何收集NO气体?
收集NO不能用排空气法,只能用排水法
2、NO2
现象:红棕色逐渐变浅
(2) 强氧化性 因此有漂白能力
(1)转化:在NO2中存在着这样一个反应
2NO2 N2O4(无色气体)
【实验5-5】
操作一:在一支50 mL的注射器里充入20 mL NO,观察颜色,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器。
现象:一氧化氮为无色气体,注射器内无明显变化。
结论:NO难溶于水
操作二:打开弹簧夹,快速吸入10 mL空气,夹上弹簧夹。
现象: 。
结论:NO和O2反应生成 。
操作三:振荡注射器
现象:气体红棕色 ,得到 溶液。
结论:NO2和H2O反应生成了 。
写出下列转化的化学方程式:
(1)NO―→NO2:_________________。
(2)NO2―→NO:3NO2+H2O===2HNO3+NO,该反应中NO2既表现 ,又表现 。
注射器内气体变为红棕色
NO2
消失
无色
HNO3和NO
2NO+O2===2NO2
氧化性
还原性
思考
1、如何收集NO2呢?
2、在二氧化氮与水的反应中的氧化剂和还原剂?物质的量之比?
只能用向上排空气法
氧化剂(NO2):还原剂( NO2 )=1:2
(1)由于NO极易与O2反应,并且其密度与空气相差不多,因此收集NO只能用排水法( )
(2)由于NO2极易与水反应且密度比空气大,因此收集NO2只能用向上排空气法( )
(3)NO2易溶于水生成HNO3,故NO2是酸性氧化物( )
(4)N2与O2反应时,不论O2是否足量,其一步反应都只能得到NO,不能生成NO2( )
(5)NO和NO2都是有刺激性气味的有毒气体,它们都是大气污染物( )
√
√
×
√
×
判断正误
评价任务二
2.将一支充有12 mL NO2气体的试管倒置于水槽中,充分反应。
(1)下列图示正确的是__。
C
(2)如水不能充满试管,需再向试管中缓缓充入O2,现象为_____________
____________________,最终充入__ mL氧气,才能使水全部充满。
红棕色,液面逐渐上升
无色气体变为
3
【课堂小结】下图表示含氮物质的转化关系
N2
NO
NO2
HNO3
NH3
N2O4
Mg3N2
高温、高压、催化剂
放电
点燃
请用化学方程式表示上述各个过程。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
