【新教材】2020-2021学年人教版(2019)高一化学必修二5.2 氮及其化合物 课时3 硝酸 酸雨及防治 课件(共48张ppt)
文档属性
| 名称 | 【新教材】2020-2021学年人教版(2019)高一化学必修二5.2 氮及其化合物 课时3 硝酸 酸雨及防治 课件(共48张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 764.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-07 00:00:00 | ||
图片预览











文档简介
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
课时3 硝酸 酸雨及防治
学习任务一 硝酸
任务探究·深度学习
新知梳理
自主学习
1.物理性质
硝酸是无色、易① ????、有② ????气味的液体。
挥发
刺激性
2.化学性质
(1)不稳定性
a.化学方程式:③ ????。
b.保存:一般将浓硝酸保存在棕色试剂瓶中,并放置在阴凉处。
(2)强氧化性
a.与金属铜反应
浓硝酸与Cu反应的化学方程式:④ ???????;
稀硝酸与Cu反应的化学方程式:⑤ ??????。
b.常温下,铁、铝的表面被浓硝酸或浓硫酸氧化,生成了一层致密的⑥ ????
薄膜,这层薄膜阻止了酸与内层金属的进一步反应,故常温下可以用铁或
铝制容器来盛装浓硝酸或浓硫酸。
c.王水
组成
浓硝酸和浓盐酸的混合物,体积比为⑦ ????????
特性
能使一些不溶于硝酸的金属如金、铂等溶解
氧化物
1 ∶ 3
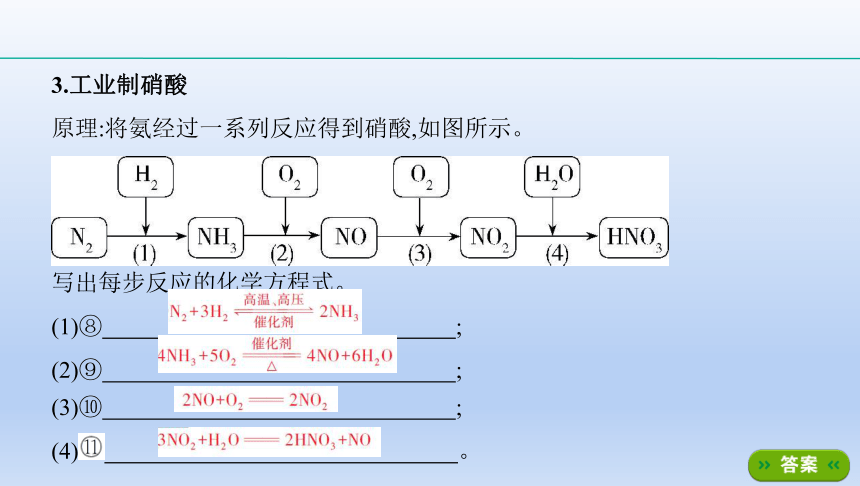
3.工业制硝酸
原理:将氨经过一系列反应得到硝酸,如图所示。
?
写出每步反应的化学方程式。
(1)⑧ ????;
(2)⑨ ????;
(3)⑩ ????;
(4)? ????。
判断下列说法的正误(正确的画“√”,错误的画“?”)。
易错辨析
1.硝酸在光照或加热条件下可分解生成二氧化氮气体?( )
2.硝酸可与Na2SO3反应制得SO2?( )
3.浓硝酸、稀硝酸与铜反应均属于置换反应?( )
4.在常温下,浓硫酸和浓硝酸遇Fe和Al无明显现象,说明常温下浓硫酸和浓硝
酸与Fe和Al都不反应?( )
√
?
?
?
1.浓硝酸、稀硝酸与Cu的反应产物分别为NO2、NO,反应中,稀硝酸中氮元素
的化合价降低较多,说明稀硝酸的氧化性比浓硝酸强,对吗?
互动探究
答案 不对,浓硝酸的氧化性比稀硝酸的强,与Cu反应时浓硝酸反应更剧烈。
2.实验室一般将浓硝酸保存在棕色试剂瓶中。如果将浓硝酸取出,发现浓硝酸
呈黄色。这是为什么呢?
?
答案 浓硝酸见光易分解,所以保存在棕色试剂瓶中。浓硝酸见光分解会生
成二氧化氮,溶于浓硝酸呈黄色。
3.《本草纲目拾遗》中记载:“(硝酸)西洋人所造,性最猛,能蚀五金”。王怡
堂先生云:“其水至强,五金八石皆能穿滴,惟玻璃可盛”。上述描述体现了硝
酸的哪些性质呢?
?
答案 酸性和强氧化性。
4.铜投入稀硫酸中不会溶解,再向溶液中投入KNO3固体,铜会不会溶解?为什
么?若将锌投入稀硝酸中,会有氢气生成吗?
答案 铜会溶解。由离子方程式:8H++2N?+3Cu? 3Cu2++2NO↑+4H2O可
知,只要溶液中同时存在H+和N?,铜就会发生反应而溶解。若将锌投入稀硝
酸中,因为硝酸的强氧化性,所以不会有氢气生成,会生成NO等氮的氧化物。
5.如图所示是进行木炭与浓硝酸的反应,并检验生成的气体的实验装置。
?
(1)实验中具支试管A内有什么现象?写出有关反应的化学方程式。
(2)试管B内的澄清石灰水会出现什么现象?水湿棉花处会发生什么反应?
(3)若将木炭与浓硝酸反应产生的气体直接通入少量澄清石灰水中,溶液能否
变浑浊?
答案 (1)木炭保持红热状态,试管内有红棕色气体生成。反应的化学方程式
为C+4HNO3(浓)? 4NO2↑+CO2↑+2H2O。
(2)木炭与浓硝酸反应生成的CO2会使澄清石灰水变浑浊。水湿棉花处发生反
应:3NO2+H2O? NO+2HNO3、CO2+H2O? H2CO3。
(3)木炭与浓硝酸反应产生的气体包括NO2和CO2,NO2溶于水会生成HNO3,
HNO3为强酸,所以不会生成CaCO3,溶液不变浑浊。
6.m g Cu与足量一定浓度的硝酸充分反应,生成V L NO、NO2混合气体(标准状
况下),则参加反应的HNO3的物质的量是多少?
答案 被还原的HNO3无论生成NO还是NO2,均有氮原子的物质的量与被还原
HNO3的物质的量相等;未被还原(起酸性作用)HNO3的物质的量等于Cu(NO3)2
物质的量的2倍,故参加反应的HNO3的物质的量为(?+?) mol。
1.硝酸的强氧化性
(1)硝酸与金属的反应
①除Au、Pt等少数金属外,硝酸几乎可以氧化所有的金属,如3Ag+4HNO3(稀)
? 3AgNO3+NO↑+2H2O。
②活泼金属与硝酸反应不生成H2,硝酸的浓度不同,还原产物不同。
提炼归纳
?
③常温下,浓硝酸能使Fe、Al钝化。
(2)硝酸与非金属的反应
①反应规律:非金属单质+浓硝酸? 最高价氧化物或其含氧酸+NO2↑+H2O。
②实例:C+4HNO3(浓)? CO2↑+4NO2↑+2H2O。
(3)硝酸与还原性化合物或离子的反应:硝酸的强氧化性还表现在可以氧化具
有还原性的化合物或离子,如HI、HBr、SO2、Fe2+、FeO、Br-、I-、S2-、S?
等均能被硝酸氧化。
2.硝酸与金属反应的“三个守恒、一个关系”
(1)三个守恒
①得失电子守恒:n(金属失电子)=n(NO2)+3n(NO)。
②氮原子守恒:n(HNO3)=xn[M(NO3)x]+n(NO2)+n(NO)。
③若向反应后的溶液中加入NaOH溶液,恰好使Mx+沉淀完全,此时溶质为NaNO3,
则存在:n(Na+)=n(N?)=n(HNO3)-n(NO)-n(NO2)。
(2)一个关系:起酸性作用的HNO3的物质的量等于金属的物质的量和金属所带
电荷数的乘积,可表示为n(HNO3)酸性=xn(Mx+)=n(转移电子)。
1.下列有关浓硝酸的说法不正确的是?( )
A.实验室常用浓硝酸与金属锌反应制备氢气
B.在常温下,浓硝酸能使金属铝钝化
C.浓硝酸不稳定,见光或受热易分解,需要避光保存
D.浓硝酸易挥发,打开瓶塞,瓶口有白雾产生
典题精练
解析???? 浓硝酸具有强氧化性,与金属反应时,一般不生成氢气,所以实验室
中不能使用浓硝酸与金属锌反应制备氢气,故A错误。
A
2.下列关于硝酸的叙述中正确的是?( )
A.稀硝酸是弱酸,浓硝酸是强酸
B.铜与浓硝酸和稀硝酸都能发生反应生成二氧化氮
C.浓硝酸能在铁的表面生成氧化膜
D.稀硝酸与活泼金属反应放出氢气,而浓硝酸则使金属钝化
解析???? 稀硝酸和浓硝酸均是强酸,A错误;铜与浓硝酸和稀硝酸都能发生反
应,分别生成NO2和NO,B错误;浓硝酸具有强氧化性,能在铁的表面生成氧化膜,
C正确;硝酸是强氧化性酸,稀硝酸与活泼金属反应不能产生氢气,浓硝酸在常
温下能使铝或铁钝化,D错误。
C
3.现有某硫酸和硝酸的混合溶液20 mL,其中含硫酸的浓度为2 mol/L,含硝酸的
浓度为1 mol/L,现向其中加入0.96 g铜粉,充分反应后(假设只生成NO),最多可
收集到标准状况下的气体的体积为?( )
A.89.6 mL B.112 mL C.168 mL D.224 mL
解析???? 硫酸的浓度为2 mol/L,为稀硫酸,硝酸的浓度为1 mol/L,为稀硝酸,溶
液中能与铜粉反应的为稀硝酸。铜与稀硝酸反应的离子方程式为3Cu+8H++
2N?? 3Cu2++2NO↑+4H2O。Cu的物质的量为? mol=0.015 mol,硝酸根离
子的物质的量为0.02 mol,硝酸和硫酸均提供氢离子,故氢离子的物质的量为
(2×0.02×2+1×0.02)mol=0.1 mol,故氢离子、硝酸根离子均过量,则生成的NO在
标准状况下的体积为(?×0.015×22.4×1 000)mL=224 mL。
D
4.某校课外活动小组为了探究铜与稀硝酸反应产生的是NO,设计了如下实
验。实验装置如图所示(已知NO、NO2能与NaOH溶液反应):
?
(1)设计装置A的目的是 ,
为达此目的应进行的操作是使分液漏斗的凹槽对准小孔,打开K,当装置C中产生白色沉淀时,关闭K。
(2)在(1)中的操作后将装置B中的铜丝插入稀硝酸,微热,观察到装置B中的现
象是 ???;
B中反应的离子方程式是 ????。
(3)将注射器F中的空气推入E中,E中的气体变为红棕色,该实验的目的是 ????
????。
(4)D装置的作用是 ????。
利用生成的CO2将整套装置内的空气排尽,以排除对气体产物检验的干扰????
铜丝上产生气泡,稀硝酸液面上气体呈无色,溶液变为蓝色
验证E中的无色气体为NO
吸收NO、NO2等尾气,防止污染空气
解析 (2)因铜与稀硝酸反应生成硝酸铜、NO和水,反应的离子方程式为3Cu+
8H++2N?? 3Cu2++2NO↑+4H2O,因此实验现象是铜丝上产生气泡,稀硝酸
液面上气体呈无色,溶液变为蓝色。
(3)将F中的空气推入E中,发生反应:2NO+O2? 2NO2,E中无色气体变为红棕
色,证明NO存在,则该实验的目的是验证E中的无色气体为NO。
学习任务二 酸雨及防治
新知梳理
自主学习
1.SO2与NOx的主要来源
(1)SO2主要来自煤、石油的燃烧和某些含硫金属矿物的冶炼。
(2)NOx主要来自机动车尾气(高温条件下氮气和氧气反应生成氮氧化物)。
2.酸雨
(1)概念:pH<① 的雨水。
(2)成因:主要是大气中的② 以及它们在大气中发生反应后的生成物
溶于雨水形成的。
(3)危害
a.直接损伤农作物,破坏森林和草原,使土壤、湖泊酸化。
b.加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀。
5.6
SO2 和NOx
判断下列说法的正误(正确的画“√”,错误的画“?”)。
易错辨析
1.pH<7的降雨均为酸雨?( )
2.CO2和SO2都属于空气污染物?( )
3.因为汽油中含有氮元素,所以汽车尾气中含有NO等氮氧化物?( )
4.二氧化硫和二氧化氮是形成酸雨的主要物质?( )
?
?
?
√
1.呈酸性的雨水就是酸雨吗?收集到的酸雨样品,放置时间稍长,酸性反而越强,
原因是什么?
互动探究
答案 不是,由于溶解了二氧化碳,正常雨水的pH约为5.6,酸雨的pH小于5.6。
酸雨中的H2SO3为弱酸,长时间放置易被O2氧化为酸性更强的H2SO4。
2.生活需要洁净、安全的生存环境,新的《环境空气质量标准》的颁布表明国
家对环境问题的进一步重视。
(1)煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成什么酸?在煤中加入适量
生石灰,可以大大减少煤燃烧时SO2的排放,请你写出涉及反应的化学方程式。
(2)A、B、C三个城市全年雨水的月平均pH变化如图所示。
?
①受酸雨危害最严重的是哪个城市?
②汽车尾气中含有NO2、NO、CO等有害气体。汽车安装尾气净化装置可将
NO、CO转化为无害气体,该反应的化学方程式是什么?
③酸雨分为硝酸型酸雨和硫酸型酸雨。请你写出NO转化为硝酸的反应的化
学方程式。
答案 (1)二氧化硫与水反应生成亚硫酸,亚硫酸不稳定,最终被空气中氧气氧
化为H2SO4。涉及反应的化学方程式为2CaO+2SO2+O2? 2CaSO4。
(2)①pH越小,受到酸雨的危害越严重,从题图中可知,C城市全年雨水的月平均
pH在三个城市中最小,受到酸雨的危害最大。
②反应的化学方程式为2NO+2CO? N2+2CO2。
③2NO+O2? 2NO2、3NO2+H2O? 2HNO3+NO。
酸雨的认识
?
提炼归纳
1.环保部门测得某市空气里的成分有①N2,②O2,③CO2,④Ar,⑤SO2,⑥NO2,⑦可
吸入碳颗粒。其中会导致酸雨的是?????( )
A.③⑤⑥ B.⑤⑥ ????
C.④⑤⑦ D.除①②以外
典题精练
解析???? SO2、NO2易形成酸雨。
B
2.下列说法错误的是?( )
A.空气中的SO2溶于水,最终形成酸雨
B.汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮氧化物
C.工业废水任意排放是造成酸雨的主要原因
D.为了减少酸雨的形成,必须减少SO2的排放量,对燃料脱硫处理
解析???? 工业废水任意排放引起江、河、湖泊污染,而酸雨是由大量SO2和
NOx溶于雨水形成的。
C
3.硫酸型酸雨的形成原理可简化表示如下图所示:
?
回答下列问题:
(1)A物质的化学式为 ????,B物质的化学式为 ????。
SO2
SO3
(2)根据SO2的性质,可让工厂的烟道气通过 ???? 或氧化剂等除去SO2,
达到减少污染的目的。
(3)现有雨水样品1份,常温下,每隔一段时间测定该雨水样品的pH,所得数据如
下:
测试时间/h
0
1
2
3
4
雨水的pH
4.73
4.62
4.56
4.55
4.55
碱液(如氨水等)
注:溶液的pH越大,H+的物质的量浓度就越小。
①雨水样品的pH变化的原因是 ????(用化学方程
式表示)。
②如果将刚取样的上述雨水和用氯气消毒的自来水相混合,pH将 ????(填
“增大”“减小”或“不变”),原因是 ????(用
化学方程式表示)。
(4)你认为减少酸雨产生可采用的措施是 ????(填序号)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加
石灰 ⑤开发新能源
2H2SO3+O2? 2H2SO4
减小
H2SO3+Cl2+H2O? H2SO4+2HCl
① ③⑤
解析 (1)硫酸型酸雨是含硫物质燃烧生成的二氧化硫引起的,依据流程分析
可知,含硫燃料燃烧主要生成二氧化硫,催化氧化为三氧化硫,三氧化硫溶于水
生成硫酸,反应的过程为SO2? SO3? H2SO4,则A物质的化学式为SO2,B物
质的化学式为SO3。
(2)SO2是酸性氧化物,且SO2中硫元素显+4价,它能升高到+6价,具有还原性,依
据氧化还原反应,需要加入氧化剂实现转化,则可让工厂的烟道气通过碱液(如
氨水等)或氧化剂(如酸性KMnO4溶液等)而除去SO2,达到减少污染的目的。
(3)①雨水的pH变小的原因是排放出来的SO2溶于水后生成H2SO3,H2SO3逐渐
被空气中的氧气氧化生成强酸H2SO4,化学方程式为2H2SO3+O2? 2H2SO4。
②因氯气能氧化H2SO3生成硫酸和HCl,两者都是强酸,酸性增强,pH减小,反应
的化学方程式为H2SO3+Cl2+H2O? H2SO4+2HCl。
(4)少用煤作燃料、燃料脱硫、开发新能源等措施可以减少二氧化硫气体的
排放,从而减少酸雨的形成,故①③⑤正确。
1.对于硝酸的物理性质或硝酸的存放,下列叙述不正确的是?( )
A.易溶于水 B.不易挥发
C.有刺激性气味 D.一般保存在棕色试剂瓶中
评价检测·课堂达标
解析???? 硝酸易溶于水,可以与水以任意比互溶,故A正确;硝酸具有挥发性,
故B错误;硝酸是有刺激性气味的液体,故C正确;硝酸见光易分解,所以一般保
存在棕色试剂瓶中,故D正确。
B
2.如图表示酸雨的形成,关于酸雨的下列说法中正确的是?( )
?
A.酸雨的pH为5.6 B.酸雨的形成过程发生了氧化还原反应
C.酸雨的主要成分为氮、硫元素的氧化物 D.形成酸雨的主要原因是雷雨天气
B
解析???? A项,酸雨的pH小于5.6,错误;B项,酸雨的形成过程发生了氧化还原
反应,正确;C项,酸雨的主要成分为氮、硫元素的含氧酸,错误;D项,形成酸雨的
主要原因是氮、硫元素氧化物的排放,错误。
3.在下列反应中,HNO3既表现出氧化性,又表现出酸性的是?( )
A.H2S+2HNO3? S↓+2NO2↑+2H2O
B.CuO+2HNO3? Cu(NO3)2+H2O
C.4HNO3? 4NO2↑+O2↑+2H2O
D.3Cu+8HNO3(稀)? 3Cu(NO3)2+2NO↑+4H2O
D
解析???? HNO3中氮元素化合价由+5降低为+4,只表现氧化性,故A错误;HNO3
中没有元素化合价的变化,只表现酸性,故B错误;HNO3中氮元素化合价由+5
降低为+4,氧元素化合价由-2升高到0,既表现氧化性,又表现还原性,故C错误;
HNO3中部分氮元素化合价由+5降低为+2,生成NO,部分氮元素化合价没变,生
成硝酸铜,既表现氧化性,又表现酸性,故D正确。
4.将铜粉置于稀硫酸中,加热后无明显现象,但加入一种盐后,铜粉质量减少,而
且溶液变蓝,则此盐可能是?( )
A.NaCl B.Na2SO4
C.NaNO3 D.Na2CO3
解析???? NO3-在酸性条件下能将Cu氧化。
C
5.0.3 mol Cu和含1.2 mol HNO3的浓硝酸充分反应后,生成NO2的物质的量为?
( )
A.0.2 mol B.0.6 mol
C.小于0.6 mol D.大于0.6 mol
解析???? 因铜与浓硝酸反应的化学方程式为Cu+4HNO3(浓)? Cu(NO3)2+
2NO2↑+2H2O,随着反应的进行,浓硝酸变稀,铜与稀硝酸反应的化学方程式为
3Cu+8HNO3(稀)? 3Cu(NO3)2+2NO↑+4H2O,所以生成的NO2的物质的量小于
0.6 mol。
C
6.如图所示甲是某学生验证铜和浓硝酸反应的装置,乙、丙是另外两位同学对
甲装置改进后的装置。
?
?
(1)甲、乙、丙三个装置中都发生的反应的化学方程式为
????。
(2)和甲装置相比,乙装置的优点是 ????;
???? ????。
Cu+4HNO3(浓)? Cu(NO3)2+2NO2↑+2H2O
可以控制反应的发生与停止
吸收NO2气体,防止污染环境
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭止水
夹 ????,再打开止水夹 ????,才能使NO2气体充满试管②;当气体充满
试管②后,将铜丝提起与溶液脱离。欲使烧杯中的水进入试管②,应该
????。
c
a、b
先关闭止水夹b,再关闭止水夹a,然后打开止水夹c,用手捂住试管②
解析 (1)铜和浓硝酸反应的化学方程式是Cu+4HNO3(浓)? Cu(NO3)2+2NO2↑+
2H2O。(2)根据题目给定的装置图可知,乙装置有尾气处理装置,同时可以
通过移动铜丝来控制反应的发生与停止。(3)丙装置中,实验时先关闭止水夹c,
再打开止水夹a、b,才能使NO2气体充满试管②;当气体充满试管②后,将铜丝
提起,与溶液脱离停止反应。欲使烧杯中的水进入试管②,应该先关闭止水
夹b,再关闭止水夹a,然后打开止水夹c,用手捂住试管②。
第二节 氮及其化合物
课时3 硝酸 酸雨及防治
学习任务一 硝酸
任务探究·深度学习
新知梳理
自主学习
1.物理性质
硝酸是无色、易① ????、有② ????气味的液体。
挥发
刺激性
2.化学性质
(1)不稳定性
a.化学方程式:③ ????。
b.保存:一般将浓硝酸保存在棕色试剂瓶中,并放置在阴凉处。
(2)强氧化性
a.与金属铜反应
浓硝酸与Cu反应的化学方程式:④ ???????;
稀硝酸与Cu反应的化学方程式:⑤ ??????。
b.常温下,铁、铝的表面被浓硝酸或浓硫酸氧化,生成了一层致密的⑥ ????
薄膜,这层薄膜阻止了酸与内层金属的进一步反应,故常温下可以用铁或
铝制容器来盛装浓硝酸或浓硫酸。
c.王水
组成
浓硝酸和浓盐酸的混合物,体积比为⑦ ????????
特性
能使一些不溶于硝酸的金属如金、铂等溶解
氧化物
1 ∶ 3
3.工业制硝酸
原理:将氨经过一系列反应得到硝酸,如图所示。
?
写出每步反应的化学方程式。
(1)⑧ ????;
(2)⑨ ????;
(3)⑩ ????;
(4)? ????。
判断下列说法的正误(正确的画“√”,错误的画“?”)。
易错辨析
1.硝酸在光照或加热条件下可分解生成二氧化氮气体?( )
2.硝酸可与Na2SO3反应制得SO2?( )
3.浓硝酸、稀硝酸与铜反应均属于置换反应?( )
4.在常温下,浓硫酸和浓硝酸遇Fe和Al无明显现象,说明常温下浓硫酸和浓硝
酸与Fe和Al都不反应?( )
√
?
?
?
1.浓硝酸、稀硝酸与Cu的反应产物分别为NO2、NO,反应中,稀硝酸中氮元素
的化合价降低较多,说明稀硝酸的氧化性比浓硝酸强,对吗?
互动探究
答案 不对,浓硝酸的氧化性比稀硝酸的强,与Cu反应时浓硝酸反应更剧烈。
2.实验室一般将浓硝酸保存在棕色试剂瓶中。如果将浓硝酸取出,发现浓硝酸
呈黄色。这是为什么呢?
?
答案 浓硝酸见光易分解,所以保存在棕色试剂瓶中。浓硝酸见光分解会生
成二氧化氮,溶于浓硝酸呈黄色。
3.《本草纲目拾遗》中记载:“(硝酸)西洋人所造,性最猛,能蚀五金”。王怡
堂先生云:“其水至强,五金八石皆能穿滴,惟玻璃可盛”。上述描述体现了硝
酸的哪些性质呢?
?
答案 酸性和强氧化性。
4.铜投入稀硫酸中不会溶解,再向溶液中投入KNO3固体,铜会不会溶解?为什
么?若将锌投入稀硝酸中,会有氢气生成吗?
答案 铜会溶解。由离子方程式:8H++2N?+3Cu? 3Cu2++2NO↑+4H2O可
知,只要溶液中同时存在H+和N?,铜就会发生反应而溶解。若将锌投入稀硝
酸中,因为硝酸的强氧化性,所以不会有氢气生成,会生成NO等氮的氧化物。
5.如图所示是进行木炭与浓硝酸的反应,并检验生成的气体的实验装置。
?
(1)实验中具支试管A内有什么现象?写出有关反应的化学方程式。
(2)试管B内的澄清石灰水会出现什么现象?水湿棉花处会发生什么反应?
(3)若将木炭与浓硝酸反应产生的气体直接通入少量澄清石灰水中,溶液能否
变浑浊?
答案 (1)木炭保持红热状态,试管内有红棕色气体生成。反应的化学方程式
为C+4HNO3(浓)? 4NO2↑+CO2↑+2H2O。
(2)木炭与浓硝酸反应生成的CO2会使澄清石灰水变浑浊。水湿棉花处发生反
应:3NO2+H2O? NO+2HNO3、CO2+H2O? H2CO3。
(3)木炭与浓硝酸反应产生的气体包括NO2和CO2,NO2溶于水会生成HNO3,
HNO3为强酸,所以不会生成CaCO3,溶液不变浑浊。
6.m g Cu与足量一定浓度的硝酸充分反应,生成V L NO、NO2混合气体(标准状
况下),则参加反应的HNO3的物质的量是多少?
答案 被还原的HNO3无论生成NO还是NO2,均有氮原子的物质的量与被还原
HNO3的物质的量相等;未被还原(起酸性作用)HNO3的物质的量等于Cu(NO3)2
物质的量的2倍,故参加反应的HNO3的物质的量为(?+?) mol。
1.硝酸的强氧化性
(1)硝酸与金属的反应
①除Au、Pt等少数金属外,硝酸几乎可以氧化所有的金属,如3Ag+4HNO3(稀)
? 3AgNO3+NO↑+2H2O。
②活泼金属与硝酸反应不生成H2,硝酸的浓度不同,还原产物不同。
提炼归纳
?
③常温下,浓硝酸能使Fe、Al钝化。
(2)硝酸与非金属的反应
①反应规律:非金属单质+浓硝酸? 最高价氧化物或其含氧酸+NO2↑+H2O。
②实例:C+4HNO3(浓)? CO2↑+4NO2↑+2H2O。
(3)硝酸与还原性化合物或离子的反应:硝酸的强氧化性还表现在可以氧化具
有还原性的化合物或离子,如HI、HBr、SO2、Fe2+、FeO、Br-、I-、S2-、S?
等均能被硝酸氧化。
2.硝酸与金属反应的“三个守恒、一个关系”
(1)三个守恒
①得失电子守恒:n(金属失电子)=n(NO2)+3n(NO)。
②氮原子守恒:n(HNO3)=xn[M(NO3)x]+n(NO2)+n(NO)。
③若向反应后的溶液中加入NaOH溶液,恰好使Mx+沉淀完全,此时溶质为NaNO3,
则存在:n(Na+)=n(N?)=n(HNO3)-n(NO)-n(NO2)。
(2)一个关系:起酸性作用的HNO3的物质的量等于金属的物质的量和金属所带
电荷数的乘积,可表示为n(HNO3)酸性=xn(Mx+)=n(转移电子)。
1.下列有关浓硝酸的说法不正确的是?( )
A.实验室常用浓硝酸与金属锌反应制备氢气
B.在常温下,浓硝酸能使金属铝钝化
C.浓硝酸不稳定,见光或受热易分解,需要避光保存
D.浓硝酸易挥发,打开瓶塞,瓶口有白雾产生
典题精练
解析???? 浓硝酸具有强氧化性,与金属反应时,一般不生成氢气,所以实验室
中不能使用浓硝酸与金属锌反应制备氢气,故A错误。
A
2.下列关于硝酸的叙述中正确的是?( )
A.稀硝酸是弱酸,浓硝酸是强酸
B.铜与浓硝酸和稀硝酸都能发生反应生成二氧化氮
C.浓硝酸能在铁的表面生成氧化膜
D.稀硝酸与活泼金属反应放出氢气,而浓硝酸则使金属钝化
解析???? 稀硝酸和浓硝酸均是强酸,A错误;铜与浓硝酸和稀硝酸都能发生反
应,分别生成NO2和NO,B错误;浓硝酸具有强氧化性,能在铁的表面生成氧化膜,
C正确;硝酸是强氧化性酸,稀硝酸与活泼金属反应不能产生氢气,浓硝酸在常
温下能使铝或铁钝化,D错误。
C
3.现有某硫酸和硝酸的混合溶液20 mL,其中含硫酸的浓度为2 mol/L,含硝酸的
浓度为1 mol/L,现向其中加入0.96 g铜粉,充分反应后(假设只生成NO),最多可
收集到标准状况下的气体的体积为?( )
A.89.6 mL B.112 mL C.168 mL D.224 mL
解析???? 硫酸的浓度为2 mol/L,为稀硫酸,硝酸的浓度为1 mol/L,为稀硝酸,溶
液中能与铜粉反应的为稀硝酸。铜与稀硝酸反应的离子方程式为3Cu+8H++
2N?? 3Cu2++2NO↑+4H2O。Cu的物质的量为? mol=0.015 mol,硝酸根离
子的物质的量为0.02 mol,硝酸和硫酸均提供氢离子,故氢离子的物质的量为
(2×0.02×2+1×0.02)mol=0.1 mol,故氢离子、硝酸根离子均过量,则生成的NO在
标准状况下的体积为(?×0.015×22.4×1 000)mL=224 mL。
D
4.某校课外活动小组为了探究铜与稀硝酸反应产生的是NO,设计了如下实
验。实验装置如图所示(已知NO、NO2能与NaOH溶液反应):
?
(1)设计装置A的目的是 ,
为达此目的应进行的操作是使分液漏斗的凹槽对准小孔,打开K,当装置C中产生白色沉淀时,关闭K。
(2)在(1)中的操作后将装置B中的铜丝插入稀硝酸,微热,观察到装置B中的现
象是 ???;
B中反应的离子方程式是 ????。
(3)将注射器F中的空气推入E中,E中的气体变为红棕色,该实验的目的是 ????
????。
(4)D装置的作用是 ????。
利用生成的CO2将整套装置内的空气排尽,以排除对气体产物检验的干扰????
铜丝上产生气泡,稀硝酸液面上气体呈无色,溶液变为蓝色
验证E中的无色气体为NO
吸收NO、NO2等尾气,防止污染空气
解析 (2)因铜与稀硝酸反应生成硝酸铜、NO和水,反应的离子方程式为3Cu+
8H++2N?? 3Cu2++2NO↑+4H2O,因此实验现象是铜丝上产生气泡,稀硝酸
液面上气体呈无色,溶液变为蓝色。
(3)将F中的空气推入E中,发生反应:2NO+O2? 2NO2,E中无色气体变为红棕
色,证明NO存在,则该实验的目的是验证E中的无色气体为NO。
学习任务二 酸雨及防治
新知梳理
自主学习
1.SO2与NOx的主要来源
(1)SO2主要来自煤、石油的燃烧和某些含硫金属矿物的冶炼。
(2)NOx主要来自机动车尾气(高温条件下氮气和氧气反应生成氮氧化物)。
2.酸雨
(1)概念:pH<① 的雨水。
(2)成因:主要是大气中的② 以及它们在大气中发生反应后的生成物
溶于雨水形成的。
(3)危害
a.直接损伤农作物,破坏森林和草原,使土壤、湖泊酸化。
b.加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀。
5.6
SO2 和NOx
判断下列说法的正误(正确的画“√”,错误的画“?”)。
易错辨析
1.pH<7的降雨均为酸雨?( )
2.CO2和SO2都属于空气污染物?( )
3.因为汽油中含有氮元素,所以汽车尾气中含有NO等氮氧化物?( )
4.二氧化硫和二氧化氮是形成酸雨的主要物质?( )
?
?
?
√
1.呈酸性的雨水就是酸雨吗?收集到的酸雨样品,放置时间稍长,酸性反而越强,
原因是什么?
互动探究
答案 不是,由于溶解了二氧化碳,正常雨水的pH约为5.6,酸雨的pH小于5.6。
酸雨中的H2SO3为弱酸,长时间放置易被O2氧化为酸性更强的H2SO4。
2.生活需要洁净、安全的生存环境,新的《环境空气质量标准》的颁布表明国
家对环境问题的进一步重视。
(1)煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成什么酸?在煤中加入适量
生石灰,可以大大减少煤燃烧时SO2的排放,请你写出涉及反应的化学方程式。
(2)A、B、C三个城市全年雨水的月平均pH变化如图所示。
?
①受酸雨危害最严重的是哪个城市?
②汽车尾气中含有NO2、NO、CO等有害气体。汽车安装尾气净化装置可将
NO、CO转化为无害气体,该反应的化学方程式是什么?
③酸雨分为硝酸型酸雨和硫酸型酸雨。请你写出NO转化为硝酸的反应的化
学方程式。
答案 (1)二氧化硫与水反应生成亚硫酸,亚硫酸不稳定,最终被空气中氧气氧
化为H2SO4。涉及反应的化学方程式为2CaO+2SO2+O2? 2CaSO4。
(2)①pH越小,受到酸雨的危害越严重,从题图中可知,C城市全年雨水的月平均
pH在三个城市中最小,受到酸雨的危害最大。
②反应的化学方程式为2NO+2CO? N2+2CO2。
③2NO+O2? 2NO2、3NO2+H2O? 2HNO3+NO。
酸雨的认识
?
提炼归纳
1.环保部门测得某市空气里的成分有①N2,②O2,③CO2,④Ar,⑤SO2,⑥NO2,⑦可
吸入碳颗粒。其中会导致酸雨的是?????( )
A.③⑤⑥ B.⑤⑥ ????
C.④⑤⑦ D.除①②以外
典题精练
解析???? SO2、NO2易形成酸雨。
B
2.下列说法错误的是?( )
A.空气中的SO2溶于水,最终形成酸雨
B.汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮氧化物
C.工业废水任意排放是造成酸雨的主要原因
D.为了减少酸雨的形成,必须减少SO2的排放量,对燃料脱硫处理
解析???? 工业废水任意排放引起江、河、湖泊污染,而酸雨是由大量SO2和
NOx溶于雨水形成的。
C
3.硫酸型酸雨的形成原理可简化表示如下图所示:
?
回答下列问题:
(1)A物质的化学式为 ????,B物质的化学式为 ????。
SO2
SO3
(2)根据SO2的性质,可让工厂的烟道气通过 ???? 或氧化剂等除去SO2,
达到减少污染的目的。
(3)现有雨水样品1份,常温下,每隔一段时间测定该雨水样品的pH,所得数据如
下:
测试时间/h
0
1
2
3
4
雨水的pH
4.73
4.62
4.56
4.55
4.55
碱液(如氨水等)
注:溶液的pH越大,H+的物质的量浓度就越小。
①雨水样品的pH变化的原因是 ????(用化学方程
式表示)。
②如果将刚取样的上述雨水和用氯气消毒的自来水相混合,pH将 ????(填
“增大”“减小”或“不变”),原因是 ????(用
化学方程式表示)。
(4)你认为减少酸雨产生可采用的措施是 ????(填序号)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加
石灰 ⑤开发新能源
2H2SO3+O2? 2H2SO4
减小
H2SO3+Cl2+H2O? H2SO4+2HCl
① ③⑤
解析 (1)硫酸型酸雨是含硫物质燃烧生成的二氧化硫引起的,依据流程分析
可知,含硫燃料燃烧主要生成二氧化硫,催化氧化为三氧化硫,三氧化硫溶于水
生成硫酸,反应的过程为SO2? SO3? H2SO4,则A物质的化学式为SO2,B物
质的化学式为SO3。
(2)SO2是酸性氧化物,且SO2中硫元素显+4价,它能升高到+6价,具有还原性,依
据氧化还原反应,需要加入氧化剂实现转化,则可让工厂的烟道气通过碱液(如
氨水等)或氧化剂(如酸性KMnO4溶液等)而除去SO2,达到减少污染的目的。
(3)①雨水的pH变小的原因是排放出来的SO2溶于水后生成H2SO3,H2SO3逐渐
被空气中的氧气氧化生成强酸H2SO4,化学方程式为2H2SO3+O2? 2H2SO4。
②因氯气能氧化H2SO3生成硫酸和HCl,两者都是强酸,酸性增强,pH减小,反应
的化学方程式为H2SO3+Cl2+H2O? H2SO4+2HCl。
(4)少用煤作燃料、燃料脱硫、开发新能源等措施可以减少二氧化硫气体的
排放,从而减少酸雨的形成,故①③⑤正确。
1.对于硝酸的物理性质或硝酸的存放,下列叙述不正确的是?( )
A.易溶于水 B.不易挥发
C.有刺激性气味 D.一般保存在棕色试剂瓶中
评价检测·课堂达标
解析???? 硝酸易溶于水,可以与水以任意比互溶,故A正确;硝酸具有挥发性,
故B错误;硝酸是有刺激性气味的液体,故C正确;硝酸见光易分解,所以一般保
存在棕色试剂瓶中,故D正确。
B
2.如图表示酸雨的形成,关于酸雨的下列说法中正确的是?( )
?
A.酸雨的pH为5.6 B.酸雨的形成过程发生了氧化还原反应
C.酸雨的主要成分为氮、硫元素的氧化物 D.形成酸雨的主要原因是雷雨天气
B
解析???? A项,酸雨的pH小于5.6,错误;B项,酸雨的形成过程发生了氧化还原
反应,正确;C项,酸雨的主要成分为氮、硫元素的含氧酸,错误;D项,形成酸雨的
主要原因是氮、硫元素氧化物的排放,错误。
3.在下列反应中,HNO3既表现出氧化性,又表现出酸性的是?( )
A.H2S+2HNO3? S↓+2NO2↑+2H2O
B.CuO+2HNO3? Cu(NO3)2+H2O
C.4HNO3? 4NO2↑+O2↑+2H2O
D.3Cu+8HNO3(稀)? 3Cu(NO3)2+2NO↑+4H2O
D
解析???? HNO3中氮元素化合价由+5降低为+4,只表现氧化性,故A错误;HNO3
中没有元素化合价的变化,只表现酸性,故B错误;HNO3中氮元素化合价由+5
降低为+4,氧元素化合价由-2升高到0,既表现氧化性,又表现还原性,故C错误;
HNO3中部分氮元素化合价由+5降低为+2,生成NO,部分氮元素化合价没变,生
成硝酸铜,既表现氧化性,又表现酸性,故D正确。
4.将铜粉置于稀硫酸中,加热后无明显现象,但加入一种盐后,铜粉质量减少,而
且溶液变蓝,则此盐可能是?( )
A.NaCl B.Na2SO4
C.NaNO3 D.Na2CO3
解析???? NO3-在酸性条件下能将Cu氧化。
C
5.0.3 mol Cu和含1.2 mol HNO3的浓硝酸充分反应后,生成NO2的物质的量为?
( )
A.0.2 mol B.0.6 mol
C.小于0.6 mol D.大于0.6 mol
解析???? 因铜与浓硝酸反应的化学方程式为Cu+4HNO3(浓)? Cu(NO3)2+
2NO2↑+2H2O,随着反应的进行,浓硝酸变稀,铜与稀硝酸反应的化学方程式为
3Cu+8HNO3(稀)? 3Cu(NO3)2+2NO↑+4H2O,所以生成的NO2的物质的量小于
0.6 mol。
C
6.如图所示甲是某学生验证铜和浓硝酸反应的装置,乙、丙是另外两位同学对
甲装置改进后的装置。
?
?
(1)甲、乙、丙三个装置中都发生的反应的化学方程式为
????。
(2)和甲装置相比,乙装置的优点是 ????;
???? ????。
Cu+4HNO3(浓)? Cu(NO3)2+2NO2↑+2H2O
可以控制反应的发生与停止
吸收NO2气体,防止污染环境
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭止水
夹 ????,再打开止水夹 ????,才能使NO2气体充满试管②;当气体充满
试管②后,将铜丝提起与溶液脱离。欲使烧杯中的水进入试管②,应该
????。
c
a、b
先关闭止水夹b,再关闭止水夹a,然后打开止水夹c,用手捂住试管②
解析 (1)铜和浓硝酸反应的化学方程式是Cu+4HNO3(浓)? Cu(NO3)2+2NO2↑+
2H2O。(2)根据题目给定的装置图可知,乙装置有尾气处理装置,同时可以
通过移动铜丝来控制反应的发生与停止。(3)丙装置中,实验时先关闭止水夹c,
再打开止水夹a、b,才能使NO2气体充满试管②;当气体充满试管②后,将铜丝
提起,与溶液脱离停止反应。欲使烧杯中的水进入试管②,应该先关闭止水
夹b,再关闭止水夹a,然后打开止水夹c,用手捂住试管②。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
