高中化学人教版2019必修1第一章物质及其变化单元小结45 PPT
文档属性
| 名称 | 高中化学人教版2019必修1第一章物质及其变化单元小结45 PPT |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-08 08:43:37 | ||
图片预览






文档简介
(单元小结)
(1)树状分类法 是对同类物质按照属性进一步细分的方法;
1、常用方法的物质的分类
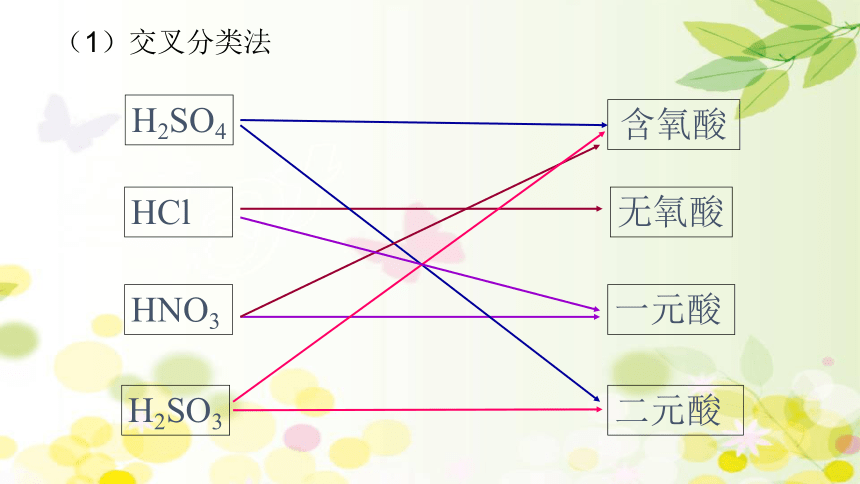
(2)交叉分类法:按照事物表现的不同属性,将一种事物按多种标准进行分类的方法.
一、物质的分类方法
树状分类图的分类原则:同一层次的物质类别间一般是相互独立,没有交叉的。
(1)交叉分类法
含氧酸
无氧酸
一元酸
二元酸
H2SO4
HCl
HNO3
H2SO3
物质
纯净物
混合物
单质
化合物
金属
非金属
Na、Mg、Al
S、O2、N2
氧化物
酸
碱
盐
酸性氧化物
碱性氧化物
两性氧化物
不成盐氧化物
SO2、CO2、P2O5
Na2O、CaO、Fe2O3
Al2O3
CO、NO
按酸根分
含氧酸
无氧酸
HNO3 、H2SO4
HCl
按电离出
的H+数分
一元酸
二元酸
三元酸
HCl
HNO3
H2SO4
H2SO3
H3PO4
按强弱分
强碱
弱碱
NaOH、Ba(OH)2
NH3H2O、Fe(OH)3
按电离出
的OH数分
一元碱
二元碱
三元碱
NaOH
Ba(OH)2
Fe(OH)3
正盐
酸式盐
碱式盐
Na2CO3
NaHCO3
Cu2(OH)2CO3
Al(OH)3
(2)树状分类法
氧化物的分类
金属氧化物:
非金属氧化物:
氧化物
CuO MgO CaO
CO2 SO2
碱性氧化物:
定义:元素与氧化合生成的化合物。有且只有两种元素组成
能跟酸起反应只生成盐和水的氧化物
能跟碱起反应只生成盐和水的氧化物
酸性氧化物:
两性氧化物:
不成盐氧化物:
同时能跟碱和酸起反应只生成盐和水
既不跟酸反应也不跟碱反应的氧化物
H2O、NO、CO、N2O、NO2、MnO2
Al2O3 : Al2O3+2NaOH=2NaAlO2+H2O
SO3、P2O5、Mn2O7、CrO3
Na2O、CaO、Fe2O3、CrO、MnO
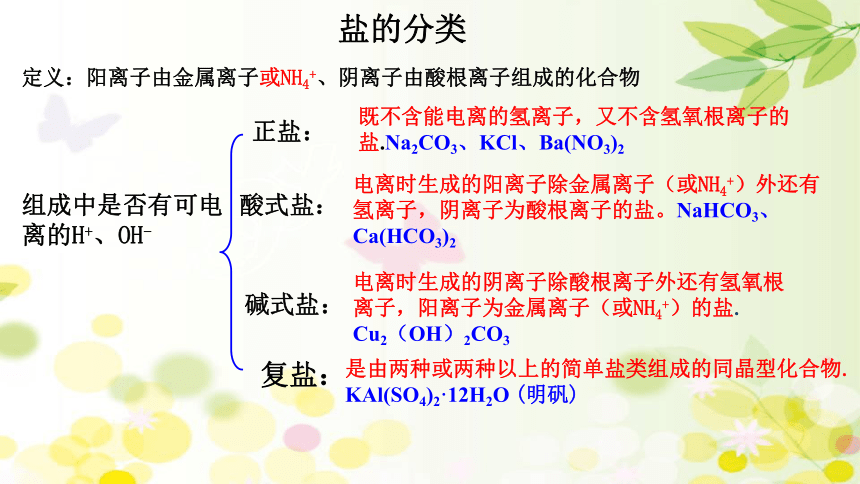
盐的分类
正盐:
酸式盐:
碱式盐:
组成中是否有可电离的H+、OH-
复盐:
既不含能电离的氢离子,又不含氢氧根离子的盐.Na2CO3、KCl、Ba(NO3)2
电离时生成的阳离子除金属离子(或NH4+)外还有氢离子,阴离子为酸根离子的盐。NaHCO3、Ca(HCO3)2
电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或NH4+)的盐.
Cu2(OH)2CO3
是由两种或两种以上的简单盐类组成的同晶型化合物. KAl(SO4)2·12H2O (明矾)
定义:阳离子由金属离子或NH4+、阴离子由酸根离子组成的化合物
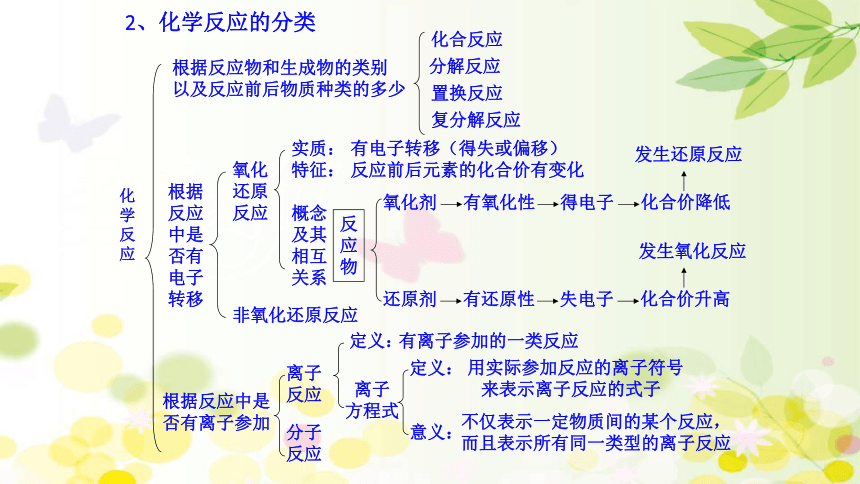
2、化学反应的分类
化
学
反
应
根据反应物和生成物的类别
以及反应前后物质种类的多少
化合反应
分解反应
置换反应
复分解反应
根据
反应
中是
否有
电子
转移
氧化
还原
反应
非氧化还原反应
实质:
有电子转移(得失或偏移)
特征:
反应前后元素的化合价有变化
概念
及其
相互
关系
反
应
物
氧化剂
还原剂
有氧化性
得电子
化合价降低
有还原性
失电子
化合价升高
根据反应中是
否有离子参加
离子
反应
分子
反应
定义:
有离子参加的一类反应
离子
方程式
定义:
用实际参加反应的离子符号
来表示离子反应的式子
意义:
不仅表示一定物质间的某个反应,
而且表示所有同一类型的离子反应
发生还原反应
发生氧化反应
二、分散系
1、分散系的组成与分类
分散质
分散剂
组成
分
散
系
分类
溶液
浊液
胶体
悬浊液
乳浊液
分散系:把一种(或)多种物质分散在另一种(或多种)物质中得到的体系。
分散质:被分散的物质;
分散剂:容纳分散质的物质。
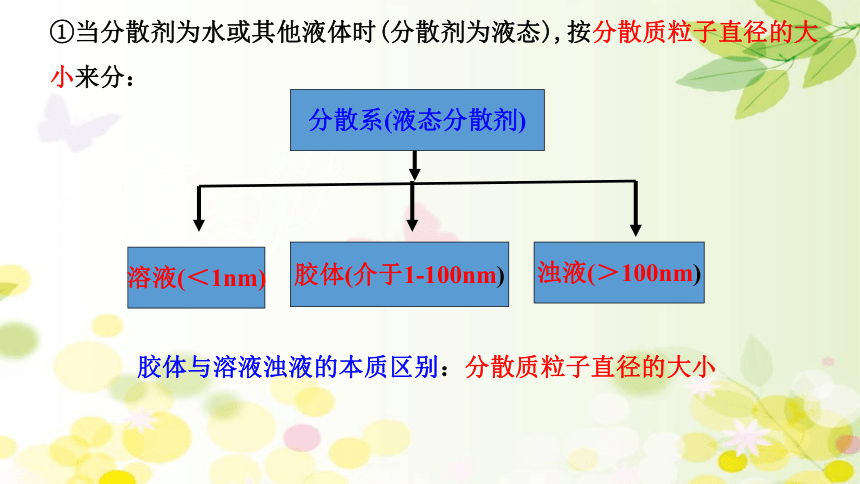
①当分散剂为水或其他液体时(分散剂为液态),按分散质粒子直径的大小来分:
分散系(液态分散剂)
溶液(<1nm)
胶体(介于1-100nm)
浊液(>100nm)
胶体与溶液浊液的本质区别:分散质粒子直径的大小
分散系类别
溶液
胶体
浊液
分散质
粒子直径
粒子组成
分子或离子
分子集合体或高分子
巨大的分子集合体
外观特征
稳定性
能否透过滤纸
能否透过半透膜
实例
氨水、碘酒
肥皂水、AgI胶体
石灰乳
均一、透明
均一、透明
不均一、不透明
〈1nm
1~100nm
>100nm
稳定(介稳体系)
不稳定
稳定
能
能
能
不能
不能
不能
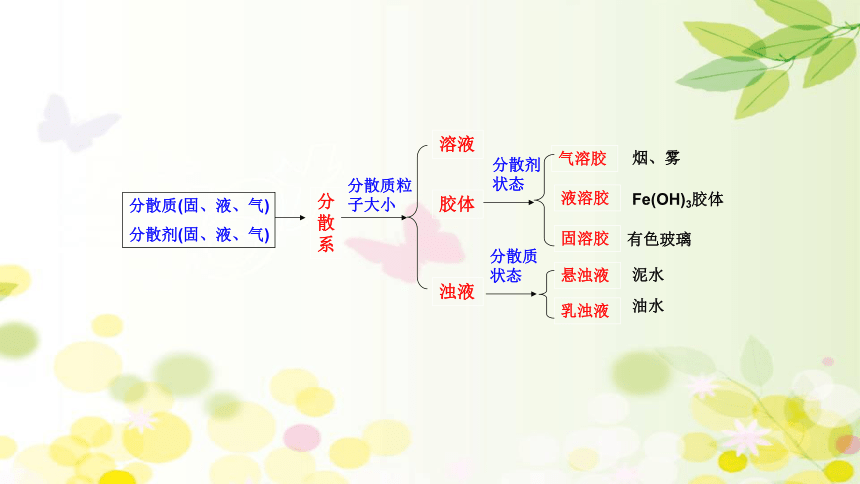
分散质(固、液、气)
分散剂(固、液、气)
分散系
溶液
胶体
浊液
气溶胶
液溶胶
固溶胶
悬浊液
乳浊液
烟、雾
有色玻璃
泥水
油水
分散质粒子大小
分散剂状态
分散质状态
Fe(OH)3胶体
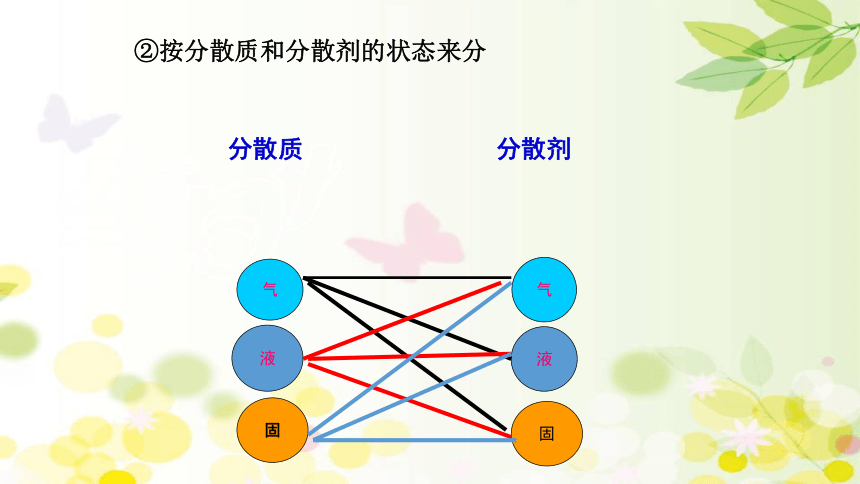
②按分散质和分散剂的状态来分
分散质
分散剂
气
液
固
气
液
固
分散质
分散剂
实 例
气
气
液
气
固
气
气
液
液
液
固
液
气
固
液
固
固
固
空气
云、雾
烟、灰尘
泡沫
牛奶、酒精的水溶液
油漆
泡沫塑料
珍珠(包藏着水的碳酸钙)
有色玻璃、合金
九种组合方式实例分析
(2)胶体的分类
根据分散质微粒的构成
粒子胶体:Fe(OH)3胶体、AgI胶体
分子胶体:淀粉溶液、蛋白质溶液
根据分散剂
的状态
气溶胶:烟、云、雾
液溶胶:AgI胶体、Fe(OH)3胶体
固溶胶:有色玻璃、烟水晶
胶体
2、胶体
(1)定义:
分散质微粒的直径大小在1nm—100nm之间的分散系叫 胶体 。
取一个小烧杯,加入25 mL蒸馏水,加热至沸腾,然后向沸水中滴加5~6滴FeCl3饱和溶液。继续煮沸至溶液呈红褐色后,停止加热,即制得Fe(OH)3胶体。
氢氧化铁胶体的制备:
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
★注意:①加热至溶液呈红褐色后停止加热
★注意:②不用“↓”,写胶体
实验:分别用激光照射盛硫酸铜溶液和氢氧化铁胶体的烧杯,在光束垂直的方向观察现象。并完成下列表格:
?
光束照射时的现象
Fe(OH)3胶体
?
CuSO4溶液
?
有光亮通路
无光亮通路
产生的原因----光的散射
硫酸铜溶液
氢氧化铁胶体
胶体的特性:
丁达尔现象
一束光通过胶体时,从侧面可观察到胶体里产生一条光亮的“通路”。
胶体的应用
(1)静电除尘
(2)土壤的保肥
(3)石膏或卤水点豆腐、制造果冻和皮冻
(4)明矾净水原理
(5)江河入海处形成沙洲
(6)使用蓝色墨水的钢笔抽黑色墨水容易堵塞
(7)喝豆浆放糖不放盐
……
常见胶体及其应用
二、离子反应
1:电解质与非电解质
电解质:在水溶液中或者熔融状态下能够导电的化合物就叫做电解质
非电解质:在水溶液中和熔融状态下都不能导电的化合物就叫做非电解质
注意
1. 电解质、非电解质是化合物,单质既不是电解质也不是非电解质;
2.溶于水或熔融状态下能导电,只要具备其中之一即是电解质。
3.非电解质在水溶液和熔融状态下都不导电,两条件同时具备才是非电解质。
4.能导电的物质不一定是电解质。如:Cu
5.非电解质一定不导电,但它的“水溶液”可能导电。如:CO2,NH3,SO3
思考:为什么电解质在水溶液或熔融状态下能导电?
因为电解质在水溶液或熔融状态下自身发生了电离,产生了能够自由移动的离子。
NaCl=Na+ + Cl-
2:电离
(1)定义:
电解质溶解于水或受热熔化时,离解成自由移动的离子的过程。
(2)电离方程式
用离子符号表示电解质电离的式子
电离方程式书写原则:
a.遵守质量守恒和电荷守恒
b.原子团不能拆开
电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
电离时生成的阴离子全部是氢氧根(OH-)的化合物叫做碱。
电离时生成金属阳离子(或铵根离子)和酸根离子的化合物叫做盐。
3:离子反应
(1)定义:有离子参加或者生成的反应叫做离子反应。(在水溶液中的反应)
(2)离子方程式:用实际参加反应的离子符号来表示反应的式子叫做离子反应方程式。(只有在水溶液中才能写离子方程式)
(3)离子反应发生的条件:
1.生成难溶物(沉淀)
如:硝酸银溶液和氯化钠溶液
2.难电离物质(弱酸、弱碱、H2O等)
如:盐酸和氢氧化钠溶液
3.生成气体
如:碳酸钙和稀盐酸
4. 发生了氧化还原反应
如: 氯化铁溶液和铁粉
复分解型离子反应
(4)离子反应方程式的书写步骤:
1、写,写出化学方程式
2、拆,易溶于水、易电离的物质拆成离子形式.(即强酸、强碱、可溶性盐拆,其它均不拆)
3、删,删去两边没反应的离子
4、查,检查方程式两边各元素的原子个数和电荷总数是否相等。
拆——易溶且易电离
①强酸:HCl、H2SO4、HNO3等;
②强碱:KOH、NaOH、Ba(OH)2等
钾盐、钠盐、铵盐、硝酸盐全溶
SO42-除Ba2+(Ca2+、Ag+ 微溶)
Cl-除Ag+
CO32-只溶K+、Na+、NH4+(Mg2+微溶)
OH-只溶K+、Na+、Ba2+(Ca2+微溶)
③可溶性盐(背诵溶解性表)。
不拆——难溶或难电离、气体、单质、氧化物
①难溶的物质:如 CaCO3、BaSO4、AgCl、Cu(OH)2等。
②难电离的物质:如CH3COOH(弱酸)、NH3·H2O(弱碱)、H2O等。
③气体:如 H2S、CO2、SO2等。
④单质:如 H2、Na、I2等。
⑤氧化物:如 Na2O、Fe2O3等。
Ca(OH)2是微溶物,作反应物时,浓度小(澄清)写离子形式,浓度大时(石灰乳)写出分子式;作生成物时,写分子式。
(5)离子反应方程式表示的意义
离子反应方程式的意义:不仅可表示某一个具体的化学反应,而且可表示同一类型的反应。
(6)离子共存问题
所谓离子在同一溶液中能大量共存,就是离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存
1、相互结合成难溶物质的离子不能大量共存。
如:Ba2+和SO42- Ag+ 和Cl- Ca2+和CO32-
2、相互结合成气体或挥发性物质的离子不能大量共存
如:H+与CO32— 、SO32—、S2—
3、相互结合成难电离物质的离子不能大量共存
如:H+与 CH3COO-、F-、OH-、ClO-;OH- 与NH4+
4、弱酸酸式根离子与H+、OH—均不能大量共存
注:无色溶液时应排除:浅绿色Fe2+ 、黄色Fe3+ 蓝色Cu2+ 、紫色MnO4-、酸性溶液,有大量H+;碱性溶液,有大量OH-
离子方程式书写步骤速记口诀:
要写离子方程式,先写化学方程式;
单质沉淀气弱质,仍然保留化学式;
可溶可离电解质,离子符号来表示;
消去相同的离子,检查守恒就完事。
离子方程式正误判断:
三、氧化还原反应
氧化还原反应
还原剂(还原性)
氧化剂(氧化性)
氧化反应
还原反应
得氧
升高
失电子
电子对偏离
失氧
降低
得电子
电子对偏向
得失氧
化合价
电子转移
特殊
普遍
实质
氧化还原反应的本质是电子转移,特征是化合价变化。“氧化”和“还原” 同时存在、不可分割的。
1:定义:有电子转移(得失或偏移)的化学反应是氧化还原反应。
基本概念
失电子
价升
还原性
被氧化
得电子
价降
氧化性
被还原
还原剂
氧化产物
氧化剂
还原产物
失去2×3e-,化合价升高,被氧化
得到2×3e-,化合价降低,被还原
0
+3
0
+3
氧化剂
还原产物
氧化产物
2Al + Fe2O3 2Fe + A l2O3
?
还原剂
2:氧化还原反应中电子转移的表示方法
0
0
+1 -1
失2×e-,化合价升高,被氧化
2Na+Cl2 2NaCl
点燃
得2×e-,化合价降低,被还原
双线桥法
①标出化合价
②画桥
箭号从反应物指向生成物,起止为同一种元素(双线桥连接不同价态的同种元素)
③电子得失总数相等。
4Al + 3O2 == 2Al2O3
0
+3
0
-2
失4×3e-,化合价升高,被氧化
得6×2e-,化合价降低,被还原
氧化剂
还原剂
还原产物
氧化产物
点燃
氧化剂+还原剂→还原产物+氧化产物
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
②2KClO3 2KCl+3O2↑
?2Al + Fe2O3 2Fe + A l2O3
?
失去2×3e-,化合价升高,被氧化
得到2×3e-,化合价降低,被还原,
0
+3
0
+3
12e-
只要标明电子转移的数目(不要标明“得、失”电子)由失电子元素指向得电子元素
单桥法
?2Al + Fe2O3 2Fe + A l2O3
?
失去2×3e-,化合价升高,被氧化
得到2×3e-,化合价降低,被还原,
0
+3
0
+3
6e-
单线桥法
用双线桥法、单桥法分析氧化还原反应
②3Cu + 8HNO3(稀) 3Cu(NO3)2+ 2 NO↑+ 4H2O
0
+2
+2
+5
得到2×3e-,化合价降低,被还原
失去3×2e-,化合价升高,被氧化
6e-
3:常见的氧化剂和还原剂
③有较高化合价元素的化合物: HNO3、H2SO4(浓)、KMnO4、MnO2等。
②含高价金属离子的化合物:FeCl3
①活泼的非金属单质: O2 、Cl2、Br2等。
氧化剂:
?④含有较低化合价元素的化合物:H2S、Na2S、 NH3、CO、SO2、Na2SO3等。
还原剂:
①金属单质:Na、 Mg、Al、Fe、Zn等。
②某些非金属:H2、C等。
③含低价金属离子的化合物:FeCl2等。
化合反应
分解反应
置换反应
复分解反应
化学基本反应类型
化学反应
氧化还原反应
非氧化还原反应
氧化还原反应与四种基本类型反应关系
氧化还原反应
分解反应
置换反应
化合反应
氧化还原反应中的守恒
氧化性:氧化剂得电子的性质,使其它物质被氧化
还原性:还原剂失电子的性质,使其它物质被还原
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
+4 -1 +2 0
失2×e-,化合价升高,被氧化
得2e-,化合价降低,被还原
质量守恒;电荷守恒;得失电子守恒
氧化还原反应中的易错误区
1.有单质参与或生成的反应不一定是氧化还原反应。如“红磷——白磷”等同素异形体之间的转化。
2.某元素由化合态变为游离态时,该元素不一定被还原,如Cl-→Cl2中氯元素被氧化。
3.在氧化还原反应中大部分非金属单质往往既具有氧化性又具有还原性,只是以氧化性为主,但F2只有氧化性。
(1)树状分类法 是对同类物质按照属性进一步细分的方法;
1、常用方法的物质的分类
(2)交叉分类法:按照事物表现的不同属性,将一种事物按多种标准进行分类的方法.
一、物质的分类方法
树状分类图的分类原则:同一层次的物质类别间一般是相互独立,没有交叉的。
(1)交叉分类法
含氧酸
无氧酸
一元酸
二元酸
H2SO4
HCl
HNO3
H2SO3
物质
纯净物
混合物
单质
化合物
金属
非金属
Na、Mg、Al
S、O2、N2
氧化物
酸
碱
盐
酸性氧化物
碱性氧化物
两性氧化物
不成盐氧化物
SO2、CO2、P2O5
Na2O、CaO、Fe2O3
Al2O3
CO、NO
按酸根分
含氧酸
无氧酸
HNO3 、H2SO4
HCl
按电离出
的H+数分
一元酸
二元酸
三元酸
HCl
HNO3
H2SO4
H2SO3
H3PO4
按强弱分
强碱
弱碱
NaOH、Ba(OH)2
NH3H2O、Fe(OH)3
按电离出
的OH数分
一元碱
二元碱
三元碱
NaOH
Ba(OH)2
Fe(OH)3
正盐
酸式盐
碱式盐
Na2CO3
NaHCO3
Cu2(OH)2CO3
Al(OH)3
(2)树状分类法
氧化物的分类
金属氧化物:
非金属氧化物:
氧化物
CuO MgO CaO
CO2 SO2
碱性氧化物:
定义:元素与氧化合生成的化合物。有且只有两种元素组成
能跟酸起反应只生成盐和水的氧化物
能跟碱起反应只生成盐和水的氧化物
酸性氧化物:
两性氧化物:
不成盐氧化物:
同时能跟碱和酸起反应只生成盐和水
既不跟酸反应也不跟碱反应的氧化物
H2O、NO、CO、N2O、NO2、MnO2
Al2O3 : Al2O3+2NaOH=2NaAlO2+H2O
SO3、P2O5、Mn2O7、CrO3
Na2O、CaO、Fe2O3、CrO、MnO
盐的分类
正盐:
酸式盐:
碱式盐:
组成中是否有可电离的H+、OH-
复盐:
既不含能电离的氢离子,又不含氢氧根离子的盐.Na2CO3、KCl、Ba(NO3)2
电离时生成的阳离子除金属离子(或NH4+)外还有氢离子,阴离子为酸根离子的盐。NaHCO3、Ca(HCO3)2
电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或NH4+)的盐.
Cu2(OH)2CO3
是由两种或两种以上的简单盐类组成的同晶型化合物. KAl(SO4)2·12H2O (明矾)
定义:阳离子由金属离子或NH4+、阴离子由酸根离子组成的化合物
2、化学反应的分类
化
学
反
应
根据反应物和生成物的类别
以及反应前后物质种类的多少
化合反应
分解反应
置换反应
复分解反应
根据
反应
中是
否有
电子
转移
氧化
还原
反应
非氧化还原反应
实质:
有电子转移(得失或偏移)
特征:
反应前后元素的化合价有变化
概念
及其
相互
关系
反
应
物
氧化剂
还原剂
有氧化性
得电子
化合价降低
有还原性
失电子
化合价升高
根据反应中是
否有离子参加
离子
反应
分子
反应
定义:
有离子参加的一类反应
离子
方程式
定义:
用实际参加反应的离子符号
来表示离子反应的式子
意义:
不仅表示一定物质间的某个反应,
而且表示所有同一类型的离子反应
发生还原反应
发生氧化反应
二、分散系
1、分散系的组成与分类
分散质
分散剂
组成
分
散
系
分类
溶液
浊液
胶体
悬浊液
乳浊液
分散系:把一种(或)多种物质分散在另一种(或多种)物质中得到的体系。
分散质:被分散的物质;
分散剂:容纳分散质的物质。
①当分散剂为水或其他液体时(分散剂为液态),按分散质粒子直径的大小来分:
分散系(液态分散剂)
溶液(<1nm)
胶体(介于1-100nm)
浊液(>100nm)
胶体与溶液浊液的本质区别:分散质粒子直径的大小
分散系类别
溶液
胶体
浊液
分散质
粒子直径
粒子组成
分子或离子
分子集合体或高分子
巨大的分子集合体
外观特征
稳定性
能否透过滤纸
能否透过半透膜
实例
氨水、碘酒
肥皂水、AgI胶体
石灰乳
均一、透明
均一、透明
不均一、不透明
〈1nm
1~100nm
>100nm
稳定(介稳体系)
不稳定
稳定
能
能
能
不能
不能
不能
分散质(固、液、气)
分散剂(固、液、气)
分散系
溶液
胶体
浊液
气溶胶
液溶胶
固溶胶
悬浊液
乳浊液
烟、雾
有色玻璃
泥水
油水
分散质粒子大小
分散剂状态
分散质状态
Fe(OH)3胶体
②按分散质和分散剂的状态来分
分散质
分散剂
气
液
固
气
液
固
分散质
分散剂
实 例
气
气
液
气
固
气
气
液
液
液
固
液
气
固
液
固
固
固
空气
云、雾
烟、灰尘
泡沫
牛奶、酒精的水溶液
油漆
泡沫塑料
珍珠(包藏着水的碳酸钙)
有色玻璃、合金
九种组合方式实例分析
(2)胶体的分类
根据分散质微粒的构成
粒子胶体:Fe(OH)3胶体、AgI胶体
分子胶体:淀粉溶液、蛋白质溶液
根据分散剂
的状态
气溶胶:烟、云、雾
液溶胶:AgI胶体、Fe(OH)3胶体
固溶胶:有色玻璃、烟水晶
胶体
2、胶体
(1)定义:
分散质微粒的直径大小在1nm—100nm之间的分散系叫 胶体 。
取一个小烧杯,加入25 mL蒸馏水,加热至沸腾,然后向沸水中滴加5~6滴FeCl3饱和溶液。继续煮沸至溶液呈红褐色后,停止加热,即制得Fe(OH)3胶体。
氢氧化铁胶体的制备:
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
★注意:①加热至溶液呈红褐色后停止加热
★注意:②不用“↓”,写胶体
实验:分别用激光照射盛硫酸铜溶液和氢氧化铁胶体的烧杯,在光束垂直的方向观察现象。并完成下列表格:
?
光束照射时的现象
Fe(OH)3胶体
?
CuSO4溶液
?
有光亮通路
无光亮通路
产生的原因----光的散射
硫酸铜溶液
氢氧化铁胶体
胶体的特性:
丁达尔现象
一束光通过胶体时,从侧面可观察到胶体里产生一条光亮的“通路”。
胶体的应用
(1)静电除尘
(2)土壤的保肥
(3)石膏或卤水点豆腐、制造果冻和皮冻
(4)明矾净水原理
(5)江河入海处形成沙洲
(6)使用蓝色墨水的钢笔抽黑色墨水容易堵塞
(7)喝豆浆放糖不放盐
……
常见胶体及其应用
二、离子反应
1:电解质与非电解质
电解质:在水溶液中或者熔融状态下能够导电的化合物就叫做电解质
非电解质:在水溶液中和熔融状态下都不能导电的化合物就叫做非电解质
注意
1. 电解质、非电解质是化合物,单质既不是电解质也不是非电解质;
2.溶于水或熔融状态下能导电,只要具备其中之一即是电解质。
3.非电解质在水溶液和熔融状态下都不导电,两条件同时具备才是非电解质。
4.能导电的物质不一定是电解质。如:Cu
5.非电解质一定不导电,但它的“水溶液”可能导电。如:CO2,NH3,SO3
思考:为什么电解质在水溶液或熔融状态下能导电?
因为电解质在水溶液或熔融状态下自身发生了电离,产生了能够自由移动的离子。
NaCl=Na+ + Cl-
2:电离
(1)定义:
电解质溶解于水或受热熔化时,离解成自由移动的离子的过程。
(2)电离方程式
用离子符号表示电解质电离的式子
电离方程式书写原则:
a.遵守质量守恒和电荷守恒
b.原子团不能拆开
电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
电离时生成的阴离子全部是氢氧根(OH-)的化合物叫做碱。
电离时生成金属阳离子(或铵根离子)和酸根离子的化合物叫做盐。
3:离子反应
(1)定义:有离子参加或者生成的反应叫做离子反应。(在水溶液中的反应)
(2)离子方程式:用实际参加反应的离子符号来表示反应的式子叫做离子反应方程式。(只有在水溶液中才能写离子方程式)
(3)离子反应发生的条件:
1.生成难溶物(沉淀)
如:硝酸银溶液和氯化钠溶液
2.难电离物质(弱酸、弱碱、H2O等)
如:盐酸和氢氧化钠溶液
3.生成气体
如:碳酸钙和稀盐酸
4. 发生了氧化还原反应
如: 氯化铁溶液和铁粉
复分解型离子反应
(4)离子反应方程式的书写步骤:
1、写,写出化学方程式
2、拆,易溶于水、易电离的物质拆成离子形式.(即强酸、强碱、可溶性盐拆,其它均不拆)
3、删,删去两边没反应的离子
4、查,检查方程式两边各元素的原子个数和电荷总数是否相等。
拆——易溶且易电离
①强酸:HCl、H2SO4、HNO3等;
②强碱:KOH、NaOH、Ba(OH)2等
钾盐、钠盐、铵盐、硝酸盐全溶
SO42-除Ba2+(Ca2+、Ag+ 微溶)
Cl-除Ag+
CO32-只溶K+、Na+、NH4+(Mg2+微溶)
OH-只溶K+、Na+、Ba2+(Ca2+微溶)
③可溶性盐(背诵溶解性表)。
不拆——难溶或难电离、气体、单质、氧化物
①难溶的物质:如 CaCO3、BaSO4、AgCl、Cu(OH)2等。
②难电离的物质:如CH3COOH(弱酸)、NH3·H2O(弱碱)、H2O等。
③气体:如 H2S、CO2、SO2等。
④单质:如 H2、Na、I2等。
⑤氧化物:如 Na2O、Fe2O3等。
Ca(OH)2是微溶物,作反应物时,浓度小(澄清)写离子形式,浓度大时(石灰乳)写出分子式;作生成物时,写分子式。
(5)离子反应方程式表示的意义
离子反应方程式的意义:不仅可表示某一个具体的化学反应,而且可表示同一类型的反应。
(6)离子共存问题
所谓离子在同一溶液中能大量共存,就是离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存
1、相互结合成难溶物质的离子不能大量共存。
如:Ba2+和SO42- Ag+ 和Cl- Ca2+和CO32-
2、相互结合成气体或挥发性物质的离子不能大量共存
如:H+与CO32— 、SO32—、S2—
3、相互结合成难电离物质的离子不能大量共存
如:H+与 CH3COO-、F-、OH-、ClO-;OH- 与NH4+
4、弱酸酸式根离子与H+、OH—均不能大量共存
注:无色溶液时应排除:浅绿色Fe2+ 、黄色Fe3+ 蓝色Cu2+ 、紫色MnO4-、酸性溶液,有大量H+;碱性溶液,有大量OH-
离子方程式书写步骤速记口诀:
要写离子方程式,先写化学方程式;
单质沉淀气弱质,仍然保留化学式;
可溶可离电解质,离子符号来表示;
消去相同的离子,检查守恒就完事。
离子方程式正误判断:
三、氧化还原反应
氧化还原反应
还原剂(还原性)
氧化剂(氧化性)
氧化反应
还原反应
得氧
升高
失电子
电子对偏离
失氧
降低
得电子
电子对偏向
得失氧
化合价
电子转移
特殊
普遍
实质
氧化还原反应的本质是电子转移,特征是化合价变化。“氧化”和“还原” 同时存在、不可分割的。
1:定义:有电子转移(得失或偏移)的化学反应是氧化还原反应。
基本概念
失电子
价升
还原性
被氧化
得电子
价降
氧化性
被还原
还原剂
氧化产物
氧化剂
还原产物
失去2×3e-,化合价升高,被氧化
得到2×3e-,化合价降低,被还原
0
+3
0
+3
氧化剂
还原产物
氧化产物
2Al + Fe2O3 2Fe + A l2O3
?
还原剂
2:氧化还原反应中电子转移的表示方法
0
0
+1 -1
失2×e-,化合价升高,被氧化
2Na+Cl2 2NaCl
点燃
得2×e-,化合价降低,被还原
双线桥法
①标出化合价
②画桥
箭号从反应物指向生成物,起止为同一种元素(双线桥连接不同价态的同种元素)
③电子得失总数相等。
4Al + 3O2 == 2Al2O3
0
+3
0
-2
失4×3e-,化合价升高,被氧化
得6×2e-,化合价降低,被还原
氧化剂
还原剂
还原产物
氧化产物
点燃
氧化剂+还原剂→还原产物+氧化产物
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
②2KClO3 2KCl+3O2↑
?2Al + Fe2O3 2Fe + A l2O3
?
失去2×3e-,化合价升高,被氧化
得到2×3e-,化合价降低,被还原,
0
+3
0
+3
12e-
只要标明电子转移的数目(不要标明“得、失”电子)由失电子元素指向得电子元素
单桥法
?2Al + Fe2O3 2Fe + A l2O3
?
失去2×3e-,化合价升高,被氧化
得到2×3e-,化合价降低,被还原,
0
+3
0
+3
6e-
单线桥法
用双线桥法、单桥法分析氧化还原反应
②3Cu + 8HNO3(稀) 3Cu(NO3)2+ 2 NO↑+ 4H2O
0
+2
+2
+5
得到2×3e-,化合价降低,被还原
失去3×2e-,化合价升高,被氧化
6e-
3:常见的氧化剂和还原剂
③有较高化合价元素的化合物: HNO3、H2SO4(浓)、KMnO4、MnO2等。
②含高价金属离子的化合物:FeCl3
①活泼的非金属单质: O2 、Cl2、Br2等。
氧化剂:
?④含有较低化合价元素的化合物:H2S、Na2S、 NH3、CO、SO2、Na2SO3等。
还原剂:
①金属单质:Na、 Mg、Al、Fe、Zn等。
②某些非金属:H2、C等。
③含低价金属离子的化合物:FeCl2等。
化合反应
分解反应
置换反应
复分解反应
化学基本反应类型
化学反应
氧化还原反应
非氧化还原反应
氧化还原反应与四种基本类型反应关系
氧化还原反应
分解反应
置换反应
化合反应
氧化还原反应中的守恒
氧化性:氧化剂得电子的性质,使其它物质被氧化
还原性:还原剂失电子的性质,使其它物质被还原
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
+4 -1 +2 0
失2×e-,化合价升高,被氧化
得2e-,化合价降低,被还原
质量守恒;电荷守恒;得失电子守恒
氧化还原反应中的易错误区
1.有单质参与或生成的反应不一定是氧化还原反应。如“红磷——白磷”等同素异形体之间的转化。
2.某元素由化合态变为游离态时,该元素不一定被还原,如Cl-→Cl2中氯元素被氧化。
3.在氧化还原反应中大部分非金属单质往往既具有氧化性又具有还原性,只是以氧化性为主,但F2只有氧化性。
