高中化学必修一人教版(2019)第三章 第一节 第四课时 铁盐(共31张PPT)
文档属性
| 名称 | 高中化学必修一人教版(2019)第三章 第一节 第四课时 铁盐(共31张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 52.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-08 00:00:00 | ||
图片预览











文档简介
主讲老师:刘老师
第三章 铁 金属材料
3.1.3 铁盐和亚铁盐
第一节 铁及其化合物
学业要求
核心素养对接
1.能列举、描述、辨识铁及其重要化合物的重要物理性质、化学性质及实验现象。
2.能利用氢氧化亚铁的性质,设计其制备方案。
3.能说明Fe2+、Fe3+的检验及其之间的相互转化。
4.能说明铁及其化合物的应用。
1.能利用氢氧化亚铁的性质,设计其制备方案,以培养学生科学探究与创新意识的素养水平。
2.利用Fe2+、Fe3+的检验及其之间的相互转化,培养学生变化观念与平衡思想的素养水平。
苹果汁是人们喜爱的饮料,但是现榨的苹果汁在空气中会慢慢的由浅绿色变为棕黄色,为什么呢?
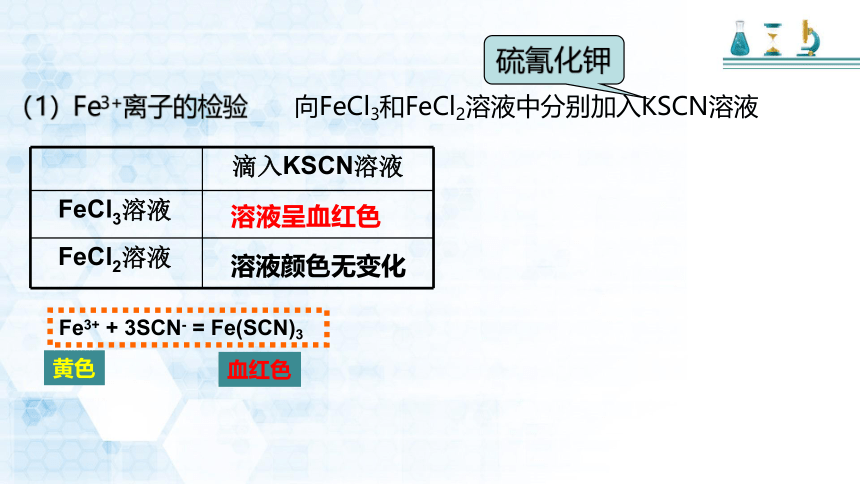
实验:在氯化铁和氯化亚铁溶液中分别滴加硫氰化钾溶液
3、铁盐和亚铁盐
(1)Fe3+离子的检验
向FeCl3和FeCl2溶液中分别加入KSCN溶液
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈血红色
溶液颜色无变化
硫氰化钾
Fe3+ + 3SCN- = Fe(SCN)3
血红色
黄色
交流和讨论:
有哪些方法可以鉴别FeCl3溶液和FeCl2溶液?
1、观察溶液颜色 黄色、浅绿色
2、滴入几滴KSCN溶液,看溶液颜色变化
3、加入NaOH,看沉淀颜色
如何判断FeCl2溶液是否有部分Fe2+被氧化成Fe3+?
滴入几滴KSCN溶液,看溶液颜色变化
(2)Fe2+和Fe3+的相互转化( Fe3+的氧化性)
向氯化铁溶液中加入铁粉,发现溶液的黄色褪去,再加入硫氰化钾溶液,发现溶液无变化,这说明铁粉将铁离子还原为亚铁离子
Fe + 2Fe3+ = 3Fe2+
向其中滴加氯水,发现溶液变为红色,说明氯水将亚铁离子氧化为铁离子
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
铁盐会被较强的还原剂还原为亚铁盐,亚铁盐会被较强的氧化剂氧化为铁盐,两者可以通过氧化还原反应进行相互转化
氧化剂
还原剂
Fe2+
Fe3+
从生活走进化学
密封包装
薄膜防止Fe2+被氧化
?
Vc会有什么作用?
亚铁盐是可以被氧化的,补铁的试剂是亚铁盐,补铁药品如何达到 2~3年的保质期?
实验:在氯化铁滴加硫氰化钾溶液,再加入维生素C
氯化铁溶液,滴加硫氰化钾溶液后显红色,加入维生素C红色褪去,说明维生素C将Fe3+,还原为Fe2+
Vc
维生素C和补铁试剂同时使用,可以保证吸收的都是亚铁离子
铁化合物和亚铁化合物的相互转变
氧化性
还原性
还原性
氧化性
Fe
Fe2+
Fe3+
弱氧化剂
H+、Cu2+
还原剂
C、H2、
强氧化剂
Cl2、KMnO4 H2O2、 HNO3
还原剂
Zn、Fe、Cu、
还原剂
C、CO、
强氧化剂
0
1. Fe只具有还原性,可以被氧化剂氧化为Fe2+、Fe3+
如:Fe+S === FeS,Fe+2Fe3+ === 3Fe2+,
Fe+Cu2+ === Cu+Fe2+;2Fe+3Cl2 === 2FeCl3,
3Fe+4H2O(g) === Fe3O4+4H2。
2. Fe2+既具有氧化性又具有还原性
如:2Fe2++Cl2===2Fe3++2Cl-,
Zn+Fe2+===Zn2++Fe
FeO+CO === Fe+CO2。
3.Fe3+具有较强氧化性,可被还原为Fe2+或Fe
如:2Fe3++Cu===2Fe2++Cu2+,
Fe2O3+3CO2Fe+3CO2,
Fe2O3+2Al2Fe+Al2O3。
特别提醒:
(1)金属阳离子被还原不一定得到金属单质。
如:Fe3+―→Fe2+。
(2)离子共存问题:
①Fe3+与I-、S2-、HS-、SO3、HSO3等因发生氧化还原反应而不能大量共存。
②Fe2+与MnO4-(H+)、NO3+(H+)、ClO-等因发生氧化还原反应而不能大量共存。
(3)除杂问题(括号内为杂质):
①FeCl3溶液(FeCl2):加足量氯水或H2O2或通入足量Cl2。
②FeCl2溶液(FeCl3):加足量铁粉,充分反应后过滤。
③FeSO4溶液(CuSO4):加足量铁粉,充分反应后过滤。
④Fe粉(铝)、Fe2O3(Al2O3):加足量NaOH溶液,充分反应后过滤。
(4)Fe2+盐溶液的配制与保存:加铁粉,防止Fe2+被氧化。
阅读:资料卡片——铜盐
图 3-21 出土的古代铜制品上往往覆盖着一层铜绿[主要成分Cu2(OH)2CO3]
1、设计实验方案,判断“速力菲”补血剂中铁元素的存在形式。
试剂:补血片剂溶液(久置、新制),KSCN溶液。
学以致用:
拓展知识:检验Fe2+的注意事项
(1)只含Fe2+的溶液:检验Fe2+加入试剂的顺序
①加KSCN溶液前,防止加氧化性物质,使Fe2+被氧化。
如H2O2、NO3+(H+)等
②氧化剂不能选用酸性KMnO4溶液,原因:酸性KMnO4 溶液本身显紫红色,对Fe(SCN)3红色有干扰;酸性KMnO4溶液能氧化KSCN,溶液不变红色,不能证明不含Fe2+。
(2)同时含有Fe2+和Fe3+的溶液
Fe2+对检验Fe3+无干扰,可以滴加KSCN溶液检验Fe3+;Fe3+对检验Fe2+有干扰,不能采用加KSCN溶液检验Fe2+,通常向溶液中滴加适量酸性KMnO4溶液,溶液紫红色褪色说明含有Fe2+。
(3)检验铁的氧化物中是否有+2价铁时,正确的思路为
①步骤a中不能选用盐酸,原因是酸性KMnO4溶液可以氧化盐酸。
②步骤a中,不能选用稀HNO3,原因是稀HNO3可以将Fe2+氧化为Fe3+。
2. 了解FeCl3制作印刷电路板
制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住的铜就被反应掉。
从化学走向社会
Cu + 2Fe3+ = 2Fe2+ + Cu2+
1.下列离子方程式正确的是( )
A.将氨水滴入到FeCl3溶液中 Fe3++3OH-===Fe(OH)3↓
B.氧化铁与盐酸反应 Fe2O3+6H+===2Fe3++3H2O
C.向FeCl3溶液中加入铁粉 Fe+Fe3+===2Fe2+
D.向氯化亚铁溶液中通入Cl2 Fe2++Cl2===Fe3++2Cl-
B
解析
A项在书写离子方程式时,弱电解质NH3·H2O不能拆写成离子的形式;
C项离子方程式中除遵循元素守恒外,电荷也必须守恒,正确的离子方程式应为Fe+2Fe3+===3Fe2+;
D项只符合元素守恒,不符合电荷守恒,正确的离子方程式应为
2Fe2++Cl2===2Fe3++2Cl-。
2.把铁粉、铜粉置于FeCl3溶液中,充分反应后加入KSCN不显红色,下列情况不能成立的是( )
A.铁不剩余,Cu剩余
B.铁、铜均剩余
C.铁剩余,含Cu2+
D.铜剩余,含Fe2+
解析答案
C
解析 因还原性:Fe>Cu,FeCl3溶液中加入铁粉、铜粉时,依次发生反应:
Fe+2FeCl3===3FeCl2,Cu+2FeCl3===2FeCl2+CuCl2
有以下情况:①Fe、Cu均剩余,溶液中只有Fe2+;
②只有Cu剩余,溶液中只有Fe2+或含Fe2+、Cu2+;
③Fe、Cu均不剩余,Fe3+恰好反应,溶液中有Fe2+、Cu2+;
④Fe、Cu均不剩余,Fe3+剩余,溶液中有Fe3+、Fe2+、Cu2+,C项Fe剩余,则溶液中不可能含有Cu2+。
1
2
3
4
3.向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴入几滴新制氯水后,混合溶液变成红色,则下列结论错误的是( )
A.该溶液中一定含有SCN-
B.氧化性:Fe3+>Cl2
C.Fe2+与SCN-不能形成红色物质
D.Fe2+被氧化为Fe3+
B
解析 溶液中的Fe2+与加入的新制氯水发生反应:2Fe2++Cl2===2Fe3++2Cl-,故氧化性:Fe3+ 4.把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中,充分反应后,所得溶液中的金属离子为( )
A.Fe3+和Cu2+ B.Fe2+和Cu2+
C.Fe2+和Fe3+ D.Fe2+
1
2
3
4
D
解析 本题涉及的物质的性质有:CuO与盐酸的反应,Fe、Fe2O3与盐酸的反应,Fe3+与Fe、Cu的反应,Fe与Cu2+的反应等。表面氧化物较少,溶于盐酸后,生成的Fe3+和Cu2+较少,分别被Fe还原为Fe2+和Cu,Cu与盐酸不反应,Fe与盐酸反应生成Fe2+。
铁及其化合物的性质
Fe
隔绝空气加热
Fe3O4
FeO
Fe2O3
(13)
(14)
(12)
①
⑤
⑥
③
②
(11)
⑨
④
⑩
⒂
⑧
FeCl2
Fe(OH)2
Fe(OH)3
FeCl3
⑦
总结:
化学课堂欢迎你
其他内容 且听下回分解
实验:FeCl2溶液中先加铁粉,再滴加KSCN溶液,最后滴加氯水
第三章 铁 金属材料
3.1.3 铁盐和亚铁盐
第一节 铁及其化合物
学业要求
核心素养对接
1.能列举、描述、辨识铁及其重要化合物的重要物理性质、化学性质及实验现象。
2.能利用氢氧化亚铁的性质,设计其制备方案。
3.能说明Fe2+、Fe3+的检验及其之间的相互转化。
4.能说明铁及其化合物的应用。
1.能利用氢氧化亚铁的性质,设计其制备方案,以培养学生科学探究与创新意识的素养水平。
2.利用Fe2+、Fe3+的检验及其之间的相互转化,培养学生变化观念与平衡思想的素养水平。
苹果汁是人们喜爱的饮料,但是现榨的苹果汁在空气中会慢慢的由浅绿色变为棕黄色,为什么呢?
实验:在氯化铁和氯化亚铁溶液中分别滴加硫氰化钾溶液
3、铁盐和亚铁盐
(1)Fe3+离子的检验
向FeCl3和FeCl2溶液中分别加入KSCN溶液
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈血红色
溶液颜色无变化
硫氰化钾
Fe3+ + 3SCN- = Fe(SCN)3
血红色
黄色
交流和讨论:
有哪些方法可以鉴别FeCl3溶液和FeCl2溶液?
1、观察溶液颜色 黄色、浅绿色
2、滴入几滴KSCN溶液,看溶液颜色变化
3、加入NaOH,看沉淀颜色
如何判断FeCl2溶液是否有部分Fe2+被氧化成Fe3+?
滴入几滴KSCN溶液,看溶液颜色变化
(2)Fe2+和Fe3+的相互转化( Fe3+的氧化性)
向氯化铁溶液中加入铁粉,发现溶液的黄色褪去,再加入硫氰化钾溶液,发现溶液无变化,这说明铁粉将铁离子还原为亚铁离子
Fe + 2Fe3+ = 3Fe2+
向其中滴加氯水,发现溶液变为红色,说明氯水将亚铁离子氧化为铁离子
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
铁盐会被较强的还原剂还原为亚铁盐,亚铁盐会被较强的氧化剂氧化为铁盐,两者可以通过氧化还原反应进行相互转化
氧化剂
还原剂
Fe2+
Fe3+
从生活走进化学
密封包装
薄膜防止Fe2+被氧化
?
Vc会有什么作用?
亚铁盐是可以被氧化的,补铁的试剂是亚铁盐,补铁药品如何达到 2~3年的保质期?
实验:在氯化铁滴加硫氰化钾溶液,再加入维生素C
氯化铁溶液,滴加硫氰化钾溶液后显红色,加入维生素C红色褪去,说明维生素C将Fe3+,还原为Fe2+
Vc
维生素C和补铁试剂同时使用,可以保证吸收的都是亚铁离子
铁化合物和亚铁化合物的相互转变
氧化性
还原性
还原性
氧化性
Fe
Fe2+
Fe3+
弱氧化剂
H+、Cu2+
还原剂
C、H2、
强氧化剂
Cl2、KMnO4 H2O2、 HNO3
还原剂
Zn、Fe、Cu、
还原剂
C、CO、
强氧化剂
0
1. Fe只具有还原性,可以被氧化剂氧化为Fe2+、Fe3+
如:Fe+S === FeS,Fe+2Fe3+ === 3Fe2+,
Fe+Cu2+ === Cu+Fe2+;2Fe+3Cl2 === 2FeCl3,
3Fe+4H2O(g) === Fe3O4+4H2。
2. Fe2+既具有氧化性又具有还原性
如:2Fe2++Cl2===2Fe3++2Cl-,
Zn+Fe2+===Zn2++Fe
FeO+CO === Fe+CO2。
3.Fe3+具有较强氧化性,可被还原为Fe2+或Fe
如:2Fe3++Cu===2Fe2++Cu2+,
Fe2O3+3CO2Fe+3CO2,
Fe2O3+2Al2Fe+Al2O3。
特别提醒:
(1)金属阳离子被还原不一定得到金属单质。
如:Fe3+―→Fe2+。
(2)离子共存问题:
①Fe3+与I-、S2-、HS-、SO3、HSO3等因发生氧化还原反应而不能大量共存。
②Fe2+与MnO4-(H+)、NO3+(H+)、ClO-等因发生氧化还原反应而不能大量共存。
(3)除杂问题(括号内为杂质):
①FeCl3溶液(FeCl2):加足量氯水或H2O2或通入足量Cl2。
②FeCl2溶液(FeCl3):加足量铁粉,充分反应后过滤。
③FeSO4溶液(CuSO4):加足量铁粉,充分反应后过滤。
④Fe粉(铝)、Fe2O3(Al2O3):加足量NaOH溶液,充分反应后过滤。
(4)Fe2+盐溶液的配制与保存:加铁粉,防止Fe2+被氧化。
阅读:资料卡片——铜盐
图 3-21 出土的古代铜制品上往往覆盖着一层铜绿[主要成分Cu2(OH)2CO3]
1、设计实验方案,判断“速力菲”补血剂中铁元素的存在形式。
试剂:补血片剂溶液(久置、新制),KSCN溶液。
学以致用:
拓展知识:检验Fe2+的注意事项
(1)只含Fe2+的溶液:检验Fe2+加入试剂的顺序
①加KSCN溶液前,防止加氧化性物质,使Fe2+被氧化。
如H2O2、NO3+(H+)等
②氧化剂不能选用酸性KMnO4溶液,原因:酸性KMnO4 溶液本身显紫红色,对Fe(SCN)3红色有干扰;酸性KMnO4溶液能氧化KSCN,溶液不变红色,不能证明不含Fe2+。
(2)同时含有Fe2+和Fe3+的溶液
Fe2+对检验Fe3+无干扰,可以滴加KSCN溶液检验Fe3+;Fe3+对检验Fe2+有干扰,不能采用加KSCN溶液检验Fe2+,通常向溶液中滴加适量酸性KMnO4溶液,溶液紫红色褪色说明含有Fe2+。
(3)检验铁的氧化物中是否有+2价铁时,正确的思路为
①步骤a中不能选用盐酸,原因是酸性KMnO4溶液可以氧化盐酸。
②步骤a中,不能选用稀HNO3,原因是稀HNO3可以将Fe2+氧化为Fe3+。
2. 了解FeCl3制作印刷电路板
制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住的铜就被反应掉。
从化学走向社会
Cu + 2Fe3+ = 2Fe2+ + Cu2+
1.下列离子方程式正确的是( )
A.将氨水滴入到FeCl3溶液中 Fe3++3OH-===Fe(OH)3↓
B.氧化铁与盐酸反应 Fe2O3+6H+===2Fe3++3H2O
C.向FeCl3溶液中加入铁粉 Fe+Fe3+===2Fe2+
D.向氯化亚铁溶液中通入Cl2 Fe2++Cl2===Fe3++2Cl-
B
解析
A项在书写离子方程式时,弱电解质NH3·H2O不能拆写成离子的形式;
C项离子方程式中除遵循元素守恒外,电荷也必须守恒,正确的离子方程式应为Fe+2Fe3+===3Fe2+;
D项只符合元素守恒,不符合电荷守恒,正确的离子方程式应为
2Fe2++Cl2===2Fe3++2Cl-。
2.把铁粉、铜粉置于FeCl3溶液中,充分反应后加入KSCN不显红色,下列情况不能成立的是( )
A.铁不剩余,Cu剩余
B.铁、铜均剩余
C.铁剩余,含Cu2+
D.铜剩余,含Fe2+
解析答案
C
解析 因还原性:Fe>Cu,FeCl3溶液中加入铁粉、铜粉时,依次发生反应:
Fe+2FeCl3===3FeCl2,Cu+2FeCl3===2FeCl2+CuCl2
有以下情况:①Fe、Cu均剩余,溶液中只有Fe2+;
②只有Cu剩余,溶液中只有Fe2+或含Fe2+、Cu2+;
③Fe、Cu均不剩余,Fe3+恰好反应,溶液中有Fe2+、Cu2+;
④Fe、Cu均不剩余,Fe3+剩余,溶液中有Fe3+、Fe2+、Cu2+,C项Fe剩余,则溶液中不可能含有Cu2+。
1
2
3
4
3.向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴入几滴新制氯水后,混合溶液变成红色,则下列结论错误的是( )
A.该溶液中一定含有SCN-
B.氧化性:Fe3+>Cl2
C.Fe2+与SCN-不能形成红色物质
D.Fe2+被氧化为Fe3+
B
解析 溶液中的Fe2+与加入的新制氯水发生反应:2Fe2++Cl2===2Fe3++2Cl-,故氧化性:Fe3+
A.Fe3+和Cu2+ B.Fe2+和Cu2+
C.Fe2+和Fe3+ D.Fe2+
1
2
3
4
D
解析 本题涉及的物质的性质有:CuO与盐酸的反应,Fe、Fe2O3与盐酸的反应,Fe3+与Fe、Cu的反应,Fe与Cu2+的反应等。表面氧化物较少,溶于盐酸后,生成的Fe3+和Cu2+较少,分别被Fe还原为Fe2+和Cu,Cu与盐酸不反应,Fe与盐酸反应生成Fe2+。
铁及其化合物的性质
Fe
隔绝空气加热
Fe3O4
FeO
Fe2O3
(13)
(14)
(12)
①
⑤
⑥
③
②
(11)
⑨
④
⑩
⒂
⑧
FeCl2
Fe(OH)2
Fe(OH)3
FeCl3
⑦
总结:
化学课堂欢迎你
其他内容 且听下回分解
实验:FeCl2溶液中先加铁粉,再滴加KSCN溶液,最后滴加氯水
