人教版化学九年级下册第九单元 溶液测试题(含答案)
文档属性
| 名称 | 人教版化学九年级下册第九单元 溶液测试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 253.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-08 00:00:00 | ||
图片预览



文档简介
第9单元《溶液》测试题
一、单选题
1.从100mL溶质的质量分数为?10%的硫酸溶液中倒出20mL,剩下的溶液中溶质的质量分数(
)
A.8%
B.10%
C.12.5%
D.80%
2.将家庭中常用的四种调味品分别放入水中,能形成溶液的是(
)
A.橄榄油
B.番茄酱
C.白醋
D.胡椒粉
3.化学课本中的图表、图像可为我们提供许多信息。下列说法不正确的是( )
A.利用元素周期表,可查阅元素在地壳中的含量
B.利用金属活动性顺序表,可判断金属与盐溶液是否发生反应
C.利用化合价表可以判断物质的化学式是否书写正确
D.利用溶解度曲线可以比较同一物质在不同温度时的溶解度大小
4.下列有关溶液的叙述中,正确的是(
)
A.均一、稳定的液体一定是溶液
B.“雪碧”饮料属于溶液
C.稀溶液一定是不饱和溶液
D.饱和溶液是不能再继续溶解任何溶质的溶液
5.下列关于溶液的叙述中,正确的是(
)
A.溶液都是无色的
B.均一稳定的液体都是溶液
C.浓溶液一定是饱和溶液
D.溶液一定是混合物
6.下列物质溶于水时,温度降低的是( )
A.氢氧化钠
B.氧化钙
C.盐酸
D.硝酸铵
7.如图为a、b、c三种固体物质的溶解度曲线,下列说法中正确的是
A.将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=c
B.t1℃时,将20gc加入50g水中充分溶解,得到70g饱和溶液
C.t2℃时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数
D.t1℃时,分别将11g的a、b、c溶于50g的水中,所得溶液的溶质质量分数最大的是b
8.将下列少量物质分别放入水中,充分搅拌,可以得到无色溶液的是(
)
A.汽油
B.面粉
C.氯化钠
D.高锰酸钾
9.某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是
A.②中溶液是饱和溶液
B.③中溶液一定是不饱和溶液
C.②③中溶液的溶质质量分数不相同
D.③中溶液的溶质质量大于②中溶液的溶质质量
10.甲、乙两物质的溶解度曲线如图所示,下列说法正确的是(
)
A.甲和乙的饱和溶液,从t1℃升温到t2℃,仍是饱和溶液
B.t1℃时,甲和乙的溶解度相等
C.t1℃时,甲和乙各30g分别加入80g水中,均能恰好完全溶解
D.t2℃时,在100g水中放入60g甲,形成不饱和溶液
11.配制70克14%的NaCl溶液,下列有些操作出现错误,下列会使所配溶液溶质质量分数大于14%的是( )
A.用图①的操作称量NaCl
B.用图②的操作溶解固体
C.用图③的操作量取水的体积
D.用图④的操作把配制好的溶液装在试剂瓶中
12.如图是A、B、C三种物质的溶解度曲线,下列分析不正确的是(
)
A.50℃时A
B
C三种物质的溶解度由大到小的顺序是A>B>C
B.50℃时把50gA放入100g水中能得到A的不饱和溶液
C.将C的饱和溶液变为不饱和溶液,可采用降温方法
D.可以通过冷却热饱和溶液的方法得到A的晶体
13.鉴别日常生活中的下列各组物质,操作1和操作2均不正确的是
选项
鉴别的物质
操作1
操作2
A
水和过氧化氢
观察颜色
加入二氧化锰
B
白糖和食盐
溶解于水
观察颜色
C
氧气和二氧化碳
滴加澄清石灰水
伸入燃着的木条
D
白酒和白醋
闻气味
燃烧
A.A
B.B
C.C
D.D
14.盐场晒盐后所得的卤水中含有MgCl2,KCl和MgSO4等物质,它们的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,KCl和MgSO4两溶液所含溶质质量一定相等
B.t2℃时,MgSO4的饱和溶液升高温度和降低温度都能析出晶体
C.t3℃时,100gMgCl2的饱和溶液中含有agMgCl2
D.将t1℃时的KCl饱和溶液升温到t3℃,溶液的溶质质量分数变大
15.有关叙述正确的是
A.凡是有发光放热现象的一定是化学变化
B.在同一化合物中,金属元素一定显正价,非金属元素一定显负价
C.50mL酒精中加入50mL水,则所得酒精溶液的体积一定为100mL
D.一定温度下,往氢氧化钙饱和溶液中加入氧化钙,溶质、溶剂的质量一定改变
二、填空题
16.如图是a、b、c三种固体物质(均不含结晶水)的溶解度曲线图。请根据图示回答下列问题:
(1)20℃时,溶解度最大的是_________________。
(2)欲将c物质的饱和溶液变为不饱和溶液,可采用的方法是___________(填“降低”或“升高”)温度。
(3)20℃时,向30g物质a中加入50g水,充分溶解并恢复到原温度,所得溶液中溶质的质量为____________g。
(4)下列说法正确的是_______________。
A当b中混有少量a时,可用蒸发结晶的方法提纯b。
B20℃时,用a、b、c三种固体配制等质量的饱和溶液,所需水的质量大小关系是b>a=c
C将20℃的a、b、c三种物质的饱和溶液升温至t℃,所得溶液中溶质的质量分数大小关系为b>a>c
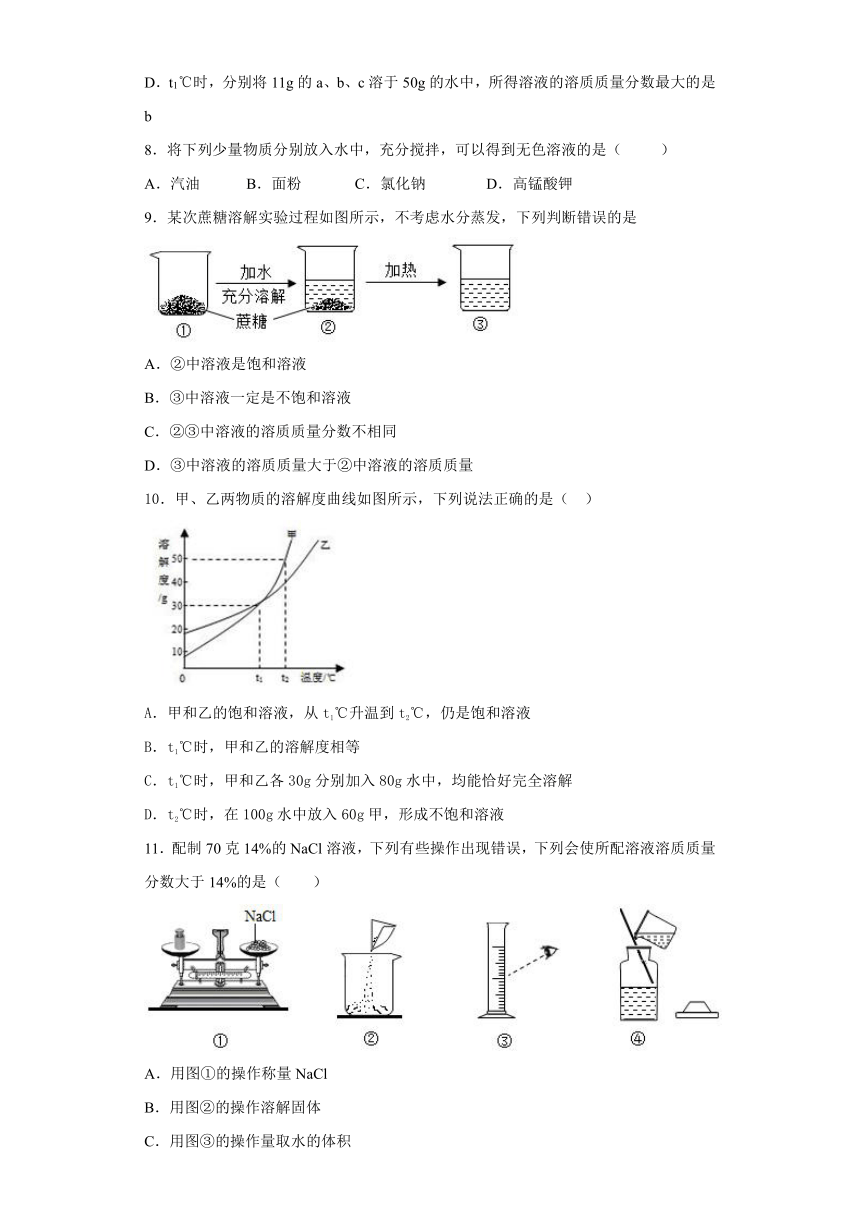
17.甲、乙、丙三种固体(均不含结晶水)的溶解度曲线如图所示,请回答下列问题
①
30℃时,丙的溶解度是__g/100g水。
②
20℃时,三种物质的溶解度由大到小依次为___________。
③
取甲、乙、丙中的某一种固体进行如下图所示的实验,请回答
Ⅰ
溶液a的溶质质量分数是__________;(精确到0.1%)
Ⅱ
取用的固体是____________;
Ⅲ
温度t的范围是__________℃;
Ⅳ
关于溶液d和溶液e的说法错误的是_______。
A溶质质量可能相等
B溶液d中溶质质量可能大于溶液e
C溶液的溶质质量分数可能相同
D溶解度可能变大
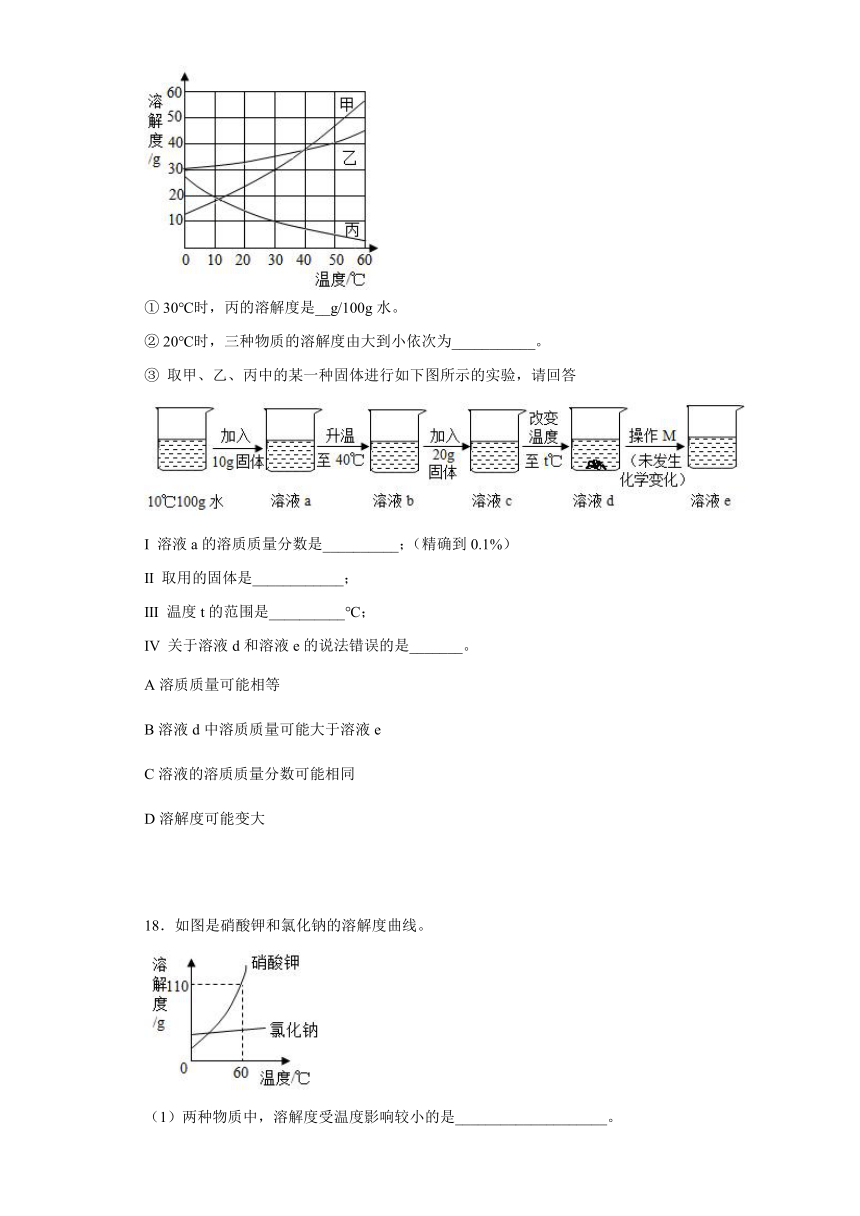
18.如图是硝酸钾和氯化钠的溶解度曲线。
(1)两种物质中,溶解度受温度影响较小的是____________________。
(2)使接近饱和的氯化钠溶液变为饱和溶液的一种方法是____________________。
(3)60℃时,硝酸钾饱和溶液中溶有少量的氯化钠提纯硝酸钾应采用的方法是________。
(4)60℃时,将60g硝酸钾放入50g水中充分溶解,形成溶液质量是__________g。
19.如图是甲、乙、丙三种固体的溶解度曲线,回答下列问题:
(1)t2℃时,甲的溶解度_________乙的溶解度(填“>”、“<”或“=”).
(2)t2℃时,向50克水中加入50g乙物质,充分溶解后所得溶液的质量是_________
(3)t1℃甲、乙、丙的饱和溶液升温到t2℃,所得溶液中溶质质量分数的大小关系为_________(填“>”、“<”或“=”).
(4)若固体乙中含有少量的甲,可用_________方法提纯乙(填“蒸发结晶”或“降温结晶”).
20.KNO3和NaCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃
0
10
20
30
40
50
60
70
溶解度/g
KNO3
13.3
20.9
31.6
45.8
63.9
85.5
110
138
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
37.8
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图所示:
图中能表示KNO3溶解度曲线的是
(填“A”或“B”)
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解
度,则温度的范围是
;
(3)某兴趣小组做了一下实验:
上述实验过程中得到的溶液一定属于不饱和溶液的是
(填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体
g;
(4)硝酸钾中含有少量氯化钠时,可通过
(填“蒸发结晶”或“降温结晶”)的方法提纯。
三、推断题
21.柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
(1)写出反应1的化学方程式:__________;
(2)操作1的名称为__________;
(3)反应3中会有气体生成,该气体是_________;
(4)柠檬酸亚铁的化学式为FeC6H6O7,柠檬酸亚铁中铁元素和碳元素质量比为________;
(5)若选用的稀硫酸溶质的质量分数为12%,则用100mL98%的浓硫酸(密度为1.8g/cm3)配制该稀硫酸,需加水________g。
22.A、B、C、D、E、F均是初中化学中的常见物质,其中A、D为单质,其余均为化合物,B、C由两种相同元素组成。
(1)A在D中完全燃烧和不完全燃烧时,生成不同的气体。B溶液在一定条件下可反应生成C和无色气体D,C和D都与生命活动息息相关。B溶液中的溶质是
(用化学式表示)
(2)如图所示将固体E放入大烧杯中的水里,小烧杯中F的饱和溶液变浑浊。
则E的化学式可能为
,产生此现象的原因是
。
四、实验题
23.请据图回答下列问题:
(1)写出标号仪器名称①_____________②____________;
(2)上述实验操作正确的是______________(填字母代号)
(3)若采用B方法量取水,会使配制的溶液溶质质量分数____
(填
“增大”或“减小”);
(4)
D实验中当_______________时停止加热。
24.M是硝酸钾或氯化铵中的一种,硝酸钾和氯化铵的溶解度曲线如图1所示,某化学兴趣小组用物质M进行了如图2所示的实验。
(1)t1℃时,氯化铵的溶解度为_____g;
(2)烧杯①中溶质质量分数的计算式为_____;
(3)物质M是_____。
五、计算题
25.实验室用密度为1.84g/cm3、质量分数为98%的浓硫酸和蒸馏水,配制500g质量分数为20%的稀硫酸.需要用量程为_____mL的量筒,量取_____mL质量分数为98%的浓硫酸.
26.实验室有一瓶硫酸溶液,老师请小福同学设计方案测定该废液中硫酸的质量分数。小福同学先取一洁净小烧杯,称其质量为20g,然后往其中倒入少量硫酸废液后称量,总质量为70
g,之后,将一枚质量为15
g的铁钉(已用砂纸打磨去掉铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为84.8
g。请回答下列问题:
(1)反应中产生的气体的质量是
g。
(2)计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数)。
参考答案
1.B
2.C
3.A
4.B
5.D
6.D
7.D
8.C
9.B
10.B
11.C
12.B
13.B
14.B
15.D
16.b
降低
17.5
AC
17.10
乙>甲>丙
9.1%
甲
<30
B
18.氯化钠
加溶质或蒸发溶剂或降低温度
降温结晶
105
19.>
75g
甲=乙>丙
蒸发结晶
20.(1)A(2)20℃至30℃时
(3)①③④
59.1g
(4)降温结晶
21.Fe
+
H2SO4
=
Fe
SO4
+
H2↑
过滤
CO2
7
:
9
1290
22.H2O2、NaOH或CaO,
23.量筒
铁架台
D
增大
出现较多量的固体
24.40
KNO3
25.100,55.5
26.(1)0.2
(2)19.6%
一、单选题
1.从100mL溶质的质量分数为?10%的硫酸溶液中倒出20mL,剩下的溶液中溶质的质量分数(
)
A.8%
B.10%
C.12.5%
D.80%
2.将家庭中常用的四种调味品分别放入水中,能形成溶液的是(
)
A.橄榄油
B.番茄酱
C.白醋
D.胡椒粉
3.化学课本中的图表、图像可为我们提供许多信息。下列说法不正确的是( )
A.利用元素周期表,可查阅元素在地壳中的含量
B.利用金属活动性顺序表,可判断金属与盐溶液是否发生反应
C.利用化合价表可以判断物质的化学式是否书写正确
D.利用溶解度曲线可以比较同一物质在不同温度时的溶解度大小
4.下列有关溶液的叙述中,正确的是(
)
A.均一、稳定的液体一定是溶液
B.“雪碧”饮料属于溶液
C.稀溶液一定是不饱和溶液
D.饱和溶液是不能再继续溶解任何溶质的溶液
5.下列关于溶液的叙述中,正确的是(
)
A.溶液都是无色的
B.均一稳定的液体都是溶液
C.浓溶液一定是饱和溶液
D.溶液一定是混合物
6.下列物质溶于水时,温度降低的是( )
A.氢氧化钠
B.氧化钙
C.盐酸
D.硝酸铵
7.如图为a、b、c三种固体物质的溶解度曲线,下列说法中正确的是
A.将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=c
B.t1℃时,将20gc加入50g水中充分溶解,得到70g饱和溶液
C.t2℃时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数
D.t1℃时,分别将11g的a、b、c溶于50g的水中,所得溶液的溶质质量分数最大的是b
8.将下列少量物质分别放入水中,充分搅拌,可以得到无色溶液的是(
)
A.汽油
B.面粉
C.氯化钠
D.高锰酸钾
9.某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是
A.②中溶液是饱和溶液
B.③中溶液一定是不饱和溶液
C.②③中溶液的溶质质量分数不相同
D.③中溶液的溶质质量大于②中溶液的溶质质量
10.甲、乙两物质的溶解度曲线如图所示,下列说法正确的是(
)
A.甲和乙的饱和溶液,从t1℃升温到t2℃,仍是饱和溶液
B.t1℃时,甲和乙的溶解度相等
C.t1℃时,甲和乙各30g分别加入80g水中,均能恰好完全溶解
D.t2℃时,在100g水中放入60g甲,形成不饱和溶液
11.配制70克14%的NaCl溶液,下列有些操作出现错误,下列会使所配溶液溶质质量分数大于14%的是( )
A.用图①的操作称量NaCl
B.用图②的操作溶解固体
C.用图③的操作量取水的体积
D.用图④的操作把配制好的溶液装在试剂瓶中
12.如图是A、B、C三种物质的溶解度曲线,下列分析不正确的是(
)
A.50℃时A
B
C三种物质的溶解度由大到小的顺序是A>B>C
B.50℃时把50gA放入100g水中能得到A的不饱和溶液
C.将C的饱和溶液变为不饱和溶液,可采用降温方法
D.可以通过冷却热饱和溶液的方法得到A的晶体
13.鉴别日常生活中的下列各组物质,操作1和操作2均不正确的是
选项
鉴别的物质
操作1
操作2
A
水和过氧化氢
观察颜色
加入二氧化锰
B
白糖和食盐
溶解于水
观察颜色
C
氧气和二氧化碳
滴加澄清石灰水
伸入燃着的木条
D
白酒和白醋
闻气味
燃烧
A.A
B.B
C.C
D.D
14.盐场晒盐后所得的卤水中含有MgCl2,KCl和MgSO4等物质,它们的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,KCl和MgSO4两溶液所含溶质质量一定相等
B.t2℃时,MgSO4的饱和溶液升高温度和降低温度都能析出晶体
C.t3℃时,100gMgCl2的饱和溶液中含有agMgCl2
D.将t1℃时的KCl饱和溶液升温到t3℃,溶液的溶质质量分数变大
15.有关叙述正确的是
A.凡是有发光放热现象的一定是化学变化
B.在同一化合物中,金属元素一定显正价,非金属元素一定显负价
C.50mL酒精中加入50mL水,则所得酒精溶液的体积一定为100mL
D.一定温度下,往氢氧化钙饱和溶液中加入氧化钙,溶质、溶剂的质量一定改变
二、填空题
16.如图是a、b、c三种固体物质(均不含结晶水)的溶解度曲线图。请根据图示回答下列问题:
(1)20℃时,溶解度最大的是_________________。
(2)欲将c物质的饱和溶液变为不饱和溶液,可采用的方法是___________(填“降低”或“升高”)温度。
(3)20℃时,向30g物质a中加入50g水,充分溶解并恢复到原温度,所得溶液中溶质的质量为____________g。
(4)下列说法正确的是_______________。
A当b中混有少量a时,可用蒸发结晶的方法提纯b。
B20℃时,用a、b、c三种固体配制等质量的饱和溶液,所需水的质量大小关系是b>a=c
C将20℃的a、b、c三种物质的饱和溶液升温至t℃,所得溶液中溶质的质量分数大小关系为b>a>c
17.甲、乙、丙三种固体(均不含结晶水)的溶解度曲线如图所示,请回答下列问题
①
30℃时,丙的溶解度是__g/100g水。
②
20℃时,三种物质的溶解度由大到小依次为___________。
③
取甲、乙、丙中的某一种固体进行如下图所示的实验,请回答
Ⅰ
溶液a的溶质质量分数是__________;(精确到0.1%)
Ⅱ
取用的固体是____________;
Ⅲ
温度t的范围是__________℃;
Ⅳ
关于溶液d和溶液e的说法错误的是_______。
A溶质质量可能相等
B溶液d中溶质质量可能大于溶液e
C溶液的溶质质量分数可能相同
D溶解度可能变大
18.如图是硝酸钾和氯化钠的溶解度曲线。
(1)两种物质中,溶解度受温度影响较小的是____________________。
(2)使接近饱和的氯化钠溶液变为饱和溶液的一种方法是____________________。
(3)60℃时,硝酸钾饱和溶液中溶有少量的氯化钠提纯硝酸钾应采用的方法是________。
(4)60℃时,将60g硝酸钾放入50g水中充分溶解,形成溶液质量是__________g。
19.如图是甲、乙、丙三种固体的溶解度曲线,回答下列问题:
(1)t2℃时,甲的溶解度_________乙的溶解度(填“>”、“<”或“=”).
(2)t2℃时,向50克水中加入50g乙物质,充分溶解后所得溶液的质量是_________
(3)t1℃甲、乙、丙的饱和溶液升温到t2℃,所得溶液中溶质质量分数的大小关系为_________(填“>”、“<”或“=”).
(4)若固体乙中含有少量的甲,可用_________方法提纯乙(填“蒸发结晶”或“降温结晶”).
20.KNO3和NaCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃
0
10
20
30
40
50
60
70
溶解度/g
KNO3
13.3
20.9
31.6
45.8
63.9
85.5
110
138
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
37.8
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图所示:
图中能表示KNO3溶解度曲线的是
(填“A”或“B”)
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解
度,则温度的范围是
;
(3)某兴趣小组做了一下实验:
上述实验过程中得到的溶液一定属于不饱和溶液的是
(填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体
g;
(4)硝酸钾中含有少量氯化钠时,可通过
(填“蒸发结晶”或“降温结晶”)的方法提纯。
三、推断题
21.柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
(1)写出反应1的化学方程式:__________;
(2)操作1的名称为__________;
(3)反应3中会有气体生成,该气体是_________;
(4)柠檬酸亚铁的化学式为FeC6H6O7,柠檬酸亚铁中铁元素和碳元素质量比为________;
(5)若选用的稀硫酸溶质的质量分数为12%,则用100mL98%的浓硫酸(密度为1.8g/cm3)配制该稀硫酸,需加水________g。
22.A、B、C、D、E、F均是初中化学中的常见物质,其中A、D为单质,其余均为化合物,B、C由两种相同元素组成。
(1)A在D中完全燃烧和不完全燃烧时,生成不同的气体。B溶液在一定条件下可反应生成C和无色气体D,C和D都与生命活动息息相关。B溶液中的溶质是
(用化学式表示)
(2)如图所示将固体E放入大烧杯中的水里,小烧杯中F的饱和溶液变浑浊。
则E的化学式可能为
,产生此现象的原因是
。
四、实验题
23.请据图回答下列问题:
(1)写出标号仪器名称①_____________②____________;
(2)上述实验操作正确的是______________(填字母代号)
(3)若采用B方法量取水,会使配制的溶液溶质质量分数____
(填
“增大”或“减小”);
(4)
D实验中当_______________时停止加热。
24.M是硝酸钾或氯化铵中的一种,硝酸钾和氯化铵的溶解度曲线如图1所示,某化学兴趣小组用物质M进行了如图2所示的实验。
(1)t1℃时,氯化铵的溶解度为_____g;
(2)烧杯①中溶质质量分数的计算式为_____;
(3)物质M是_____。
五、计算题
25.实验室用密度为1.84g/cm3、质量分数为98%的浓硫酸和蒸馏水,配制500g质量分数为20%的稀硫酸.需要用量程为_____mL的量筒,量取_____mL质量分数为98%的浓硫酸.
26.实验室有一瓶硫酸溶液,老师请小福同学设计方案测定该废液中硫酸的质量分数。小福同学先取一洁净小烧杯,称其质量为20g,然后往其中倒入少量硫酸废液后称量,总质量为70
g,之后,将一枚质量为15
g的铁钉(已用砂纸打磨去掉铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为84.8
g。请回答下列问题:
(1)反应中产生的气体的质量是
g。
(2)计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数)。
参考答案
1.B
2.C
3.A
4.B
5.D
6.D
7.D
8.C
9.B
10.B
11.C
12.B
13.B
14.B
15.D
16.b
降低
17.5
AC
17.10
乙>甲>丙
9.1%
甲
<30
B
18.氯化钠
加溶质或蒸发溶剂或降低温度
降温结晶
105
19.>
75g
甲=乙>丙
蒸发结晶
20.(1)A(2)20℃至30℃时
(3)①③④
59.1g
(4)降温结晶
21.Fe
+
H2SO4
=
Fe
SO4
+
H2↑
过滤
CO2
7
:
9
1290
22.H2O2、NaOH或CaO,
23.量筒
铁架台
D
增大
出现较多量的固体
24.40
KNO3
25.100,55.5
26.(1)0.2
(2)19.6%
同课章节目录
