初中化学鲁教版八年级全一册第五单元第一节 化学反应中的质量守恒练习题-普通用卷(含解析)
文档属性
| 名称 | 初中化学鲁教版八年级全一册第五单元第一节 化学反应中的质量守恒练习题-普通用卷(含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 146.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-09 23:11:13 | ||
图片预览



文档简介
初中化学鲁教版八年级全一册第五单元第一节练习题
一、单选题
推理是学习化学的一种方法,以下推理正确的是
A.
化合物是由不同种元素组成的,所以由不同种元素组成的物质一定是化合物
B.
氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧元素
C.
在原子中质子数等于核外电子数,所以所有的微粒中质子数一定等于核外电子数
D.
稀有气体元素的原子最外层电子数为氦除外,因此微粒??一定?是稀有气体元素的原子
将Mg、Al、Fe、Zn四种金属的混合物粉末共25g,加入到一定量的稀硫酸中,恰好完全反应,将所得溶液进行蒸发、结晶、烘干、称量,称得固体总质量为所得固体均不含结晶水,则反应中产生的氢气的总质量为
A.
48
B.
2g
C.
1g
D.
把一定量甲、乙、丙、丁四种物质放入一个密闭容器中,在一定条件下充分反应,测得反应前后各物质的质量如表所示。下列说法不正确的是
物质
甲
乙
丙
丁
反应前质量
10
5
12
16
反应中质量
X
5
21
Y
反应后质量
8
5
30
Z
A.
参加反应的甲和丁的质量比为1:8
B.
C.
乙一定是催化剂
D.
丙一定是化合物
科学家通过宇宙探测仪发现金星大气层中含有物质可以通过下列反应制取:则物质X的化学式为
A.
CO
B.
C.
D.
下列现象的解释或者结论错误的是
A.
蒸馏水不能养金鱼--蒸馏水中不含氧元素
B.
煤燃烧后灰渣质量减小--这个反应遵守质量守恒定律
C.
石墨作电极--石墨具有导电性
D.
把燃着的木条伸入集气瓶中,火焰熄灭--瓶中气体可能是
某物质完全燃烧后生成和水则对该物质相关判断正确的是
A.
该物质只含碳、氢元素
B.
该物质一定含有碳、氢元素,可能含有氧元素
C.
该物质由碳、氢、氧元素组成
D.
无法确定
在一个密闭容器里放入四种物质,使其充分反应,测得数据如下:
四种物质
甲
乙
丙
丁
应前质量
25
15
1
5
应后质量
11
未测
1
22
则下列表述正确的是
A.
未测值3g
B.
丙一定是催化剂
C.
乙全部发生了反应
D.
甲与乙反应的质量比为14:3
“开车不饮酒,饮酒不开车”交警常用“酒精检测仪”检查司机是否饮酒,其检测原理是让司机呼出气体中的酒精与检测仪中的物质发生化变反应:,其中x的值和三氧化铬中铬元素的化合价分别是
A.
2,价
B.
4,价
C.
4,价
D.
2,价
在光照条件下,可分解为
Ag、和某种氮的氧化物
取一定质量的固体充分光照,测得反应后生成Ag、、X的质量分别为、mg、。下列说法正确的是
A.
的质量为
B.
C.
X?的化学式为NO
D.
该反应方程式中Ag与的化学计量数之比为?2:1
高氯酸铵是一种火箭推进剂。实验室加热分解高氯酸铵固体,不可能得到的物质是
A.
B.
C.
D.
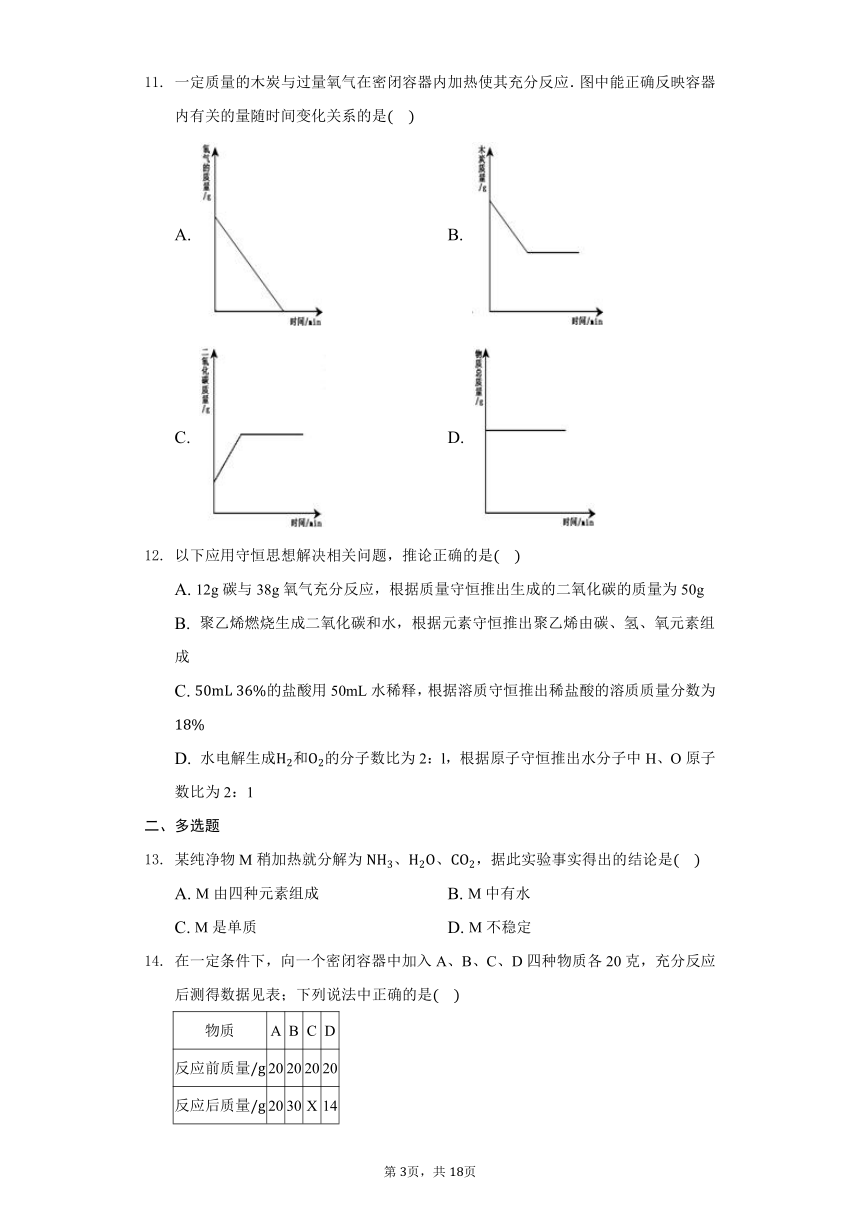
一定质量的木炭与过量氧气在密闭容器内加热使其充分反应.图中能正确反映容器内有关的量随时间变化关系的是
A.
B.
C.
D.
以下应用守恒思想解决相关问题,推论正确的是
A.
12g碳与38g氧气充分反应,根据质量守恒推出生成的二氧化碳的质量为50g
B.
聚乙烯燃烧生成二氧化碳和水,根据元素守恒推出聚乙烯由碳、氢、氧元素组成
C.
的盐酸用50mL水稀释,根据溶质守恒推出稀盐酸的溶质质量分数为
D.
水电解生成和的分子数比为2:l,根据原子守恒推出水分子中H、O原子数比为2:1
二、多选题
某纯净物M稍加热就分解为、、,据此实验事实得出的结论是
A.
M由四种元素组成
B.
M中有水
C.
M是单质
D.
M不稳定
在一定条件下,向一个密闭容器中加入A、B、C、D四种物质各20克,充分反应后测得数据见表;下列说法中正确的是
物质
A
B
C
D
反应前质量
20
20
20
20
反应后质量
20
30
X
14
A.
B.
A一定是该反应的催化剂
C.
B一定是化合物
D.
反应中C和D的质量比是2:3
在光照条件下,可分解为Ag、和某种氮的氧化物X。取一定质量的固体充分光照,测得生成Ag、、X的质量分别为、mg、。说法正确的是
A.
固体应密封保存在无色细口瓶中
B.
C.
X的化学式为
D.
生成物中Ag与的物质的量之比为3:2
某物质与氧气充分反应,生成和。下列说法正确是
A.
参加反应的的质量为
B.
该物质中碳、氢元素质量比为1:3
C.
生成和的分子个数比为2:3
D.
该物质一定含有碳、氢元素、氧元素
三、填空题
空气中体积分数约为的气体是
______
;地壳中含量最多的固态非金属元素所形成的氧化物的化学式为
______
;探究化学反应前后各物质之间的质量关系,必须用到的仪器是
______
。
实验室取氯酸钾和二氧化锰的混合物28g,加热完全反应后,冷却称量,剩余固体质量为。加热时反应的方程式为
______
,生成氧气的质量为
______
g。
用质量守恒定律解释下列问题。
高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小
______
。
细铁丝在氧气中燃烧后,生成物的质量比细铁丝的质量大
______
。
质量守恒定律的发现对化学的发展作出了重要贡献
用如图所示的3个实验验证质量守恒定律,其中实验前后天平不能保持平衡的是
______
填序号,理由是
______
.
从微观角度分析,化学反应中质量守恒的原因是
______
.
四、推断题
利用空气制取氮肥的流程如图所示。
从空气中分离出氮气和氧气属于?
?
?
?
?
?
?
?填物理变化或化学变化??
操作Ⅱ反应为,在该反应中化合价升高的元素为?
?
?
?。
Ⅰ中参加反应的单质甲为____填化学式,Ⅰ、Ⅱ、Ⅲ三个变化中属于化合反应的有?
?
?
?个。
五、实验题
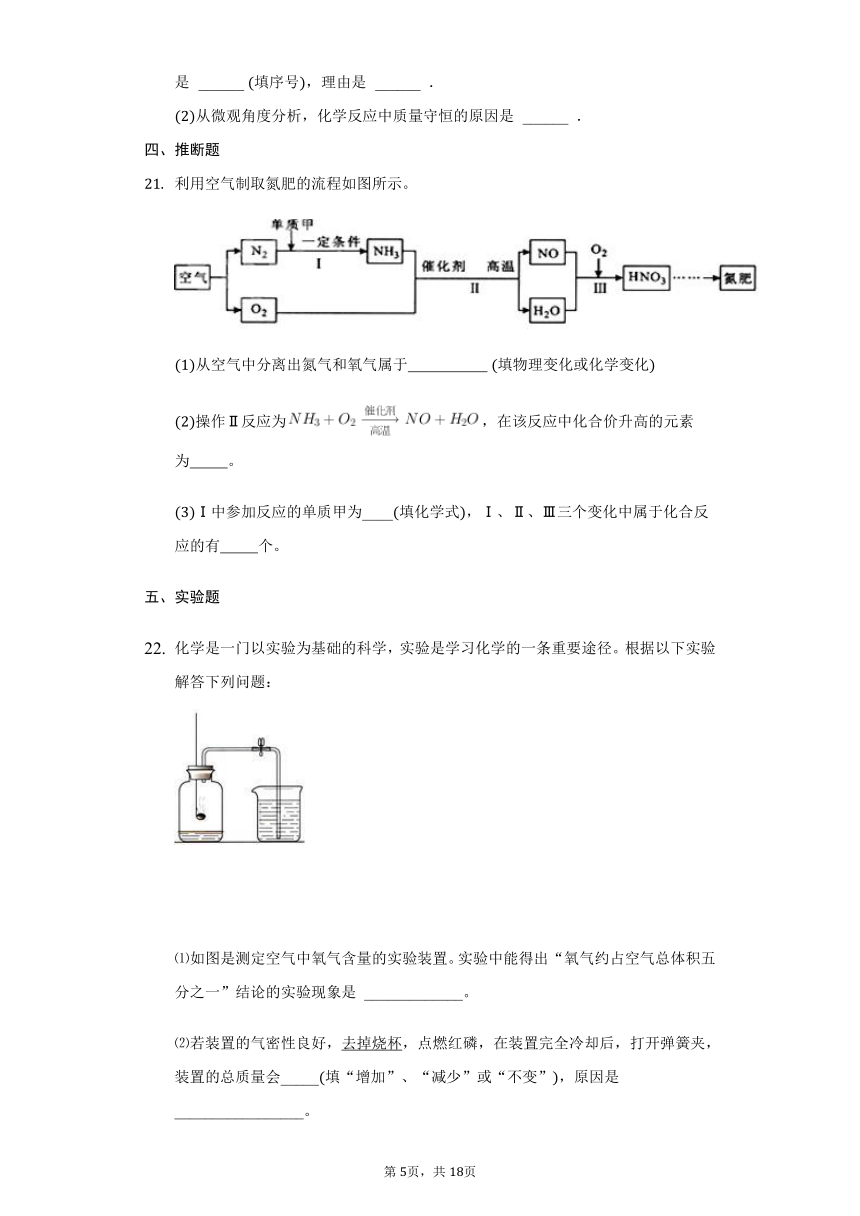
化学是一门以实验为基础的科学,实验是学习化学的一条重要途径。根据以下实验解答下列问题:
如图是测定空气中氧气含量的实验装置。实验中能得出“氧气约占空气总体积五分之一”结论的实验现象是
_____________。
若装置的气密性良好,去掉烧杯,点燃红磷,在装置完全冷却后,打开弹簧夹,装置的总质量会_____填“增加”、“减少”或“不变”,原因是_________________。
如图是一些探究实验,请回答相关问题。
实验得出的结论是水是由______组成。
关于B实验的下列说法中,正确的是______填字母序号。
A.实验时,红磷的用量不影响最终结果
B.实验前,应先检验装置的气密性
C.点燃红磷前,先用弹簧夹夹紧胶皮管红磷熄灭后,应立即打开弹簧夹
实验能否达到目的并说出理由是______。
小屹同学在学习了实验室制取二氧化碳的原理和装置后,对验证质量守恒定律的实验装置进行了改进:如下图所示,实验前天平平衡。
制取二氧化碳原理:
?
将注射器中适量的稀盐酸注入锥形瓶中,观察到天平的指针__________________填“偏左”、“偏右”或“在标尺中央”,下同。上述实验的反应结束后,松开锥形瓶上的橡皮塞,天平的指针____________________。
结论:为验证质量守恒定律,若有气体参与或生成的实验必须在______________填“开放”或“密闭”装置进行探究。
答案和解析
1.【答案】B
解:A、化合物是由不同种元素组成的,所以由不同种元素组成的物质一定是化合物错误,还有可能是混合物;故选项错误;
B、氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧元素正确,依据是质量守恒定律;故选项正确;
C、在原子中质子数等于核外电子数,所以所有的微粒中质子数一定等于核外电子数错误,同一种原子和离子核外电子数不同;故选项错误;
D、稀有气体元素的原子最外层电子数为氦除外,因此微粒??一定是稀有气体元素的原子错误,该微粒可能是离子;故选项错误;
故选:B。
化合物是由不同种元素组成的,所以由不同种元素组成的物质一定是化合物错误,还有可能是混合物;氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧元素正确,依据是质量守恒定律;在原子中质子数等于核外电子数,所以所有的微粒中质子数一定等于核外电子数错误,同一种原子和离子核外电子数不同;稀有气体元素的原子最外层电子数为氦除外,因此微粒??一定是稀有气体元素的原子错误,该微粒可能是离子.
本考点考查了物质的分类和微粒结构示意图,要加强记忆有关的等基本概念,并能够区分应用.本考点的基础性比较强,主要出现在选择题和填空题中.
2.【答案】C
解:蒸发后的固体为混合物,反应前的固体是四种金属,所以为硫酸根的质量,在硫酸中,氢元素与硫酸根的质量比为:96,设产生的氢气的总质量为x,则::48g,。
故选:C。
根据蒸发后的固体混合物的质量减去反应前的固体是四种金属混合物的质量就是硫酸中硫酸根的质量,由氢元素和硫酸根的质量比可以进行分析解答本题.
本题难度较大,考查学生根据元素守恒律灵活运用知识的能力.
3.【答案】C
解:由表中数据分析可知,反应前后甲的质量减少了,故是反应物,参加反应的质量为2g;同理可以确定乙的质量不变,可能作该反应的催化剂,也可能没有参加反应;丙是生成物,生成的质量为;由质量守恒定律,丁应是反应物,参加反应的质量为;故Z的数值为.
A、参加反应的甲和丁的质量比为2g::8,故选项说法正确。
B、反应中,生成丙的质量为,则参加反应的甲和丁的质量之和为9g,则,则,故选项说法正确。
C、乙的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
D、该反应的反应物为甲和丁,生成物是丙,符合“多变一”的形式,属于化合反应,丙是化合反应的生成物,一定是化合物,故选项说法正确。
故选:C。
反应后质量增加的属于生成物,反应后质量减少的属于反应物,反应后质量不变可能属于催化剂,进行分析判断。
本题难度不大,考查的是质量守恒定律的应用,解题的关键是分析表中数据反应后质量增加的属于生成物、质量减少的属于反应物,灵活运用质量守恒定律.
4.【答案】C
【解析】解:从化学方程式看,反应前有碳原子3个、氧原子4个、氢原子4个;反应后2个水分子中氢原子4个、氧原子2个,根据质量守恒定律,化学反应前后原子种类不变与原子数目不变,所以一个X分子中含有3个碳原子、2个氧原子,故可知物质X的化学式为。
故选:C。
根据化学反应前后原子种类不变与原子数目不变,结合反应的化学方程式可求得物质X的化学式.
掌握有关化学式的计算和推断方法,掌握质量守恒定律的内容、涵义及其实际应用,难度较大.
5.【答案】A
【解析】解:蒸馏水是由氢元素与氧元素组成的,蒸馏水不能养鱼是因为蒸馏水溶解的氧气太少,选项说法错误;
B.煤的燃烧属于化学变化,所有化学变化都遵循质量守恒定律,质量减少的原因是生成的二氧化碳逸散到空气中了,选项说法正确;
C.石墨具有导电性,所以可用石墨来制电极,选项说法正确;
D.二氧化碳不燃烧、也不支持燃烧,所以把燃着的木条伸入集气瓶中,火焰熄灭,瓶内的气体可能是二氧化碳,选项说法正确。
故选:A。
A.根据物质的性质与组成来分析;
B.根据所有化学反应均遵循质量守恒定律来分析;
C.根据石墨的性质与用途来分析;
D.根据气体的性质来分析。
本题考查了物质的组成与性质、质量守恒定律等,难度不大。
6.【答案】C
【解析】解:中含有碳元素的质量为:,水中含有氢元素的质量为:,生成物二氧化碳和水所含碳、氢元素的质量和,,则该物质中一定含有碳、氢、氧三种元素。
故选:C。
根据质量守恒定律,反应前后元素种类、质量均不变,由生成物可以初步确定该物质中含有氢元素和碳元素,由生成的二氧化碳和水中碳、氢元素的质量和与该物质的质量进行对比,从而确定该物质的组成元素.
本题难度稍大,主要考查了质量守恒定律、化学式的计算,解题的关键是根据质量守恒定律确定物质的元素组成.
7.【答案】D
【解析】解:根据表格中的数据和质量守恒定律,可知:甲反应后质量减少了14g,是反应物;丁反应后质量增加了17g,是生成物;根据质量守恒定律可知,乙物质是反应物,反应了3g,则未测值为:。
A、未测值为:,不符合题意;
B、丙质量不变,不一定是催化剂,可能没有参与反应,不符合题意;
C、乙物质是反应物,反应了3g,不符合题意;
D、甲与乙反应的质量比为::::符合题意。
故选:D。
根据表格中的数据和质量守恒定律,可知:反应后质量增加的物质是生成物,质量减少的物质是反应物,质量不变的物质可能是催化剂,也可能既不是反应物,也不是生成物.
在化学反应中遵循质量守恒定律,参加反应的物质的质量总和等于反应后生成的物质的质量总和.
8.【答案】D
【解析】解:根据反应的化学方程式,根据反应前后原子种类、数目不变,反应物中C原子个数为2,生成物中C原子个数为x,反应前后C原子相等,则;
根据在化合物中正负化合价代数和为零,氧元素显,设铬元素的化合价为x,可知中Cr元素的化合价为:,则。
故选:D。
根据质量守恒定律:反应前后原子种类、数目均不变,据此由反应的化学方程式计算x的数值;根据在化合物中正负化合价代数和为零,结合的化学式进行解答.
本题难度不大,考查学生利用化学反应前后原子守恒来确定物质的化学式、利用化合价的原则计算指定元素的化合价的能力.
9.【答案】D
【解析】解:A、硝酸银的质量为:,该选项说法不正确;
B、,该选项说法不正确;
C、X中氮元素的质量为:,氧元素的质量为:,X中氮原子、氧原子的个数比为:::2,X的化学式为,该选项说法不正确;
D、该反应方程式中Ag与的化学计量数之比为::1,该选项说法正确。
故选:D。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
10.【答案】A
【解析】解:A、高氯酸铵中含有氮、氢、氯、氧四种元素,不含碳元素,不可能生成二氧化碳,故选项正确。
B、高氯酸铵中含有氮、氢、氯、氧四种元素,可能生成氧气,故选项错误。
C、高氯酸铵中含有氮、氢、氯、氧四种元素,可能生成水,故选项错误。
D、高氯酸铵中含有氮、氢、氯、氧四种元素,可能生成氯气,故选项错误。
故选:A。
根据质量守恒定律,反应前后元素种类不变,结合题意进行分析解答。
本题难度不大,掌握质量守恒定律反应前后,元素种类不变并能灵活运用是正确解答本题的关键。
11.【答案】D
【解析】
【分析】
一定质量的木炭与过量氧气在密闭容器内加热使其充分反应,木炭在氧气中燃烧生成二氧化碳,据此结合质量守恒定律,进行分析解答.
本题是一道图象坐标与质量守恒定律结合的综合题,解题的关键是结合所涉及的化学知识,正确分析各变化的过程,注意分析坐标轴表示的意义、曲线的起点、折点及变化趋势,进而确定正确的图象.
【解答】
解:A、一定质量的木炭与过量氧气在密闭容器内加热使其充分反应,因为氧气过量,所以最终氧气有剩余,反应后氧气的质量不能为0,故选项图象错误.
B、一定质量的木炭与过量氧气在密闭容器内加热使其充分反应,因为氧气过量,最终木炭完全反应,反应后木炭的质量为0,故选项图象错误.
C、一定质量的木炭与过量氧气在密闭容器内加热使其充分反应,反应前二氧化碳的质量为0,时间为0时,纵坐标应为0,故选项图象错误.
D、反应在密闭容器中进行,所以反应前后物质的总质量不变,故选项图象正确.
故选:D.
12.【答案】D
【解析】解:A、根据化学方程式可知32g氧气与12g碳恰好完全反应,质量守恒定律只能应用于参加化学反应的物质,因此12g碳与38g氧气充分反应,生成的二氧化碳的质量为,故A错误;
B、反应物为聚乙烯和氧气,生成物为二氧化碳和水,氧气中含有氧元素,故根据质量守恒定律,聚乙烯中肯定含有碳、氢两种元素,可能含有氧元素,故B错误;
C、溶质的质量分数为溶质的质量与溶液的质量之比,然后乘以,水的密度为,水的质量为50g,而盐酸的密度大于,50mL盐酸的质量不是50g,故稀释后盐酸溶质的质量分数不是,故C错误;
D、根据质量守恒定律,化学反应前后原子的个数不变,反应后氢氧原子个数比为:2:1,故反应前氢氧原子个数比也为2:1,故D正确;
故选:D。
A、质量守恒定律只适应与参加化学反应的物质,没有参加化学反应的不适用;
B、根据反应物为聚乙烯和氧气,生成物为二氧化碳和水,氧气中含有氧元素进行解答;
C、根据水的密度为,而盐酸的密度大于进行解答;
D、根据化学反应前后原子的个数不变进行解答。
本题是对学过的多种知识的考查,同学们要熟记质量守恒定律的应用范围、溶质质量分数的求法等才能正确解答本题.
13.【答案】AD
【解析】解:A、某纯净物M稍加热就分解为、、,说明M由氮元素、氢元素、氧元素和碳元素组成,该选项说法正确;
B、M是纯净物,因此M中不含有水,该选项说法不正确;
C、M是由不同种元素组成的纯净物,是化合物,该选项说法不正确;
D、M稍加热就分解,说明M不稳定,该选项说法正确。
故选:AD。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
14.【答案】CD
【解析】解:A、,该选项说法不正确;
B、A反应前后质量不变,可能是催化剂,也可能不是催化剂,该选项说法不正确;
C、反应后B质量增大,是生成物,C、D质量减小,都是反应物,即C、D反应生成B,因此B是化合物,该选项说法正确;
D、反应中C和D的质量比是:::3,该选项说法正确。
故选:CD。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
15.【答案】BC
【解析】解:A、硝酸银见光易分解,因此固体应密封保存在棕色广口瓶中,该选项说法不正确;
B、硝酸银质量:,,该选项说法正确;
C、氮的氧化物中,氮元素质量:,氧元素质量:,氮原子、氧原子个数比:::2,X的化学式为,该选项说法正确;
D、生成物中Ag与的物质的量之比为:::1,该选项说法不正确。
故选:BC。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
16.【答案】CD
【解析】解:A、参加反应的的质量为:,该选项说法不正确;
B、物质中碳、氢元素质量比为:::1,该选项说法不正确;
C、生成和的分子个数比为:::3,该选项说法正确;
D、二氧化碳中的碳元素和水中的氢元素来自于该物质,该物质中氧元素质量:,该物质一定含有碳、氢元素、氧元素,该选项说法正确。
故选:CD。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
17.【答案】氧气?
?
天平
【解析】解:空气中体积分数约为的气体是氧气;
地壳中含量最多的固态非金属元素是硅元素,所形成的氧化物中,硅元素化合价是,氧元素化合价是,根据化合物中元素化合价代数和为零可知,氧化物化学式是;
探究化学反应前后各物质之间的质量关系,必须用到的仪器是天平,即需要利用天平进行称量。
故填:氧气;;天平。?
空气中体积分数约为的气体是氧气;
化合物中元素化合价代数和为零;
探究化学反应前后各物质之间的质量关系,必须用到的仪器是天平,即需要利用天平进行称量。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
18.【答案】?
【解析】解:氯酸钾在二氧化锰催化作用下受热分解生成氯化钾和氧气,反应的化学方程式:;
生成氧气质量:。
故填:;.
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
19.【答案】反应生成了氧气?
氧气参加了反应
【解析】解:高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小,是因为反应生成了氧气。
故填:反应生成了氧气。
细铁丝在氧气中燃烧后,生成物的质量比细铁丝的质量大,是因为氧气参加了反应。
故填:氧气参加了反应。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
20.【答案】B?
装置未密闭,生成的二氧化碳气体逸出,导致左盘中容器内物质总质量减小?
化学反应前后,原子的种类、原子的数目和原子的质量都没有发生改变
【解析】解:分析三个实验可以知道,反应A中是在密闭的容器中反应,B是在敞口的容器中反应且生成了气体,而C虽然是敞口的容器中反应但是没有生成气体,所以可以判断反应前后B实验实验前后天平不能保持平衡;
根据化学反应的实质可以知道,在反应的过程中是分子裂解成原子,原子进行了重新组合而得到新的分子,所以该过程中原子的种类、原子的数目和原子的质量都没有发生改变,所以化学反应前后质量守恒;
故答案为:
,装置未密闭,生成的二氧化碳气体逸出,导致左盘中容器内物质总质量减小.
化学反应前后,原子的种类、原子的数目和原子的质量都没有发生改变.
根据三个实验中所发生的反应的来完成解答;
根据化学反应的实质进行分析;
要想解答好这类题目,首先,要理解和熟记与之相关的知识.然后,根据所给的问题情景或图中信息等,结合所学的相关知识和技能,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.
21.【答案】物理变化;
氮;
;2
【解析】
【分析】
本题难度不大,根据物理变化和化学变化的特征进行分析,根据反应前后各种元素化合价的高低进行分析,根据质量守恒定律化学反应前后元素种类不变分析。
【解答】
空气的主要成分是氮气和氧气,利用氮气和氧气沸点的不同,从空气中分离出氮气和氧气过程中没有新物质生成,属于物理变化;
变化前,氨气中氮元素化合价为,氧气中氧元素化合价为0,反应后,一氧化氮中氮元素化合价为,氧元素化合价为,因此在该反应中化合价升高的元素为氮元素;
Ⅰ中氮气和单质甲在一定条件下反应生成氨气,氨气中含有氮元素和氢元素,利用质量守恒定律,反应前后元素种类不变,则参加反应的单质甲为氢气,化学式为。反应Ⅰ、Ⅲ的反应特点是多变一的反应,故属于化合反应。
22.【答案】冷却后,打开止水夹,吸入瓶中的水大约上升五分之一
增加??生成固体的质量大于消耗的红磷质量,且打开弹簧夹后空气进入瓶中,补充消耗的氧气
?
【解析】
【分析】
根据对实验原理及在实验中能得出“氧气约占空气总体积五分之一”这一结论的分析,来推导出对应的实验现象即可;?
根据实验原理及红磷燃烧消耗氧气生成五氧化二磷固体来进行分析解答。
【解答】
测定空气中氧气含量的实验原理是:利用某些物质如红磷与空气中氧气反应不生成气体,生成固体,使容器内压强减小,烧杯中的水倒吸入容器内,测定进入容器内水的体积,即为空气中氧气的体积。所以根据实验现象“冷却后,打开止水夹,吸入瓶中的水大约上升五分之一”可得出“氧气约占空气总体积五分之一”的结论;故填:冷却后,打开止水夹,吸入瓶中的水大约上升五分之一;
红磷和氧气反应,生成固体,根据质量守恒定律可知,生成固体的质量大于消耗的红磷质量,且打开弹簧夹后空气进入瓶中,补充了消耗的氧气,因此点燃红磷,在装置完全冷却后,打开弹簧夹,装置的总质量会增加;故填:增加;生成固体的质量大于消耗的红磷质量,且打开弹簧夹后空气进入瓶中,补充消耗的氧气。
23.【答案】氢元素、氧元素
?
BC
?
不能,这是因为反应生成的二氧化碳逸出装置,导致天平失去平衡
【解析】解:实验中,电解水生成氢气和氧气,得出的结论是水是由氢元素、氧元素组成。
故填:氢元素、氧元素。
实验时,红磷的用量影响最终结果,如果红磷不足,会导致实验结果偏小,该选项说法不正确;
B.实验前,应先检验装置的气密性,该选项说法正确;
C.点燃红磷前,先用弹簧夹夹紧胶皮管,防止集气瓶中的气体膨胀逸出,影响实验结果,该选项说法正确;
D.红磷熄灭后,不能立即打开弹簧夹,应该冷却至室温后打开弹簧夹,该选项说法不正确。
故填:BC。
实验不能达到目的,理由是反应生成的二氧化碳逸出装置,导致天平失去平衡。
故填:不能,这是因为反应生成的二氧化碳逸出装置,导致天平失去平衡。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
24.【答案】在标尺中央,偏右
密闭
【解析】
【分析】
本题考查质量守恒定律的探究,准确掌握参加化学反应的各物质的质量总和等于生成的各物质的质量总和。
【解答】
稀盐酸和碳酸钙反应生成氯化钙,水和二氧化碳,由于是在密闭的装置内反应的,参加化学反应的各物质的质量总和等于生成的各物质的质量总和,故天平指针在标尺中央;实验的反应结束后,松开锥形瓶上的橡皮塞,生成的二氧化碳会飘逸到空气中,导致测得的质量偏小,天平的指针偏右,
故答案是:在标尺中央,偏右;
为验证质量守恒定律,若有气体参与或生成的实验必须在密闭装置进行探究,
故答案是:密闭。
第2页,共2页
第1页,共1页
一、单选题
推理是学习化学的一种方法,以下推理正确的是
A.
化合物是由不同种元素组成的,所以由不同种元素组成的物质一定是化合物
B.
氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧元素
C.
在原子中质子数等于核外电子数,所以所有的微粒中质子数一定等于核外电子数
D.
稀有气体元素的原子最外层电子数为氦除外,因此微粒??一定?是稀有气体元素的原子
将Mg、Al、Fe、Zn四种金属的混合物粉末共25g,加入到一定量的稀硫酸中,恰好完全反应,将所得溶液进行蒸发、结晶、烘干、称量,称得固体总质量为所得固体均不含结晶水,则反应中产生的氢气的总质量为
A.
48
B.
2g
C.
1g
D.
把一定量甲、乙、丙、丁四种物质放入一个密闭容器中,在一定条件下充分反应,测得反应前后各物质的质量如表所示。下列说法不正确的是
物质
甲
乙
丙
丁
反应前质量
10
5
12
16
反应中质量
X
5
21
Y
反应后质量
8
5
30
Z
A.
参加反应的甲和丁的质量比为1:8
B.
C.
乙一定是催化剂
D.
丙一定是化合物
科学家通过宇宙探测仪发现金星大气层中含有物质可以通过下列反应制取:则物质X的化学式为
A.
CO
B.
C.
D.
下列现象的解释或者结论错误的是
A.
蒸馏水不能养金鱼--蒸馏水中不含氧元素
B.
煤燃烧后灰渣质量减小--这个反应遵守质量守恒定律
C.
石墨作电极--石墨具有导电性
D.
把燃着的木条伸入集气瓶中,火焰熄灭--瓶中气体可能是
某物质完全燃烧后生成和水则对该物质相关判断正确的是
A.
该物质只含碳、氢元素
B.
该物质一定含有碳、氢元素,可能含有氧元素
C.
该物质由碳、氢、氧元素组成
D.
无法确定
在一个密闭容器里放入四种物质,使其充分反应,测得数据如下:
四种物质
甲
乙
丙
丁
应前质量
25
15
1
5
应后质量
11
未测
1
22
则下列表述正确的是
A.
未测值3g
B.
丙一定是催化剂
C.
乙全部发生了反应
D.
甲与乙反应的质量比为14:3
“开车不饮酒,饮酒不开车”交警常用“酒精检测仪”检查司机是否饮酒,其检测原理是让司机呼出气体中的酒精与检测仪中的物质发生化变反应:,其中x的值和三氧化铬中铬元素的化合价分别是
A.
2,价
B.
4,价
C.
4,价
D.
2,价
在光照条件下,可分解为
Ag、和某种氮的氧化物
取一定质量的固体充分光照,测得反应后生成Ag、、X的质量分别为、mg、。下列说法正确的是
A.
的质量为
B.
C.
X?的化学式为NO
D.
该反应方程式中Ag与的化学计量数之比为?2:1
高氯酸铵是一种火箭推进剂。实验室加热分解高氯酸铵固体,不可能得到的物质是
A.
B.
C.
D.
一定质量的木炭与过量氧气在密闭容器内加热使其充分反应.图中能正确反映容器内有关的量随时间变化关系的是
A.
B.
C.
D.
以下应用守恒思想解决相关问题,推论正确的是
A.
12g碳与38g氧气充分反应,根据质量守恒推出生成的二氧化碳的质量为50g
B.
聚乙烯燃烧生成二氧化碳和水,根据元素守恒推出聚乙烯由碳、氢、氧元素组成
C.
的盐酸用50mL水稀释,根据溶质守恒推出稀盐酸的溶质质量分数为
D.
水电解生成和的分子数比为2:l,根据原子守恒推出水分子中H、O原子数比为2:1
二、多选题
某纯净物M稍加热就分解为、、,据此实验事实得出的结论是
A.
M由四种元素组成
B.
M中有水
C.
M是单质
D.
M不稳定
在一定条件下,向一个密闭容器中加入A、B、C、D四种物质各20克,充分反应后测得数据见表;下列说法中正确的是
物质
A
B
C
D
反应前质量
20
20
20
20
反应后质量
20
30
X
14
A.
B.
A一定是该反应的催化剂
C.
B一定是化合物
D.
反应中C和D的质量比是2:3
在光照条件下,可分解为Ag、和某种氮的氧化物X。取一定质量的固体充分光照,测得生成Ag、、X的质量分别为、mg、。说法正确的是
A.
固体应密封保存在无色细口瓶中
B.
C.
X的化学式为
D.
生成物中Ag与的物质的量之比为3:2
某物质与氧气充分反应,生成和。下列说法正确是
A.
参加反应的的质量为
B.
该物质中碳、氢元素质量比为1:3
C.
生成和的分子个数比为2:3
D.
该物质一定含有碳、氢元素、氧元素
三、填空题
空气中体积分数约为的气体是
______
;地壳中含量最多的固态非金属元素所形成的氧化物的化学式为
______
;探究化学反应前后各物质之间的质量关系,必须用到的仪器是
______
。
实验室取氯酸钾和二氧化锰的混合物28g,加热完全反应后,冷却称量,剩余固体质量为。加热时反应的方程式为
______
,生成氧气的质量为
______
g。
用质量守恒定律解释下列问题。
高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小
______
。
细铁丝在氧气中燃烧后,生成物的质量比细铁丝的质量大
______
。
质量守恒定律的发现对化学的发展作出了重要贡献
用如图所示的3个实验验证质量守恒定律,其中实验前后天平不能保持平衡的是
______
填序号,理由是
______
.
从微观角度分析,化学反应中质量守恒的原因是
______
.
四、推断题
利用空气制取氮肥的流程如图所示。
从空气中分离出氮气和氧气属于?
?
?
?
?
?
?
?填物理变化或化学变化??
操作Ⅱ反应为,在该反应中化合价升高的元素为?
?
?
?。
Ⅰ中参加反应的单质甲为____填化学式,Ⅰ、Ⅱ、Ⅲ三个变化中属于化合反应的有?
?
?
?个。
五、实验题
化学是一门以实验为基础的科学,实验是学习化学的一条重要途径。根据以下实验解答下列问题:
如图是测定空气中氧气含量的实验装置。实验中能得出“氧气约占空气总体积五分之一”结论的实验现象是
_____________。
若装置的气密性良好,去掉烧杯,点燃红磷,在装置完全冷却后,打开弹簧夹,装置的总质量会_____填“增加”、“减少”或“不变”,原因是_________________。
如图是一些探究实验,请回答相关问题。
实验得出的结论是水是由______组成。
关于B实验的下列说法中,正确的是______填字母序号。
A.实验时,红磷的用量不影响最终结果
B.实验前,应先检验装置的气密性
C.点燃红磷前,先用弹簧夹夹紧胶皮管红磷熄灭后,应立即打开弹簧夹
实验能否达到目的并说出理由是______。
小屹同学在学习了实验室制取二氧化碳的原理和装置后,对验证质量守恒定律的实验装置进行了改进:如下图所示,实验前天平平衡。
制取二氧化碳原理:
?
将注射器中适量的稀盐酸注入锥形瓶中,观察到天平的指针__________________填“偏左”、“偏右”或“在标尺中央”,下同。上述实验的反应结束后,松开锥形瓶上的橡皮塞,天平的指针____________________。
结论:为验证质量守恒定律,若有气体参与或生成的实验必须在______________填“开放”或“密闭”装置进行探究。
答案和解析
1.【答案】B
解:A、化合物是由不同种元素组成的,所以由不同种元素组成的物质一定是化合物错误,还有可能是混合物;故选项错误;
B、氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧元素正确,依据是质量守恒定律;故选项正确;
C、在原子中质子数等于核外电子数,所以所有的微粒中质子数一定等于核外电子数错误,同一种原子和离子核外电子数不同;故选项错误;
D、稀有气体元素的原子最外层电子数为氦除外,因此微粒??一定是稀有气体元素的原子错误,该微粒可能是离子;故选项错误;
故选:B。
化合物是由不同种元素组成的,所以由不同种元素组成的物质一定是化合物错误,还有可能是混合物;氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧元素正确,依据是质量守恒定律;在原子中质子数等于核外电子数,所以所有的微粒中质子数一定等于核外电子数错误,同一种原子和离子核外电子数不同;稀有气体元素的原子最外层电子数为氦除外,因此微粒??一定是稀有气体元素的原子错误,该微粒可能是离子.
本考点考查了物质的分类和微粒结构示意图,要加强记忆有关的等基本概念,并能够区分应用.本考点的基础性比较强,主要出现在选择题和填空题中.
2.【答案】C
解:蒸发后的固体为混合物,反应前的固体是四种金属,所以为硫酸根的质量,在硫酸中,氢元素与硫酸根的质量比为:96,设产生的氢气的总质量为x,则::48g,。
故选:C。
根据蒸发后的固体混合物的质量减去反应前的固体是四种金属混合物的质量就是硫酸中硫酸根的质量,由氢元素和硫酸根的质量比可以进行分析解答本题.
本题难度较大,考查学生根据元素守恒律灵活运用知识的能力.
3.【答案】C
解:由表中数据分析可知,反应前后甲的质量减少了,故是反应物,参加反应的质量为2g;同理可以确定乙的质量不变,可能作该反应的催化剂,也可能没有参加反应;丙是生成物,生成的质量为;由质量守恒定律,丁应是反应物,参加反应的质量为;故Z的数值为.
A、参加反应的甲和丁的质量比为2g::8,故选项说法正确。
B、反应中,生成丙的质量为,则参加反应的甲和丁的质量之和为9g,则,则,故选项说法正确。
C、乙的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
D、该反应的反应物为甲和丁,生成物是丙,符合“多变一”的形式,属于化合反应,丙是化合反应的生成物,一定是化合物,故选项说法正确。
故选:C。
反应后质量增加的属于生成物,反应后质量减少的属于反应物,反应后质量不变可能属于催化剂,进行分析判断。
本题难度不大,考查的是质量守恒定律的应用,解题的关键是分析表中数据反应后质量增加的属于生成物、质量减少的属于反应物,灵活运用质量守恒定律.
4.【答案】C
【解析】解:从化学方程式看,反应前有碳原子3个、氧原子4个、氢原子4个;反应后2个水分子中氢原子4个、氧原子2个,根据质量守恒定律,化学反应前后原子种类不变与原子数目不变,所以一个X分子中含有3个碳原子、2个氧原子,故可知物质X的化学式为。
故选:C。
根据化学反应前后原子种类不变与原子数目不变,结合反应的化学方程式可求得物质X的化学式.
掌握有关化学式的计算和推断方法,掌握质量守恒定律的内容、涵义及其实际应用,难度较大.
5.【答案】A
【解析】解:蒸馏水是由氢元素与氧元素组成的,蒸馏水不能养鱼是因为蒸馏水溶解的氧气太少,选项说法错误;
B.煤的燃烧属于化学变化,所有化学变化都遵循质量守恒定律,质量减少的原因是生成的二氧化碳逸散到空气中了,选项说法正确;
C.石墨具有导电性,所以可用石墨来制电极,选项说法正确;
D.二氧化碳不燃烧、也不支持燃烧,所以把燃着的木条伸入集气瓶中,火焰熄灭,瓶内的气体可能是二氧化碳,选项说法正确。
故选:A。
A.根据物质的性质与组成来分析;
B.根据所有化学反应均遵循质量守恒定律来分析;
C.根据石墨的性质与用途来分析;
D.根据气体的性质来分析。
本题考查了物质的组成与性质、质量守恒定律等,难度不大。
6.【答案】C
【解析】解:中含有碳元素的质量为:,水中含有氢元素的质量为:,生成物二氧化碳和水所含碳、氢元素的质量和,,则该物质中一定含有碳、氢、氧三种元素。
故选:C。
根据质量守恒定律,反应前后元素种类、质量均不变,由生成物可以初步确定该物质中含有氢元素和碳元素,由生成的二氧化碳和水中碳、氢元素的质量和与该物质的质量进行对比,从而确定该物质的组成元素.
本题难度稍大,主要考查了质量守恒定律、化学式的计算,解题的关键是根据质量守恒定律确定物质的元素组成.
7.【答案】D
【解析】解:根据表格中的数据和质量守恒定律,可知:甲反应后质量减少了14g,是反应物;丁反应后质量增加了17g,是生成物;根据质量守恒定律可知,乙物质是反应物,反应了3g,则未测值为:。
A、未测值为:,不符合题意;
B、丙质量不变,不一定是催化剂,可能没有参与反应,不符合题意;
C、乙物质是反应物,反应了3g,不符合题意;
D、甲与乙反应的质量比为::::符合题意。
故选:D。
根据表格中的数据和质量守恒定律,可知:反应后质量增加的物质是生成物,质量减少的物质是反应物,质量不变的物质可能是催化剂,也可能既不是反应物,也不是生成物.
在化学反应中遵循质量守恒定律,参加反应的物质的质量总和等于反应后生成的物质的质量总和.
8.【答案】D
【解析】解:根据反应的化学方程式,根据反应前后原子种类、数目不变,反应物中C原子个数为2,生成物中C原子个数为x,反应前后C原子相等,则;
根据在化合物中正负化合价代数和为零,氧元素显,设铬元素的化合价为x,可知中Cr元素的化合价为:,则。
故选:D。
根据质量守恒定律:反应前后原子种类、数目均不变,据此由反应的化学方程式计算x的数值;根据在化合物中正负化合价代数和为零,结合的化学式进行解答.
本题难度不大,考查学生利用化学反应前后原子守恒来确定物质的化学式、利用化合价的原则计算指定元素的化合价的能力.
9.【答案】D
【解析】解:A、硝酸银的质量为:,该选项说法不正确;
B、,该选项说法不正确;
C、X中氮元素的质量为:,氧元素的质量为:,X中氮原子、氧原子的个数比为:::2,X的化学式为,该选项说法不正确;
D、该反应方程式中Ag与的化学计量数之比为::1,该选项说法正确。
故选:D。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
10.【答案】A
【解析】解:A、高氯酸铵中含有氮、氢、氯、氧四种元素,不含碳元素,不可能生成二氧化碳,故选项正确。
B、高氯酸铵中含有氮、氢、氯、氧四种元素,可能生成氧气,故选项错误。
C、高氯酸铵中含有氮、氢、氯、氧四种元素,可能生成水,故选项错误。
D、高氯酸铵中含有氮、氢、氯、氧四种元素,可能生成氯气,故选项错误。
故选:A。
根据质量守恒定律,反应前后元素种类不变,结合题意进行分析解答。
本题难度不大,掌握质量守恒定律反应前后,元素种类不变并能灵活运用是正确解答本题的关键。
11.【答案】D
【解析】
【分析】
一定质量的木炭与过量氧气在密闭容器内加热使其充分反应,木炭在氧气中燃烧生成二氧化碳,据此结合质量守恒定律,进行分析解答.
本题是一道图象坐标与质量守恒定律结合的综合题,解题的关键是结合所涉及的化学知识,正确分析各变化的过程,注意分析坐标轴表示的意义、曲线的起点、折点及变化趋势,进而确定正确的图象.
【解答】
解:A、一定质量的木炭与过量氧气在密闭容器内加热使其充分反应,因为氧气过量,所以最终氧气有剩余,反应后氧气的质量不能为0,故选项图象错误.
B、一定质量的木炭与过量氧气在密闭容器内加热使其充分反应,因为氧气过量,最终木炭完全反应,反应后木炭的质量为0,故选项图象错误.
C、一定质量的木炭与过量氧气在密闭容器内加热使其充分反应,反应前二氧化碳的质量为0,时间为0时,纵坐标应为0,故选项图象错误.
D、反应在密闭容器中进行,所以反应前后物质的总质量不变,故选项图象正确.
故选:D.
12.【答案】D
【解析】解:A、根据化学方程式可知32g氧气与12g碳恰好完全反应,质量守恒定律只能应用于参加化学反应的物质,因此12g碳与38g氧气充分反应,生成的二氧化碳的质量为,故A错误;
B、反应物为聚乙烯和氧气,生成物为二氧化碳和水,氧气中含有氧元素,故根据质量守恒定律,聚乙烯中肯定含有碳、氢两种元素,可能含有氧元素,故B错误;
C、溶质的质量分数为溶质的质量与溶液的质量之比,然后乘以,水的密度为,水的质量为50g,而盐酸的密度大于,50mL盐酸的质量不是50g,故稀释后盐酸溶质的质量分数不是,故C错误;
D、根据质量守恒定律,化学反应前后原子的个数不变,反应后氢氧原子个数比为:2:1,故反应前氢氧原子个数比也为2:1,故D正确;
故选:D。
A、质量守恒定律只适应与参加化学反应的物质,没有参加化学反应的不适用;
B、根据反应物为聚乙烯和氧气,生成物为二氧化碳和水,氧气中含有氧元素进行解答;
C、根据水的密度为,而盐酸的密度大于进行解答;
D、根据化学反应前后原子的个数不变进行解答。
本题是对学过的多种知识的考查,同学们要熟记质量守恒定律的应用范围、溶质质量分数的求法等才能正确解答本题.
13.【答案】AD
【解析】解:A、某纯净物M稍加热就分解为、、,说明M由氮元素、氢元素、氧元素和碳元素组成,该选项说法正确;
B、M是纯净物,因此M中不含有水,该选项说法不正确;
C、M是由不同种元素组成的纯净物,是化合物,该选项说法不正确;
D、M稍加热就分解,说明M不稳定,该选项说法正确。
故选:AD。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
14.【答案】CD
【解析】解:A、,该选项说法不正确;
B、A反应前后质量不变,可能是催化剂,也可能不是催化剂,该选项说法不正确;
C、反应后B质量增大,是生成物,C、D质量减小,都是反应物,即C、D反应生成B,因此B是化合物,该选项说法正确;
D、反应中C和D的质量比是:::3,该选项说法正确。
故选:CD。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
15.【答案】BC
【解析】解:A、硝酸银见光易分解,因此固体应密封保存在棕色广口瓶中,该选项说法不正确;
B、硝酸银质量:,,该选项说法正确;
C、氮的氧化物中,氮元素质量:,氧元素质量:,氮原子、氧原子个数比:::2,X的化学式为,该选项说法正确;
D、生成物中Ag与的物质的量之比为:::1,该选项说法不正确。
故选:BC。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
16.【答案】CD
【解析】解:A、参加反应的的质量为:,该选项说法不正确;
B、物质中碳、氢元素质量比为:::1,该选项说法不正确;
C、生成和的分子个数比为:::3,该选项说法正确;
D、二氧化碳中的碳元素和水中的氢元素来自于该物质,该物质中氧元素质量:,该物质一定含有碳、氢元素、氧元素,该选项说法正确。
故选:CD。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
17.【答案】氧气?
?
天平
【解析】解:空气中体积分数约为的气体是氧气;
地壳中含量最多的固态非金属元素是硅元素,所形成的氧化物中,硅元素化合价是,氧元素化合价是,根据化合物中元素化合价代数和为零可知,氧化物化学式是;
探究化学反应前后各物质之间的质量关系,必须用到的仪器是天平,即需要利用天平进行称量。
故填:氧气;;天平。?
空气中体积分数约为的气体是氧气;
化合物中元素化合价代数和为零;
探究化学反应前后各物质之间的质量关系,必须用到的仪器是天平,即需要利用天平进行称量。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
18.【答案】?
【解析】解:氯酸钾在二氧化锰催化作用下受热分解生成氯化钾和氧气,反应的化学方程式:;
生成氧气质量:。
故填:;.
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
19.【答案】反应生成了氧气?
氧气参加了反应
【解析】解:高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小,是因为反应生成了氧气。
故填:反应生成了氧气。
细铁丝在氧气中燃烧后,生成物的质量比细铁丝的质量大,是因为氧气参加了反应。
故填:氧气参加了反应。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
20.【答案】B?
装置未密闭,生成的二氧化碳气体逸出,导致左盘中容器内物质总质量减小?
化学反应前后,原子的种类、原子的数目和原子的质量都没有发生改变
【解析】解:分析三个实验可以知道,反应A中是在密闭的容器中反应,B是在敞口的容器中反应且生成了气体,而C虽然是敞口的容器中反应但是没有生成气体,所以可以判断反应前后B实验实验前后天平不能保持平衡;
根据化学反应的实质可以知道,在反应的过程中是分子裂解成原子,原子进行了重新组合而得到新的分子,所以该过程中原子的种类、原子的数目和原子的质量都没有发生改变,所以化学反应前后质量守恒;
故答案为:
,装置未密闭,生成的二氧化碳气体逸出,导致左盘中容器内物质总质量减小.
化学反应前后,原子的种类、原子的数目和原子的质量都没有发生改变.
根据三个实验中所发生的反应的来完成解答;
根据化学反应的实质进行分析;
要想解答好这类题目,首先,要理解和熟记与之相关的知识.然后,根据所给的问题情景或图中信息等,结合所学的相关知识和技能,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.
21.【答案】物理变化;
氮;
;2
【解析】
【分析】
本题难度不大,根据物理变化和化学变化的特征进行分析,根据反应前后各种元素化合价的高低进行分析,根据质量守恒定律化学反应前后元素种类不变分析。
【解答】
空气的主要成分是氮气和氧气,利用氮气和氧气沸点的不同,从空气中分离出氮气和氧气过程中没有新物质生成,属于物理变化;
变化前,氨气中氮元素化合价为,氧气中氧元素化合价为0,反应后,一氧化氮中氮元素化合价为,氧元素化合价为,因此在该反应中化合价升高的元素为氮元素;
Ⅰ中氮气和单质甲在一定条件下反应生成氨气,氨气中含有氮元素和氢元素,利用质量守恒定律,反应前后元素种类不变,则参加反应的单质甲为氢气,化学式为。反应Ⅰ、Ⅲ的反应特点是多变一的反应,故属于化合反应。
22.【答案】冷却后,打开止水夹,吸入瓶中的水大约上升五分之一
增加??生成固体的质量大于消耗的红磷质量,且打开弹簧夹后空气进入瓶中,补充消耗的氧气
?
【解析】
【分析】
根据对实验原理及在实验中能得出“氧气约占空气总体积五分之一”这一结论的分析,来推导出对应的实验现象即可;?
根据实验原理及红磷燃烧消耗氧气生成五氧化二磷固体来进行分析解答。
【解答】
测定空气中氧气含量的实验原理是:利用某些物质如红磷与空气中氧气反应不生成气体,生成固体,使容器内压强减小,烧杯中的水倒吸入容器内,测定进入容器内水的体积,即为空气中氧气的体积。所以根据实验现象“冷却后,打开止水夹,吸入瓶中的水大约上升五分之一”可得出“氧气约占空气总体积五分之一”的结论;故填:冷却后,打开止水夹,吸入瓶中的水大约上升五分之一;
红磷和氧气反应,生成固体,根据质量守恒定律可知,生成固体的质量大于消耗的红磷质量,且打开弹簧夹后空气进入瓶中,补充了消耗的氧气,因此点燃红磷,在装置完全冷却后,打开弹簧夹,装置的总质量会增加;故填:增加;生成固体的质量大于消耗的红磷质量,且打开弹簧夹后空气进入瓶中,补充消耗的氧气。
23.【答案】氢元素、氧元素
?
BC
?
不能,这是因为反应生成的二氧化碳逸出装置,导致天平失去平衡
【解析】解:实验中,电解水生成氢气和氧气,得出的结论是水是由氢元素、氧元素组成。
故填:氢元素、氧元素。
实验时,红磷的用量影响最终结果,如果红磷不足,会导致实验结果偏小,该选项说法不正确;
B.实验前,应先检验装置的气密性,该选项说法正确;
C.点燃红磷前,先用弹簧夹夹紧胶皮管,防止集气瓶中的气体膨胀逸出,影响实验结果,该选项说法正确;
D.红磷熄灭后,不能立即打开弹簧夹,应该冷却至室温后打开弹簧夹,该选项说法不正确。
故填:BC。
实验不能达到目的,理由是反应生成的二氧化碳逸出装置,导致天平失去平衡。
故填:不能,这是因为反应生成的二氧化碳逸出装置,导致天平失去平衡。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
24.【答案】在标尺中央,偏右
密闭
【解析】
【分析】
本题考查质量守恒定律的探究,准确掌握参加化学反应的各物质的质量总和等于生成的各物质的质量总和。
【解答】
稀盐酸和碳酸钙反应生成氯化钙,水和二氧化碳,由于是在密闭的装置内反应的,参加化学反应的各物质的质量总和等于生成的各物质的质量总和,故天平指针在标尺中央;实验的反应结束后,松开锥形瓶上的橡皮塞,生成的二氧化碳会飘逸到空气中,导致测得的质量偏小,天平的指针偏右,
故答案是:在标尺中央,偏右;
为验证质量守恒定律,若有气体参与或生成的实验必须在密闭装置进行探究,
故答案是:密闭。
第2页,共2页
第1页,共1页
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
