高中化学人教版(2019)选择性必修二共价键 课件(共39张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修二共价键 课件(共39张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-09 16:03:35 | ||
图片预览



文档简介
高二年级 化学
选择性必修 2 物质结构与性质 第二章 分子结构与性质
共价键
学习目标
1. 能认识原子间通过原子轨道重叠形成共价键,
能说出共价键的分类、特征。
2. 能用模型、符号、图像等正确表征简单分子中原
子轨道的重叠方式。
3. 能理解键参数的含义并用其解释分子的某些性质。
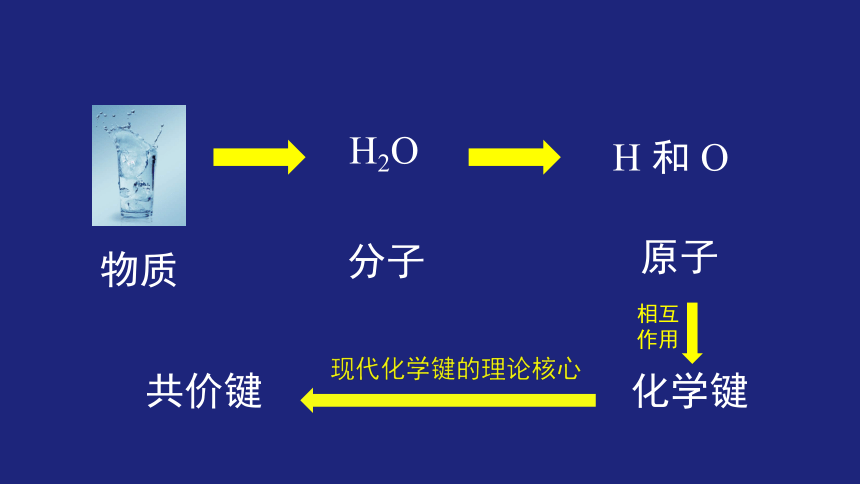
H2O
分子
现代化学键的理论核心
共价键
化学键
相互
作用
物质
原子
H 和 O
请用电子式表示 H2 的形成过程并回忆共价键的含义。
一、共价键
H · + ·H → H : H
基础回顾
1. 共用电子对角度初识共价键
原子之间通过共用电子对形成的相互作用叫共价键。
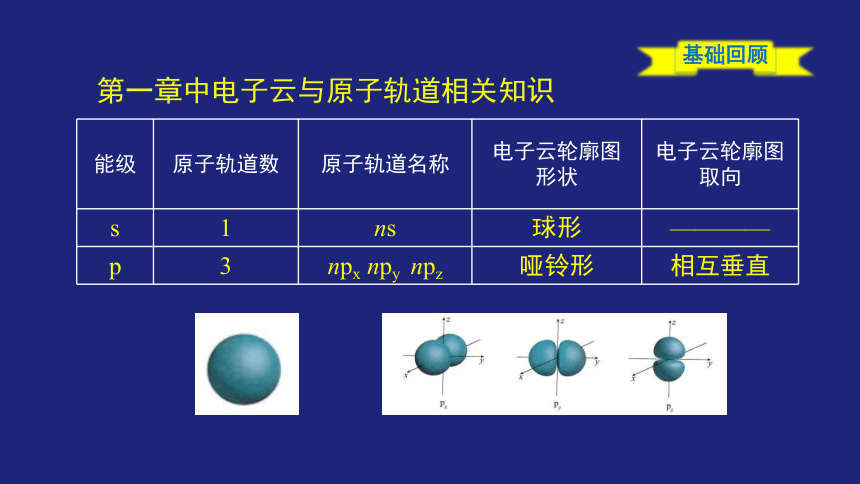
第一章中电子云与原子轨道相关知识
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}能级
原子轨道数
原子轨道名称
电子云轮廓图
形状
电子云轮廓图
取向
s
1
ns
球形
————
p
3
npx npy npz
哑铃形
相互垂直
基础回顾
H
H
H
H
原子轨道重叠 → 电子在核间出现概率增大
2. 原子轨道角度理解共价键—H2
↑
1s
↓
1s
H
?
H
?
↓
1s
Cl
?
?
H
?
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
2. 原子轨道角度理解共价键—HCl
?
?
?
?
?
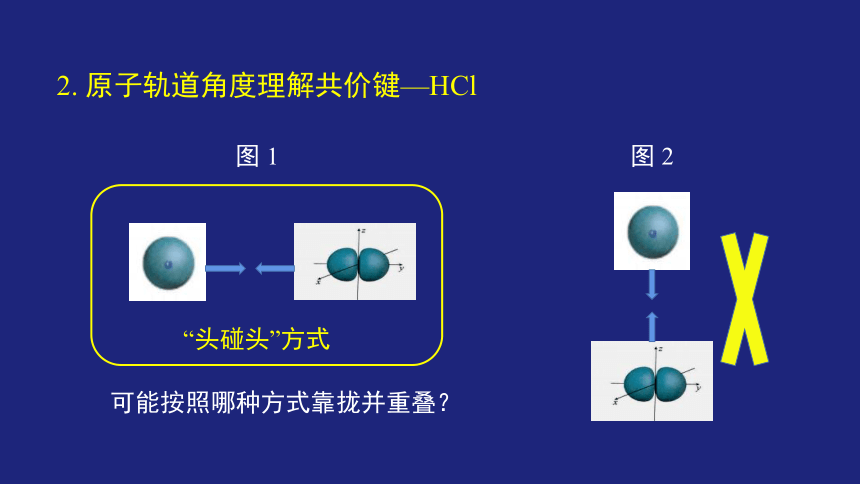
2. 原子轨道角度理解共价键—HCl
图 1
图 2
可能按照哪种方式靠拢并重叠?
“头碰头”方式
↓
1S
Cl
?
?
?
?
?
H
?
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
原子轨道“头碰头”重叠
形成共价键
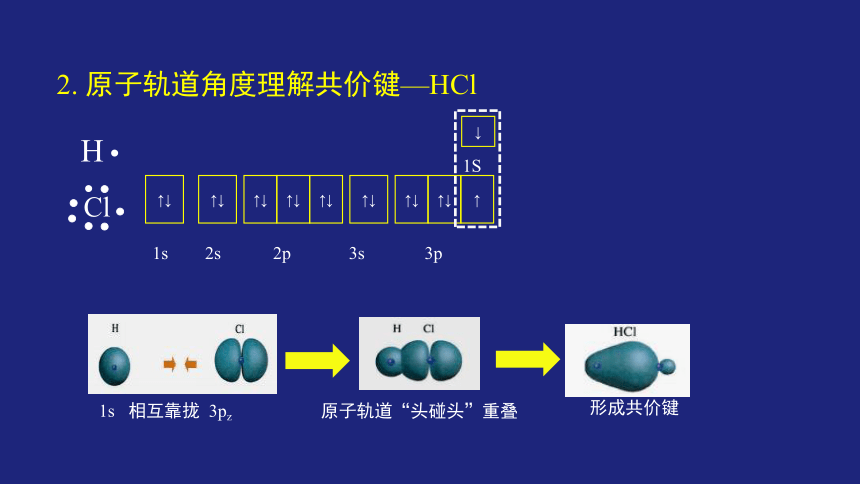
2. 原子轨道角度理解共价键—HCl
?
?
1s 相互靠拢 3pz
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↓
1s
2s
2p
3s
3p
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
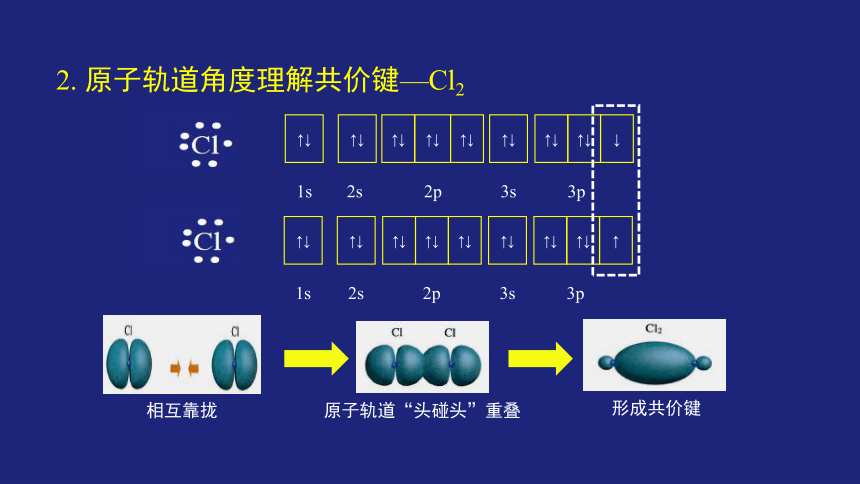
相互靠拢
原子轨道“头碰头”重叠
形成共价键
2. 原子轨道角度理解共价键—Cl2
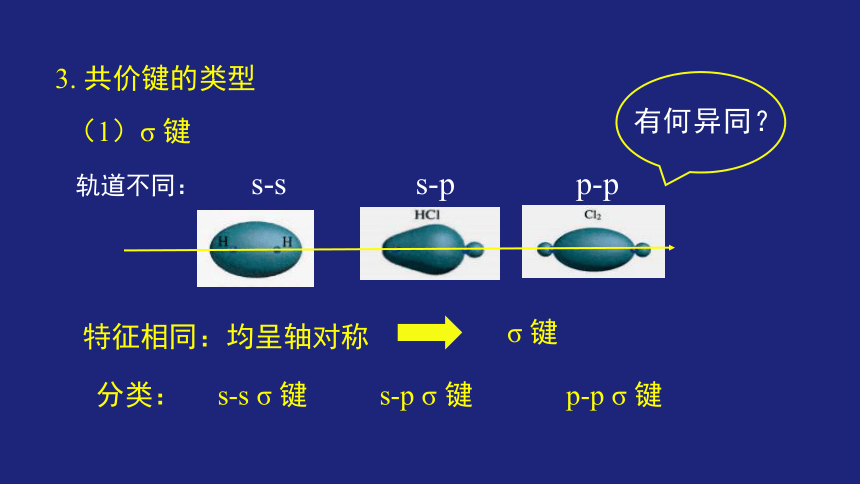
轨道不同: s-s s-p p-p
特征相同:均呈轴对称
σ 键
3. 共价键的类型
(1)σ 键
有何异同?
分类: s-s σ 键 s-p σ 键 p-p σ 键
(2)π 键
特征:呈镜面对称
π 键( p - p π 键 )
“头碰头”靠拢后重叠
p - pσ键
“肩并肩”靠拢后重叠
3. 共价键的类型
请尝试画一画 N2(N≡N)原子轨道重叠过程。
↑
↑
↑
↑↓
↑↓
1s
2s
2p
?
?
N
?
?
?
↓
↓
↓
↑↓
↑↓
1s
2s
2p
思考讨论
p-p σ 键
px
思考
请尝试画一画N2(N≡N)原子轨道重叠过程。
p-p π 键
pz
py
p-p π 键
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A} 键型
σ 键
π 键
成键方向
特征
(3)小结
成键判断
及规律
①共价单键是 σ 键;
②共价双键中有一个是 σ 键,另一个是 π键;
③共价三键中有一个是 σ 键,另两个是 π 键。
项目
沿轴方向
“头碰头”
轴对称,可旋转
平行方向
“肩并肩”
镜面对称,不可旋转
观察下列分子结构,它们分子中共价键由几个 σ 键、几个 π 键构成?
7个 σ 键
无 π 键
5个 σ 键
1个 π 键
3 个 σ 键
2 个 π 键
思考
结合乙烷、乙烯和乙炔的化学性质分析 π 键和 σ 键的强度是否相同?
乙烯和乙炔:加成反应 π 键更易断裂
乙烷:取代反应 σ 键相对更稳定
思考
结论:π 键和 σ 键的强度不同
乙烯和乙炔分子中π 键不如 σ 键牢固
(1)饱和性:
原子有几个未成对电子,便可和几个电子配对成键。
(2)方向性(s-s σ 键除外):
原子轨道之间会按照一定的方向进行重叠。
4. 共价键的特征
H3 H2Cl?
5. 共价键形成的条件
钠和氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子
和氯原子共用形成共价键而形成离子键呢?请从元素电负性差别理解 。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}原子
Na Cl
H Cl
C O
电负性
0.9 3.0
2.1 3.0
2.5 3.5
电负性之差
(绝对值)
2.1
0.9
1.0
结论:当原子电负性相差很大时,化学反应形成的电子对不会被
共用,形成的是离子键;电负性相差不大时形成共价键。
1.7
二、键参数—键能、键长、键角
1. 键能:
气态分子中1 mol 化学键解离成气态原子所吸收的能量。
键能通常是 298.15 K、101 kPa 条件下的标准值,其单位为 kJ/mol。
成键 放出能量
断键 吸收能量
热效应
ΔH = 反应物总键能 - 生成物总键能
ΔH > 0 吸热反应
ΔH < 0 放热反应
思考
从计算结果看 HCl 和 HBr 哪个更容易分解呢?
ΔH = 反应物总键能 - 生成物总键能
ΔH (HCl) = [ ( 436 + 242.7 ) - 2×431.8 ] kJ/mol = - 184.9 kJ/mol
ΔH (HBr) = [ ( 436 + 193.7 ) - 2×366 ] kJ/mol = - 102.3 kJ/mol
利用 P37 表 2-1 数据计算,1 mol H2 分别与1 mol Cl2、1mol Br2
反应,分别形成 2 mol HCl 和 2 mol HBr 哪个释放能量多??
HBr 分解需吸收能量少,更易分解。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}键
键能
C-C
347.7
C = C
615
C = C
812
请结合下列数据思考为何碳碳双键的键能不是碳碳单键的二倍,碳碳三键的键能不是碳碳单键的三倍?
碳碳单键:1 个 σ 键
碳碳双键:1 个 σ 键,1个 π 键
碳碳三键:1 个 σ 键,2个 π 键
思考
σ 键与 π 键
强度不同
乙烯分子中
σ 键强于π 键
键能越大,共价键越牢固
键能:衡量共价键强弱的参数
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}键
键能
N-H
390.8
O-H
462.8
H-F
568
请结合教材 P37表 2-1 分析,从键能的角度如何理解
N2、O2、F2 跟 H2 的反应能力依次增强这一化学事实?
共价键:越来越牢固
产物:越来越稳定
结论:与氢气反应能力越来越强
思考
大
小
2. 键长:
构成化学键的两个原子之间的核间距,
其单位为 pm。 (1pm=10-12 m)
成键原子半径之和______键长
大于
二、键参数—键能、键长、键角
结合教材 P37表 2-1和 P38表 2-2
分析键长和键能是否有一定相关性?
思考它们对分子的化学性质有何影响?
思考
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}键
键能
键长
H-F
565.0
92
H-Cl
428.0
128
H-Br
362.0
141
一般情况下,
键长越短,键能越大。
化学键越牢固,
含该共价键的分子越稳定。
键长:衡量共价键强弱的参数
稳
定
性
减
弱
自主探究
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}键
键能
键长
F-F
157
141
Cl-Cl
242.7
198
Br-Br
193.7
228
F—F 键键长最短,键能却最小?
查阅资料,寻找原因。
二、键参数—键能、键长、键角
3. 键角:
在多原子分子中,两个相邻共价键之间的夹角称为键角。
键长和键角的数值测定方法:晶体的 X 射线衍射实验
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子
空间结构模型
键角
CO2
180°
H2O
105°
NH3
107°
CH4
109°28′
多原子分子中的键角一定
键角:描述分子空间结构的参数
图表导学
本课小结
特征
方向性
饱和性
σ 键:轴对称
分
类
π 键:镜面对称
原子间
相互作用
共价键
原子
轨道重叠
本课小结
原子间
相互作用
共价键
键参数
定量
键角
键长
键能
键的
强弱
分子的
稳定性
特征
方向性
饱和性
测定
晶体 X 射线衍射实验
分子空间结构
原子
轨道重叠
σ 键:轴对称
分
类
π 键:镜面对称
下列关于 σ 键和 π 键说法错误的是( )
A. σ 键的电子云图形是轴对称,π 键电子云图形是镜面对称
B. σ 键原子轨道“头碰头”式重叠,
π 键原子轨道“肩并肩”式重叠
C. 2个 p 轨道无法形成 σ 键,只能形成 π 键
D. H 可以形成 σ 键,而 O 可以形成 σ 键和 π 键
C
反馈评价
1s1
2s2 2p4
√
√
×
√
下列说法中,错误的是( )
A. 键能是衡量化学键稳定性的参数之一,
键能越大,化学键越牢固
B. 键长与共价键的稳定性没有关系
C. 键角是两个相邻共价键之间的夹角
D. 共价键是通过原子轨道重叠并共用电子对而形成的,
所以共价键有饱和性
B
反馈评价
√
√
√
×
结合 HCl、HBr 和 HI 的键长键能数据和热分解温度,
考察它们的相关性。
通过这个例子说明分子结构如何影响分子的化学性质。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}键
键长/pm
键能/(kJ·mol-1)
HX 在 1273K 的分解百分数/%
H—Cl
127.4
431.8
0.0014
H—Br
141.4
366
0.5
H—I
160.9
298.7
33
反馈评价
数据证据:HCl 键能大且键长短 HCl 难分解
得出结论: 共价键牢固 HCl 分子稳定
微观结构
宏观性质
人体长时间照射紫外光后皮肤为什么会受伤?
信息1:紫外光具有能量约为 399 kJ/mol
信息2:有关蛋白质分子中重要的化学键键能
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}共价键
C一C
C一N
C一S
键能(kJ/mol)
347
305
259
活学活用
紫外光具有的能量比蛋白质中主要化学键的键能都大,足以使这些化学键断裂从而破坏蛋白质分子。
防晒霜的原理
生活知识
归纳整理:阅读教材并整理笔记
基础夯实:教材 P39 练习与应用第 1-5 题
课堂延伸:用彩泥、竹签等材料制作电子云模型图,并模拟
σ 键和 π 键的形成过程。
课后作业
诚实和勤勉,
应该成为你永久的伴侣。
富兰克林
结语
同 学 们 再 见 !
选择性必修 2 物质结构与性质 第二章 分子结构与性质
共价键
学习目标
1. 能认识原子间通过原子轨道重叠形成共价键,
能说出共价键的分类、特征。
2. 能用模型、符号、图像等正确表征简单分子中原
子轨道的重叠方式。
3. 能理解键参数的含义并用其解释分子的某些性质。
H2O
分子
现代化学键的理论核心
共价键
化学键
相互
作用
物质
原子
H 和 O
请用电子式表示 H2 的形成过程并回忆共价键的含义。
一、共价键
H · + ·H → H : H
基础回顾
1. 共用电子对角度初识共价键
原子之间通过共用电子对形成的相互作用叫共价键。
第一章中电子云与原子轨道相关知识
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}能级
原子轨道数
原子轨道名称
电子云轮廓图
形状
电子云轮廓图
取向
s
1
ns
球形
————
p
3
npx npy npz
哑铃形
相互垂直
基础回顾
H
H
H
H
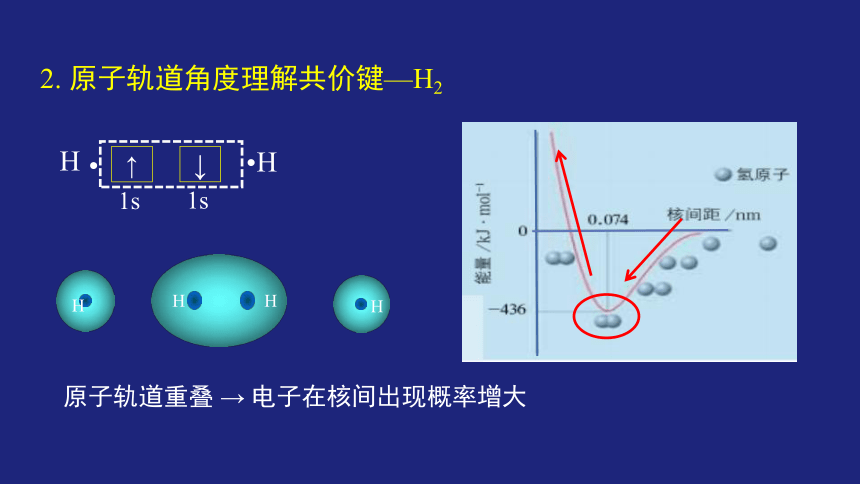
原子轨道重叠 → 电子在核间出现概率增大
2. 原子轨道角度理解共价键—H2
↑
1s
↓
1s
H
?
H
?
↓
1s
Cl
?
?
H
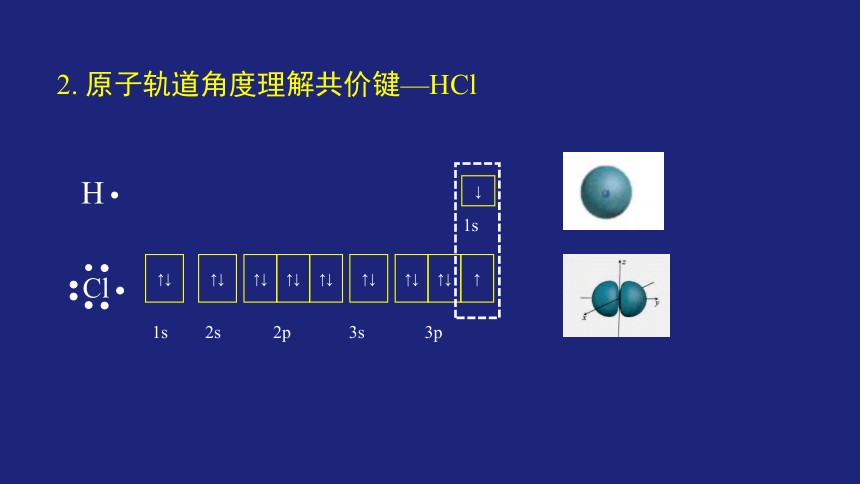
?
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
2. 原子轨道角度理解共价键—HCl
?
?
?
?
?
2. 原子轨道角度理解共价键—HCl
图 1
图 2
可能按照哪种方式靠拢并重叠?
“头碰头”方式
↓
1S
Cl
?
?
?
?
?
H
?
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
原子轨道“头碰头”重叠
形成共价键
2. 原子轨道角度理解共价键—HCl
?
?
1s 相互靠拢 3pz
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↓
1s
2s
2p
3s
3p
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
相互靠拢
原子轨道“头碰头”重叠
形成共价键
2. 原子轨道角度理解共价键—Cl2
轨道不同: s-s s-p p-p
特征相同:均呈轴对称
σ 键
3. 共价键的类型
(1)σ 键
有何异同?
分类: s-s σ 键 s-p σ 键 p-p σ 键
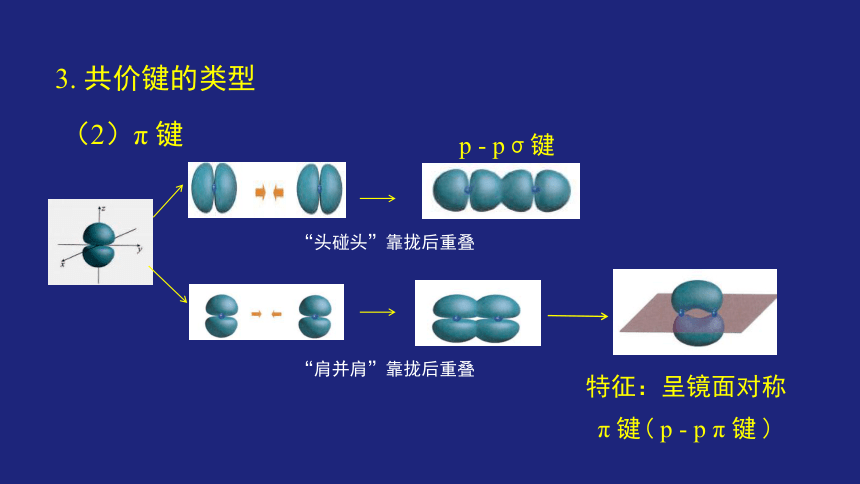
(2)π 键
特征:呈镜面对称
π 键( p - p π 键 )
“头碰头”靠拢后重叠
p - pσ键
“肩并肩”靠拢后重叠
3. 共价键的类型
请尝试画一画 N2(N≡N)原子轨道重叠过程。
↑
↑
↑
↑↓
↑↓
1s
2s
2p
?
?
N
?
?
?
↓
↓
↓
↑↓
↑↓
1s
2s
2p
思考讨论
p-p σ 键
px
思考
请尝试画一画N2(N≡N)原子轨道重叠过程。
p-p π 键
pz
py
p-p π 键
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A} 键型
σ 键
π 键
成键方向
特征
(3)小结
成键判断
及规律
①共价单键是 σ 键;
②共价双键中有一个是 σ 键,另一个是 π键;
③共价三键中有一个是 σ 键,另两个是 π 键。
项目
沿轴方向
“头碰头”
轴对称,可旋转
平行方向
“肩并肩”
镜面对称,不可旋转
观察下列分子结构,它们分子中共价键由几个 σ 键、几个 π 键构成?
7个 σ 键
无 π 键
5个 σ 键
1个 π 键
3 个 σ 键
2 个 π 键
思考
结合乙烷、乙烯和乙炔的化学性质分析 π 键和 σ 键的强度是否相同?
乙烯和乙炔:加成反应 π 键更易断裂
乙烷:取代反应 σ 键相对更稳定
思考
结论:π 键和 σ 键的强度不同
乙烯和乙炔分子中π 键不如 σ 键牢固
(1)饱和性:
原子有几个未成对电子,便可和几个电子配对成键。
(2)方向性(s-s σ 键除外):
原子轨道之间会按照一定的方向进行重叠。
4. 共价键的特征
H3 H2Cl?
5. 共价键形成的条件
钠和氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子
和氯原子共用形成共价键而形成离子键呢?请从元素电负性差别理解 。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}原子
Na Cl
H Cl
C O
电负性
0.9 3.0
2.1 3.0
2.5 3.5
电负性之差
(绝对值)
2.1
0.9
1.0
结论:当原子电负性相差很大时,化学反应形成的电子对不会被
共用,形成的是离子键;电负性相差不大时形成共价键。
1.7
二、键参数—键能、键长、键角
1. 键能:
气态分子中1 mol 化学键解离成气态原子所吸收的能量。
键能通常是 298.15 K、101 kPa 条件下的标准值,其单位为 kJ/mol。
成键 放出能量
断键 吸收能量
热效应
ΔH = 反应物总键能 - 生成物总键能
ΔH > 0 吸热反应
ΔH < 0 放热反应
思考
从计算结果看 HCl 和 HBr 哪个更容易分解呢?
ΔH = 反应物总键能 - 生成物总键能
ΔH (HCl) = [ ( 436 + 242.7 ) - 2×431.8 ] kJ/mol = - 184.9 kJ/mol
ΔH (HBr) = [ ( 436 + 193.7 ) - 2×366 ] kJ/mol = - 102.3 kJ/mol
利用 P37 表 2-1 数据计算,1 mol H2 分别与1 mol Cl2、1mol Br2
反应,分别形成 2 mol HCl 和 2 mol HBr 哪个释放能量多??
HBr 分解需吸收能量少,更易分解。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}键
键能
C-C
347.7
C = C
615
C = C
812
请结合下列数据思考为何碳碳双键的键能不是碳碳单键的二倍,碳碳三键的键能不是碳碳单键的三倍?
碳碳单键:1 个 σ 键
碳碳双键:1 个 σ 键,1个 π 键
碳碳三键:1 个 σ 键,2个 π 键
思考
σ 键与 π 键
强度不同
乙烯分子中
σ 键强于π 键
键能越大,共价键越牢固
键能:衡量共价键强弱的参数
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}键
键能
N-H
390.8
O-H
462.8
H-F
568
请结合教材 P37表 2-1 分析,从键能的角度如何理解
N2、O2、F2 跟 H2 的反应能力依次增强这一化学事实?
共价键:越来越牢固
产物:越来越稳定
结论:与氢气反应能力越来越强
思考
大
小
2. 键长:
构成化学键的两个原子之间的核间距,
其单位为 pm。 (1pm=10-12 m)
成键原子半径之和______键长
大于
二、键参数—键能、键长、键角
结合教材 P37表 2-1和 P38表 2-2
分析键长和键能是否有一定相关性?
思考它们对分子的化学性质有何影响?
思考
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}键
键能
键长
H-F
565.0
92
H-Cl
428.0
128
H-Br
362.0
141
一般情况下,
键长越短,键能越大。
化学键越牢固,
含该共价键的分子越稳定。
键长:衡量共价键强弱的参数
稳
定
性
减
弱
自主探究
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}键
键能
键长
F-F
157
141
Cl-Cl
242.7
198
Br-Br
193.7
228
F—F 键键长最短,键能却最小?
查阅资料,寻找原因。
二、键参数—键能、键长、键角
3. 键角:
在多原子分子中,两个相邻共价键之间的夹角称为键角。
键长和键角的数值测定方法:晶体的 X 射线衍射实验
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子
空间结构模型
键角
CO2
180°
H2O
105°
NH3
107°
CH4
109°28′
多原子分子中的键角一定
键角:描述分子空间结构的参数
图表导学
本课小结
特征
方向性
饱和性
σ 键:轴对称
分
类
π 键:镜面对称
原子间
相互作用
共价键
原子
轨道重叠
本课小结
原子间
相互作用
共价键
键参数
定量
键角
键长
键能
键的
强弱
分子的
稳定性
特征
方向性
饱和性
测定
晶体 X 射线衍射实验
分子空间结构
原子
轨道重叠
σ 键:轴对称
分
类
π 键:镜面对称
下列关于 σ 键和 π 键说法错误的是( )
A. σ 键的电子云图形是轴对称,π 键电子云图形是镜面对称
B. σ 键原子轨道“头碰头”式重叠,
π 键原子轨道“肩并肩”式重叠
C. 2个 p 轨道无法形成 σ 键,只能形成 π 键
D. H 可以形成 σ 键,而 O 可以形成 σ 键和 π 键
C
反馈评价
1s1
2s2 2p4
√
√
×
√
下列说法中,错误的是( )
A. 键能是衡量化学键稳定性的参数之一,
键能越大,化学键越牢固
B. 键长与共价键的稳定性没有关系
C. 键角是两个相邻共价键之间的夹角
D. 共价键是通过原子轨道重叠并共用电子对而形成的,
所以共价键有饱和性
B
反馈评价
√
√
√
×
结合 HCl、HBr 和 HI 的键长键能数据和热分解温度,
考察它们的相关性。
通过这个例子说明分子结构如何影响分子的化学性质。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}键
键长/pm
键能/(kJ·mol-1)
HX 在 1273K 的分解百分数/%
H—Cl
127.4
431.8
0.0014
H—Br
141.4
366
0.5
H—I
160.9
298.7
33
反馈评价
数据证据:HCl 键能大且键长短 HCl 难分解
得出结论: 共价键牢固 HCl 分子稳定
微观结构
宏观性质
人体长时间照射紫外光后皮肤为什么会受伤?
信息1:紫外光具有能量约为 399 kJ/mol
信息2:有关蛋白质分子中重要的化学键键能
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}共价键
C一C
C一N
C一S
键能(kJ/mol)
347
305
259
活学活用
紫外光具有的能量比蛋白质中主要化学键的键能都大,足以使这些化学键断裂从而破坏蛋白质分子。
防晒霜的原理
生活知识
归纳整理:阅读教材并整理笔记
基础夯实:教材 P39 练习与应用第 1-5 题
课堂延伸:用彩泥、竹签等材料制作电子云模型图,并模拟
σ 键和 π 键的形成过程。
课后作业
诚实和勤勉,
应该成为你永久的伴侣。
富兰克林
结语
同 学 们 再 见 !
