高中化学人教版(2019)选择性必修二第二章第二节分子的空间结构 课件(共40张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修二第二章第二节分子的空间结构 课件(共40张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-09 00:00:00 | ||
图片预览




文档简介
高二年级 化学
选择性必修2 物质结构与性质 第二章 分子结构与性质
分子的空间结构
学习目标
1. 能列举测定分子空间结构的实验方法,知道分子空
间结构的多样性存在。
2. 能利用价层电子对互斥理论预测简单分子或离子
的空间结构。
3. 能用杂化轨道理论解释简单共价分子的空间结构。
异彩纷呈的分子世界
化学性质推测
一、分子结构的测定
现代仪器和方法
红外光谱
晶体X射线衍射实验
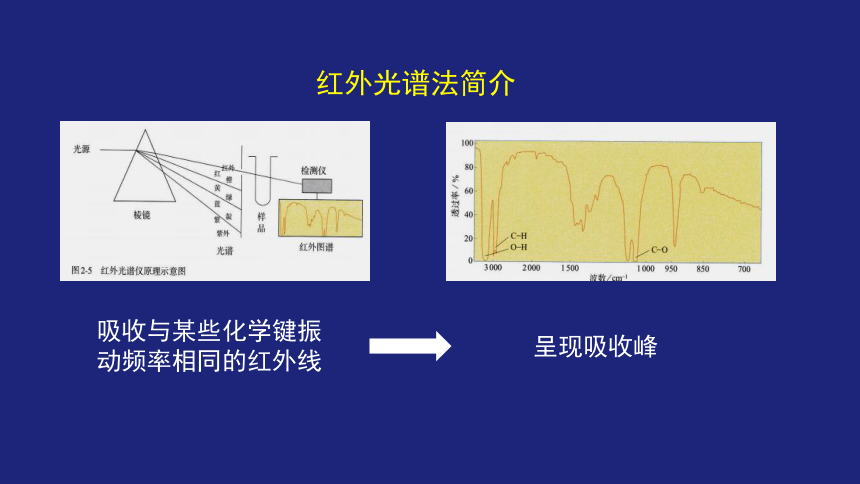
红外光谱法简介
吸收与某些化学键振动频率相同的红外线
呈现吸收峰
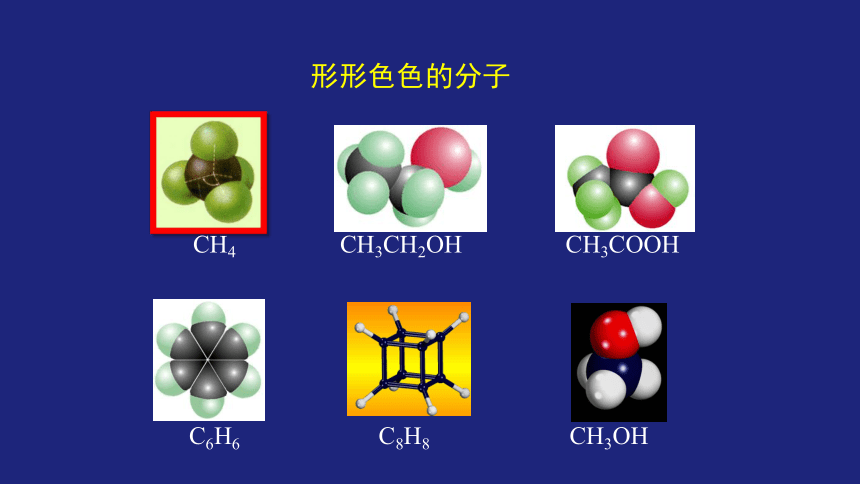
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
形形色色的分子
CH4
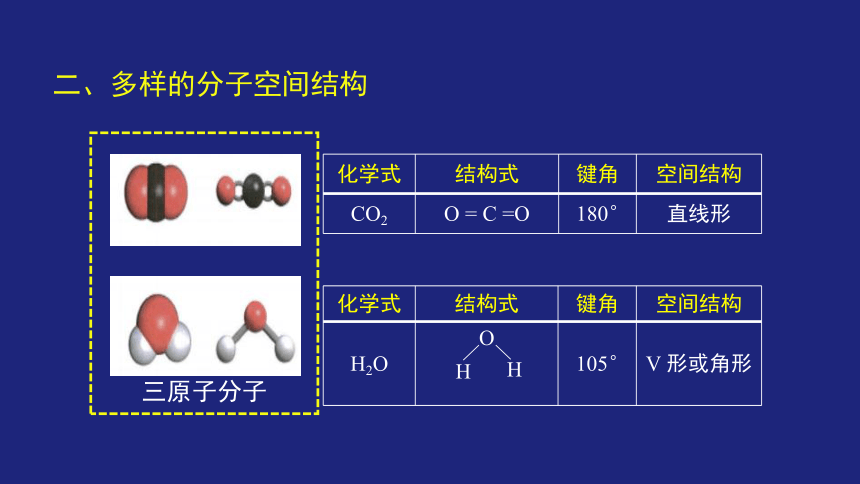
二、多样的分子空间结构
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}化学式
结构式
键角
空间结构
CO2
O = C =O
180°
直线形
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}化学式
结构式
键角
空间结构
H2O
O
105°
V 形或角形
三原子分子
H
H
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}化学式
结构式
键角
空间结构
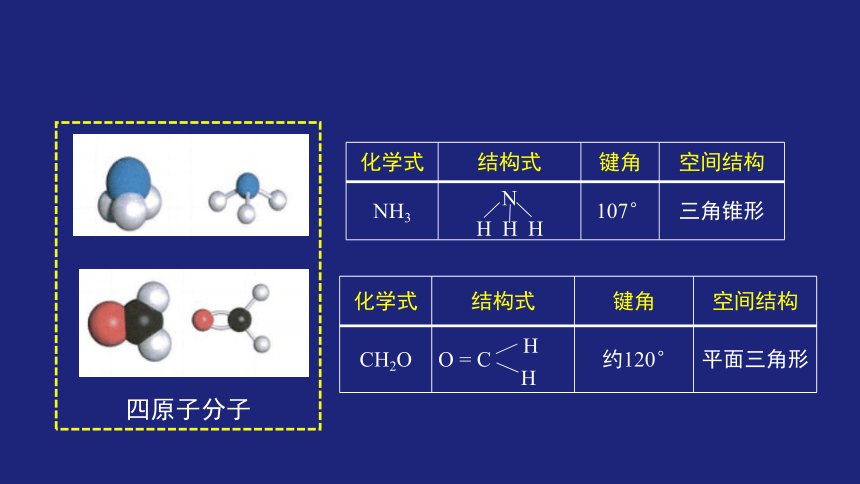
CH2O
O = C
约120°
平面三角形
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}化学式
结构式
键角
空间结构
NH3
N
107°
三角锥形
四原子分子
H
H
H
H
H
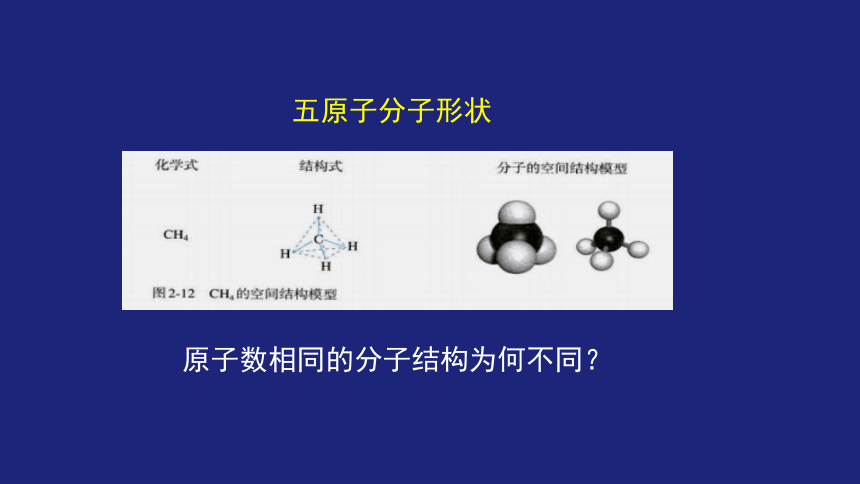
五原子分子形状
原子数相同的分子结构为何不同?
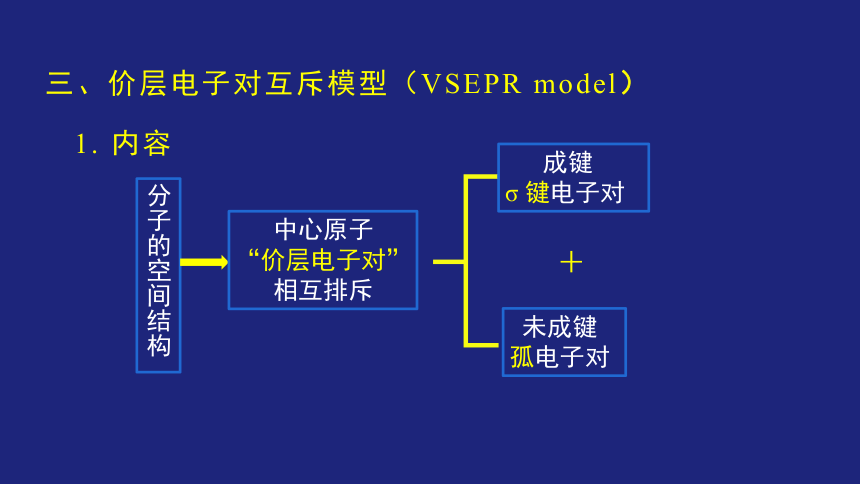
三、价层电子对互斥模型(VSEPR model)
成键
σ 键电子对
未成键
孤电子对
+
1. 内容
分子的空间结构
中心原子
“价层电子对”
相互排斥
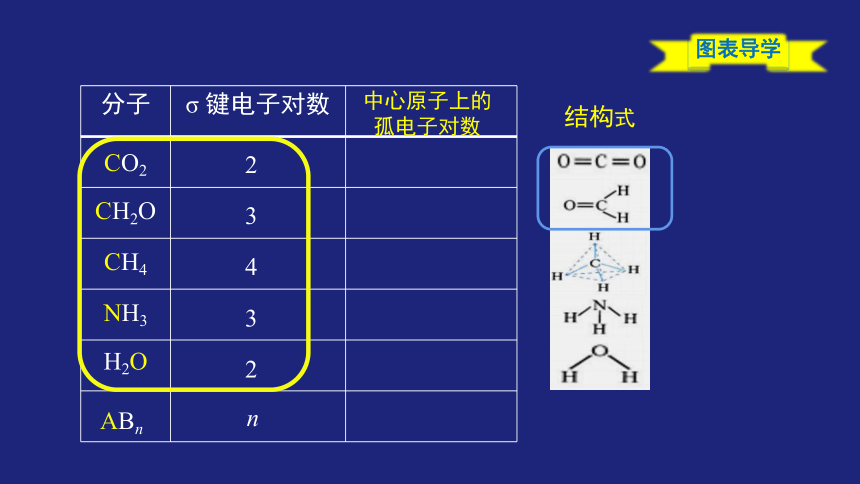
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子
σ 键电子对数
CO2
CH2O
CH4
NH3
H2O
2
3
4
3
2
图表导学
ABn
n
结构式
中心原子上的
孤电子对数
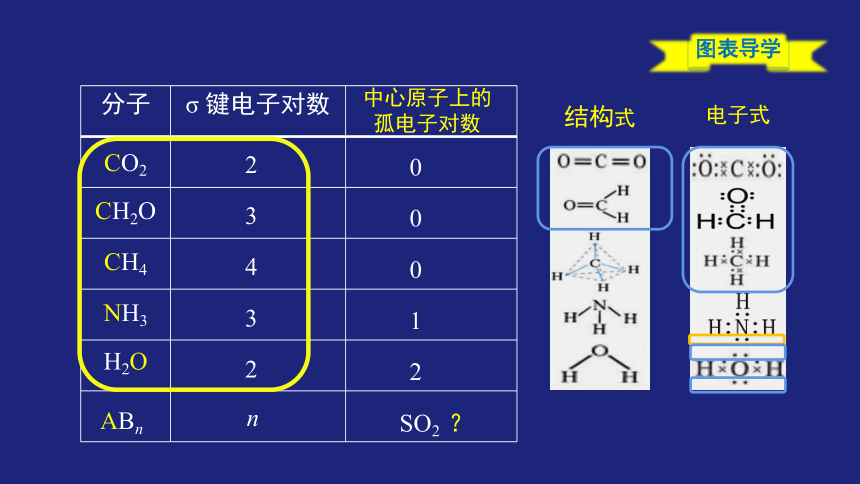
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子
σ 键电子对数
CO2
CH2O
CH4
NH3
H2O
2
3
4
3
2
ABn
图表导学
n
结构式
电子式
0
0
0
1
2
SO2 ?
中心原子上的
孤电子对数
2. 中心原子上的孤电子对的计算
a:中心原子的价电子数(主族序数、最外层电子数)
x:中心原子结合的原子数(ABn中的n值)
b:与中心原子结合的原子最多接受的电子数
( H 为 1,其他原子为“8 - 该原子的最外层电子数”)
中心原子上的
孤电子对数
=
1
2
(a-xb)
a:中心原子的价电子数(主族序数、最外层电子数)
x:中心原子结合的原子数(ABn中的n值)
b:与中心原子结合的原子最多接受的电子数
( H 为 1,其他原子为“8 - 该原子的最外层电子数”)
例:H2O 中心原子 O 上孤电子对数 = 2
CH2O 中心原子 C 上孤电子对数 = 0
12 ( 4 – 2×1 – 1×2 )=0
?
12 ( 6 – 2 × 1 )=2
?
2. 中心原子上的孤电子对的计算
中心原子上的
孤电子对数
=
1
2
(a-xb)
运用公式计算下列分子或离子的中心原子上的孤电子对数
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
分子
a
x
b
孤电子对数
BF3
SO2
SO3
NH4+
SO42-
阳离子:中心原子的价电子数
a “-” 离子的电荷数
阴离子:中心原子的价电子数
“+”离子的电荷数
3 3 1 0
6 2 2 1
6 3 2 0
5-1 = 4
6+2 = 8
4 1 0
4 2 0
反馈评价
中心原子上的孤电子对数
=
1
2
(a-xb)
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子
σ 键
电子对数
CO2
2
0
BF3
3
0
SO2
2
1
CH4
4
0
NH3
3
1
H2O
2
2
2
3
3
4
4
4
图表导学
价层电子对
相互排斥
采用排斥力
最小几何构型
VSEPR 模型
中心原子上的价层
电子对数
中心原子上的
孤电子对数
中心原子上的
价层电子对数
气球空间互斥模拟价层电子对互斥(VSEPR模型)
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
2
3
4
VSEPR 模型
角度
3.VSEPR 模型
直线形
180°
平面三角形
120°
正四面体形
109°28′
分子实际空间结构和 VSEPR 模型完全一致么?
中心原子上的
价层电子对数
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子
σ 键
电子对数
VSEPR
模型
分子
空间结构
CO2
2
0
2
直线
BF3
3
0
3
平面三角形
SO2
2
1
3
CH4
4
0
4
正四面体形
NH3
3
1
4
H2O
2
2
4
直线形
平面三角形
V 形
正四面体形
三角锥形
V 形
图表导学
中心原子上的
孤电子对数
中心原子上的
价层电子对数
VSEPR 模型与空间结构
略去孤电子对
H2O:105°
NH3:107°
思考讨论
预测键角
109°28′
实测键角
原因分析:孤电子对斥力较大,实测键角略小。
方法模型
分子的空间结构
中心原子
“价层电子对”
相互排斥
成键
σ 键电子对
未成键
孤电子对
VSEPR 模型
预测
ABn
n
+
II
中心原子上的
价层电子对数
反馈评价
请用上述模型预测下列分子或离子的空间结构
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}粒子
σ 键
电子对数
VSEPR
模型
空间结构
SO2
H3O+
SO42-
HCN
CH4
2
3
4
2
4
1
1
0
0
0
( 4 -1- 3 )
= 0
中心原子
上的孤电
子对数
中心原子
上的价层
电子对数
反馈评价
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}粒子
σ 键
电子对数
VSEPR
模型
空间结构
SO2
H3O+
SO42-
HCN
CH4
2
3
4
2
4
1
1
0
0
0
( 4 -1- 3 )
= 0
3 平面三角形
4 正四面体形
4 正四面体形
2 直线形
4 正四面体形
正四面体形
直线形
正四面体形
V 形
三角锥形
请用上述模型预测下列分子或离子的空间结构
中心原子
上的孤电
子对数
中心原子
上的价层
电子对数
↑
↑
↑↓
2s
2p
C
分子式
不是 CH2?
成键原理
↑
↑
↑
↑
2s
2p
C
激发
四个共价键完全相同么?
与 H 原子
轨道重叠
鲍林
杂化轨道理论
甲烷:正四面体结构
x
y
z
x
y
z
x
y
z
x
y
z
109°28′
杂化轨道理论解释甲烷空间结构
↑
↑
↑↓
2s
2p
C 原子基态
↑
↑
↑
↑
2s
2p
激发
杂化
↑
↑
↑
↑
sp3杂化轨道
↑
↑
↑
↑
sp3杂化轨道
与 H 原子轨道重叠
甲烷:正四面体结构
杂化轨道理论解释甲烷空间结构
1. 杂化过程
四、杂化轨道理论简介
原子轨
道杂化
同一原子内部能量相近的原子轨发生混杂
重组成与原轨道数目____的新轨道的过程。
杂化
轨道
形成
特点:能量_____方向______。
相等
相同
不同
—解释分子空间结构
已知 H2O 的中心原子为 sp3 杂化,
试讨论杂化过程,并由此解释其空间结构为 V 形。
思考讨论
↑↓
↑
↑
↑↓
2s
2p
O
↑↓
↑
↑
↑↓
sp3杂化轨道
杂化
与 H 原子
轨道重叠
sp 杂化
sp2 杂化
2. 杂化轨道的类型
未杂化 p 轨道:
形成 π 键
杂化轨道:
形成 σ 键或
容纳孤电子对
杂化类型
sp
sp2
sp3
参加杂化的
原子轨道
杂化轨道数
轨道空间结构
夹角
1 个 ns
1 个 np
1 个 ns
2 个 np
1 个 ns
3 个 np
2
3
4
直线形
平面三角形
正四面体形
180°
120°
109°28′
2. 杂化轨道的类型
图表导学
3. 杂化轨道的判断
中心原子上的价层电子对数→杂化轨道数目→杂化轨道类型
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}粒子
VSEPR
模型
空间结构
杂化
轨道
SO2
H3O+
SO42-
HCN
CH4
练习反馈
3 平面三角形
4 正四面体形
4 正四面体形
2 直线形
4 正四面体形
V 形
三角锥形
正四面体形
直线形
正四面体形
sp3 杂化
sp3 杂化
sp 杂化
sp3 杂化
sp2 杂化
中心原子上的价层电子对数
VSEPR 模型
预测
分子
空间结构
课堂小结
中心原子上的价层电子对数
成键
σ 键电子对
未成键
孤电子对
= 0 时 VSEPR 模型 空间结构
>0 时 VSEPR 模型 空间结构
略去
中心原子上的
孤电子对
VSEPR 模型
预测
分子
空间结构
课堂小结
中心原子上的价层电子对数
成键
σ 键电子对
未成键
孤电子对
= 0 时 VSEPR 模型 空间结构
>0 时 VSEPR 模型 空间结构
略去
中心原子上的
孤电子对
杂化轨道理论
解释
现代仪器检测
检测反馈
乙炔的结构式如下,请判断碳原子采取什么杂化方式?
它的杂化轨道用于形成什么化学键?怎样理解它存在三键?
σ 键电子数 = 2
孤电子对数 = 0
价层电子对 = 2
故为 sp 杂化
H—C三C—H
检测反馈
H—C三C—H
σ 键电子数 = 2
孤电子对数 = 0
价层电子对 = 2
故为 sp 杂化
σ
σ
σ
乙炔的结构式如下,请判断碳原子采取什么杂化方式?
它的杂化轨道用于形成什么化学键?怎样理解它存在三键?
课后作业
归纳整理:阅读教材并整理笔记
基础夯实:教材 P50 练习与应用第1 - 8 题
课堂延伸:利用杂化轨道理论相关知识,解释乙烯分子的空间结构。
查阅资料了解质谱仪和晶体 X 射线衍射实验的原理应用。
结语
想出一个好点子最好的办法,就是想出很多的点子。
莱纳斯·鲍林
同 学 们 再 见 !
选择性必修2 物质结构与性质 第二章 分子结构与性质
分子的空间结构
学习目标
1. 能列举测定分子空间结构的实验方法,知道分子空
间结构的多样性存在。
2. 能利用价层电子对互斥理论预测简单分子或离子
的空间结构。
3. 能用杂化轨道理论解释简单共价分子的空间结构。
异彩纷呈的分子世界
化学性质推测
一、分子结构的测定
现代仪器和方法
红外光谱
晶体X射线衍射实验
红外光谱法简介
吸收与某些化学键振动频率相同的红外线
呈现吸收峰
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
形形色色的分子
CH4
二、多样的分子空间结构
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}化学式
结构式
键角
空间结构
CO2
O = C =O
180°
直线形
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}化学式
结构式
键角
空间结构
H2O
O
105°
V 形或角形
三原子分子
H
H
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}化学式
结构式
键角
空间结构
CH2O
O = C
约120°
平面三角形
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}化学式
结构式
键角
空间结构
NH3
N
107°
三角锥形
四原子分子
H
H
H
H
H
五原子分子形状
原子数相同的分子结构为何不同?
三、价层电子对互斥模型(VSEPR model)
成键
σ 键电子对
未成键
孤电子对
+
1. 内容
分子的空间结构
中心原子
“价层电子对”
相互排斥
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子
σ 键电子对数
CO2
CH2O
CH4
NH3
H2O
2
3
4
3
2
图表导学
ABn
n
结构式
中心原子上的
孤电子对数
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子
σ 键电子对数
CO2
CH2O
CH4
NH3
H2O
2
3
4
3
2
ABn
图表导学
n
结构式
电子式
0
0
0
1
2
SO2 ?
中心原子上的
孤电子对数
2. 中心原子上的孤电子对的计算
a:中心原子的价电子数(主族序数、最外层电子数)
x:中心原子结合的原子数(ABn中的n值)
b:与中心原子结合的原子最多接受的电子数
( H 为 1,其他原子为“8 - 该原子的最外层电子数”)
中心原子上的
孤电子对数
=
1
2
(a-xb)
a:中心原子的价电子数(主族序数、最外层电子数)
x:中心原子结合的原子数(ABn中的n值)
b:与中心原子结合的原子最多接受的电子数
( H 为 1,其他原子为“8 - 该原子的最外层电子数”)
例:H2O 中心原子 O 上孤电子对数 = 2
CH2O 中心原子 C 上孤电子对数 = 0
12 ( 4 – 2×1 – 1×2 )=0
?
12 ( 6 – 2 × 1 )=2
?
2. 中心原子上的孤电子对的计算
中心原子上的
孤电子对数
=
1
2
(a-xb)
运用公式计算下列分子或离子的中心原子上的孤电子对数
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
分子
a
x
b
孤电子对数
BF3
SO2
SO3
NH4+
SO42-
阳离子:中心原子的价电子数
a “-” 离子的电荷数
阴离子:中心原子的价电子数
“+”离子的电荷数
3 3 1 0
6 2 2 1
6 3 2 0
5-1 = 4
6+2 = 8
4 1 0
4 2 0
反馈评价
中心原子上的孤电子对数
=
1
2
(a-xb)
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子
σ 键
电子对数
CO2
2
0
BF3
3
0
SO2
2
1
CH4
4
0
NH3
3
1
H2O
2
2
2
3
3
4
4
4
图表导学
价层电子对
相互排斥
采用排斥力
最小几何构型
VSEPR 模型
中心原子上的价层
电子对数
中心原子上的
孤电子对数
中心原子上的
价层电子对数
气球空间互斥模拟价层电子对互斥(VSEPR模型)
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
2
3
4
VSEPR 模型
角度
3.VSEPR 模型
直线形
180°
平面三角形
120°
正四面体形
109°28′
分子实际空间结构和 VSEPR 模型完全一致么?
中心原子上的
价层电子对数
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子
σ 键
电子对数
VSEPR
模型
分子
空间结构
CO2
2
0
2
直线
BF3
3
0
3
平面三角形
SO2
2
1
3
CH4
4
0
4
正四面体形
NH3
3
1
4
H2O
2
2
4
直线形
平面三角形
V 形
正四面体形
三角锥形
V 形
图表导学
中心原子上的
孤电子对数
中心原子上的
价层电子对数
VSEPR 模型与空间结构
略去孤电子对
H2O:105°
NH3:107°
思考讨论
预测键角
109°28′
实测键角
原因分析:孤电子对斥力较大,实测键角略小。
方法模型
分子的空间结构
中心原子
“价层电子对”
相互排斥
成键
σ 键电子对
未成键
孤电子对
VSEPR 模型
预测
ABn
n
+
II
中心原子上的
价层电子对数
反馈评价
请用上述模型预测下列分子或离子的空间结构
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}粒子
σ 键
电子对数
VSEPR
模型
空间结构
SO2
H3O+
SO42-
HCN
CH4
2
3
4
2
4
1
1
0
0
0
( 4 -1- 3 )
= 0
中心原子
上的孤电
子对数
中心原子
上的价层
电子对数
反馈评价
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}粒子
σ 键
电子对数
VSEPR
模型
空间结构
SO2
H3O+
SO42-
HCN
CH4
2
3
4
2
4
1
1
0
0
0
( 4 -1- 3 )
= 0
3 平面三角形
4 正四面体形
4 正四面体形
2 直线形
4 正四面体形
正四面体形
直线形
正四面体形
V 形
三角锥形
请用上述模型预测下列分子或离子的空间结构
中心原子
上的孤电
子对数
中心原子
上的价层
电子对数
↑
↑
↑↓
2s
2p
C
分子式
不是 CH2?
成键原理
↑
↑
↑
↑
2s
2p
C
激发
四个共价键完全相同么?
与 H 原子
轨道重叠
鲍林
杂化轨道理论
甲烷:正四面体结构
x
y
z
x
y
z
x
y
z
x
y
z
109°28′
杂化轨道理论解释甲烷空间结构
↑
↑
↑↓
2s
2p
C 原子基态
↑
↑
↑
↑
2s
2p
激发
杂化
↑
↑
↑
↑
sp3杂化轨道
↑
↑
↑
↑
sp3杂化轨道
与 H 原子轨道重叠
甲烷:正四面体结构
杂化轨道理论解释甲烷空间结构
1. 杂化过程
四、杂化轨道理论简介
原子轨
道杂化
同一原子内部能量相近的原子轨发生混杂
重组成与原轨道数目____的新轨道的过程。
杂化
轨道
形成
特点:能量_____方向______。
相等
相同
不同
—解释分子空间结构
已知 H2O 的中心原子为 sp3 杂化,
试讨论杂化过程,并由此解释其空间结构为 V 形。
思考讨论
↑↓
↑
↑
↑↓
2s
2p
O
↑↓
↑
↑
↑↓
sp3杂化轨道
杂化
与 H 原子
轨道重叠
sp 杂化
sp2 杂化
2. 杂化轨道的类型
未杂化 p 轨道:
形成 π 键
杂化轨道:
形成 σ 键或
容纳孤电子对
杂化类型
sp
sp2
sp3
参加杂化的
原子轨道
杂化轨道数
轨道空间结构
夹角
1 个 ns
1 个 np
1 个 ns
2 个 np
1 个 ns
3 个 np
2
3
4
直线形
平面三角形
正四面体形
180°
120°
109°28′
2. 杂化轨道的类型
图表导学
3. 杂化轨道的判断
中心原子上的价层电子对数→杂化轨道数目→杂化轨道类型
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}粒子
VSEPR
模型
空间结构
杂化
轨道
SO2
H3O+
SO42-
HCN
CH4
练习反馈
3 平面三角形
4 正四面体形
4 正四面体形
2 直线形
4 正四面体形
V 形
三角锥形
正四面体形
直线形
正四面体形
sp3 杂化
sp3 杂化
sp 杂化
sp3 杂化
sp2 杂化
中心原子上的价层电子对数
VSEPR 模型
预测
分子
空间结构
课堂小结
中心原子上的价层电子对数
成键
σ 键电子对
未成键
孤电子对
= 0 时 VSEPR 模型 空间结构
>0 时 VSEPR 模型 空间结构
略去
中心原子上的
孤电子对
VSEPR 模型
预测
分子
空间结构
课堂小结
中心原子上的价层电子对数
成键
σ 键电子对
未成键
孤电子对
= 0 时 VSEPR 模型 空间结构
>0 时 VSEPR 模型 空间结构
略去
中心原子上的
孤电子对
杂化轨道理论
解释
现代仪器检测
检测反馈
乙炔的结构式如下,请判断碳原子采取什么杂化方式?
它的杂化轨道用于形成什么化学键?怎样理解它存在三键?
σ 键电子数 = 2
孤电子对数 = 0
价层电子对 = 2
故为 sp 杂化
H—C三C—H
检测反馈
H—C三C—H
σ 键电子数 = 2
孤电子对数 = 0
价层电子对 = 2
故为 sp 杂化
σ
σ
σ
乙炔的结构式如下,请判断碳原子采取什么杂化方式?
它的杂化轨道用于形成什么化学键?怎样理解它存在三键?
课后作业
归纳整理:阅读教材并整理笔记
基础夯实:教材 P50 练习与应用第1 - 8 题
课堂延伸:利用杂化轨道理论相关知识,解释乙烯分子的空间结构。
查阅资料了解质谱仪和晶体 X 射线衍射实验的原理应用。
结语
想出一个好点子最好的办法,就是想出很多的点子。
莱纳斯·鲍林
同 学 们 再 见 !
