【新教材】人教版(2019)高中化学选择性必修22.2 杂化轨道理论 课件 (共36张ppt)
文档属性
| 名称 | 【新教材】人教版(2019)高中化学选择性必修22.2 杂化轨道理论 课件 (共36张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-09 00:00:00 | ||
图片预览


文档简介
第二章 分子结构与性质
第二节 分子的空间结构
第三课时 杂化轨道理论简介
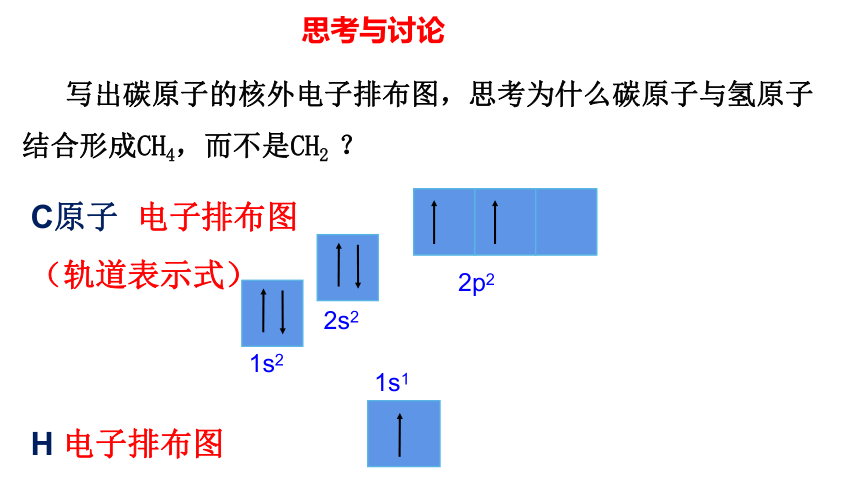
写出碳原子的核外电子排布图,思考为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
C原子 电子排布图
(轨道表示式)
1s2
2s2
2p2
H 电子排布图
1s1
思考与讨论
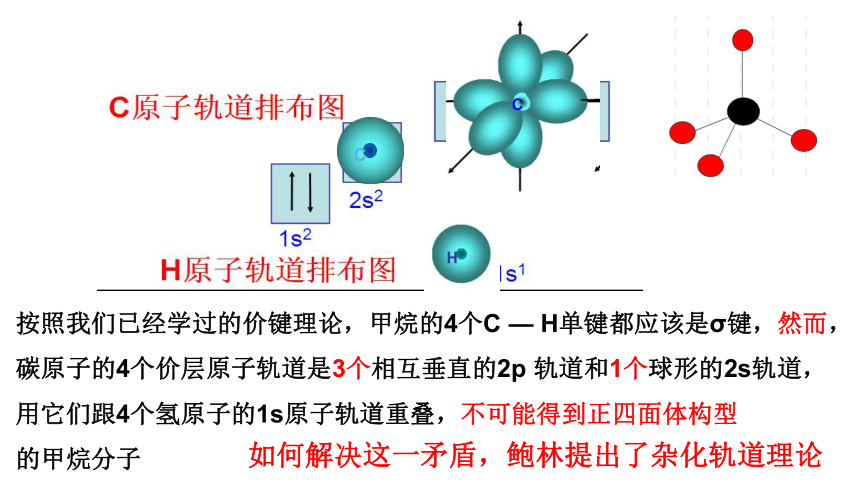
按照我们已经学过的价键理论,甲烷的4个C — H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p 轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到正四面体构型
的甲烷分子
C
C
如何解决这一矛盾,鲍林提出了杂化轨道理论
sp3
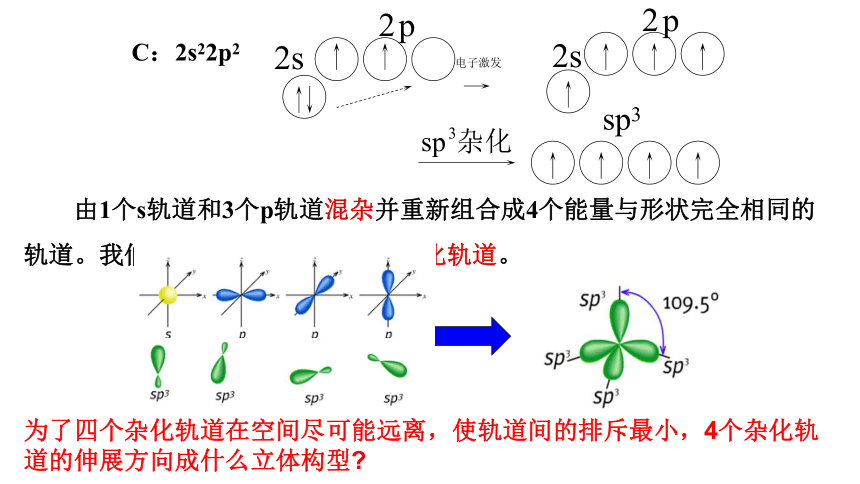
C:2s22p2
由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状完全相同的轨道。我们把这种轨道称之为 sp3杂化轨道。
为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的伸展方向成什么立体构型?
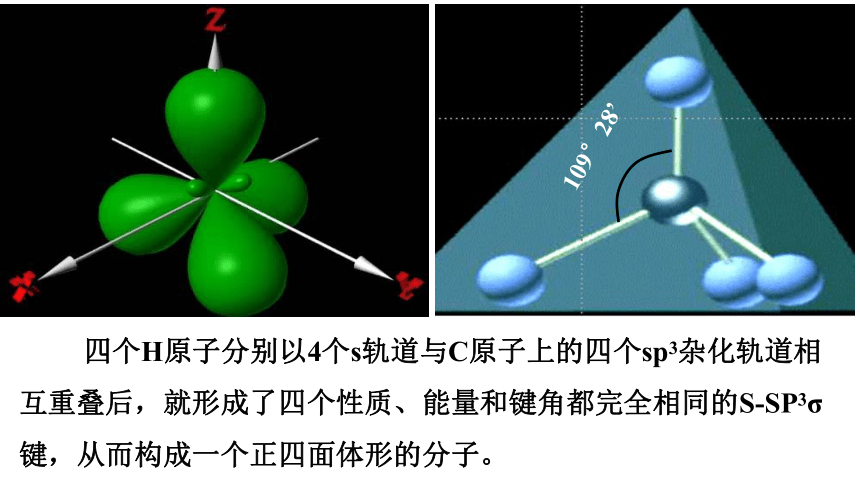
四个H原子分别以4个s轨道与C原子上的四个sp3杂化轨道相互重叠后,就形成了四个性质、能量和键角都完全相同的S-SP3σ键,从而构成一个正四面体形的分子。
109°28’
四、杂化理论简介
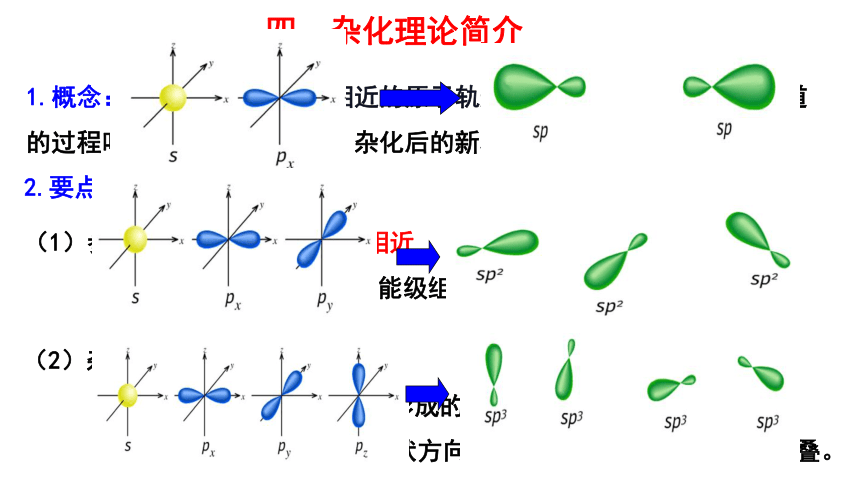
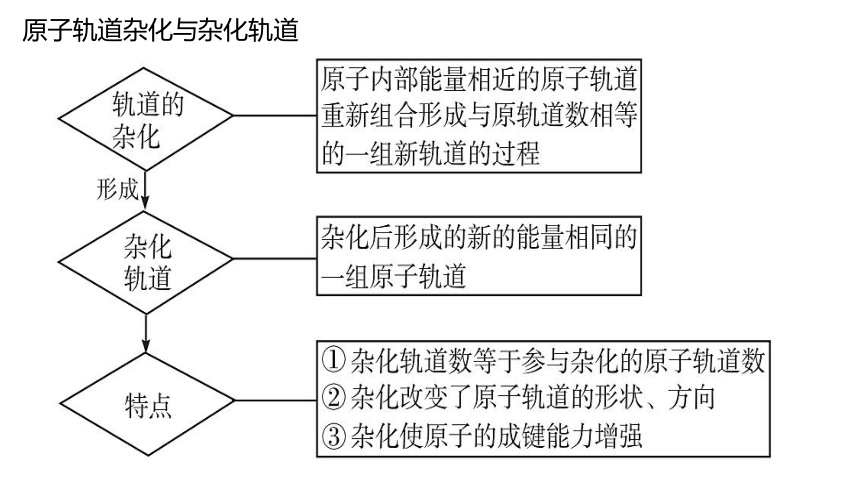
1.概念:外界条件下,能量相近的原子轨道混杂起来,重新组合新轨道的过程叫做原子轨道的杂化,杂化后的新轨道就称为杂化轨道。
2.要点:
(1)参与杂化的原子轨道能量相近
(同一能级组或相近能级组的轨道)
(2)杂化前后原子轨道数目不变:
参加杂化的轨道数目等于形成的杂化轨道数目;
杂化改变了原子轨道的形状方向,成键时更有利于轨道间的重叠。
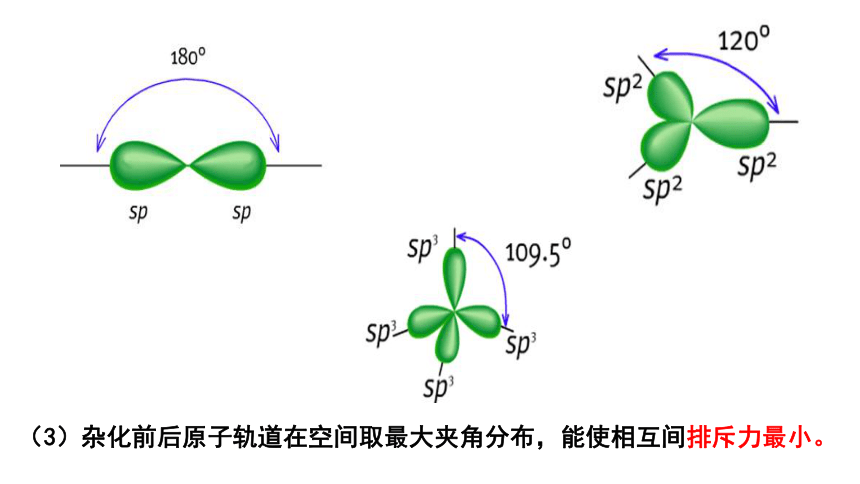
(3)杂化前后原子轨道在空间取最大夹角分布,能使相互间排斥力最小。
3.杂化的条件:
(1).只有在形成化学键时才能杂化
(2).只有能量相近的轨道间才能杂化
4.杂化轨道的特征
(1)杂化前后轨道数不变
(2)杂化过程中轨道的形状发生变化
(3)杂化后形成的化学键更稳定
(4)杂化后的新轨道能量、形状都相同
(5)杂化后的轨道之间尽可能远离。
(6)杂化轨道只用于形成σ键和容纳孤电子对
原子轨道杂化与杂化轨道
对杂化过程的理解
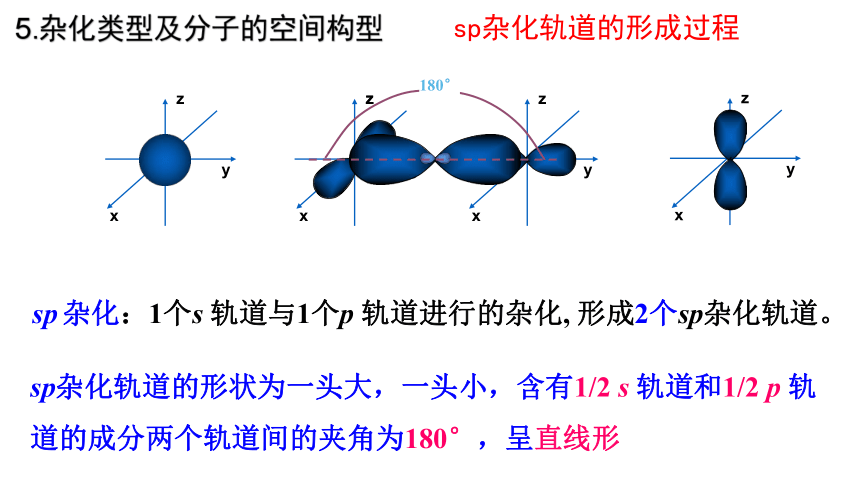
sp杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分两个轨道间的夹角为180°,呈直线形
sp 杂化:1个s 轨道与1个p 轨道进行的杂化, 形成2个sp杂化轨道。
5.杂化类型及分子的空间构型
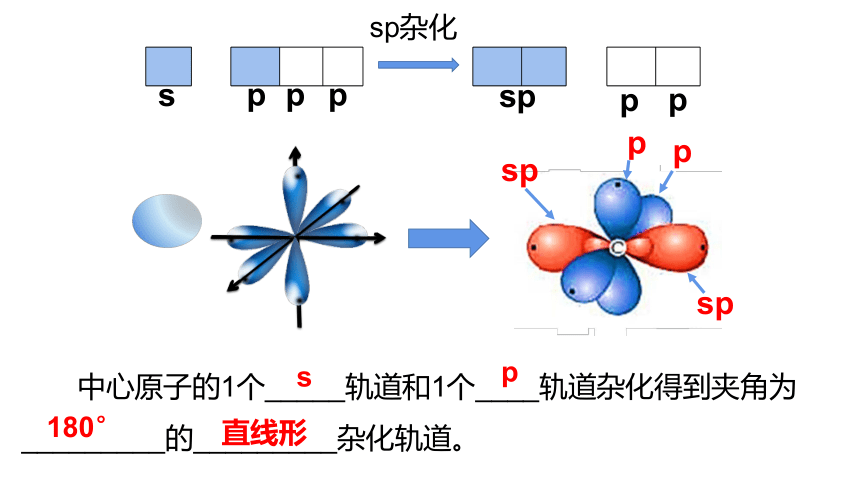
sp杂化
中心原子的1个_____轨道和1个____轨道杂化得到夹角为_________的_________杂化轨道。
{5940675A-B579-460E-94D1-54222C63F5DA}
{5940675A-B579-460E-94D1-54222C63F5DA}
s
p
p
p
{5940675A-B579-460E-94D1-54222C63F5DA}
{5940675A-B579-460E-94D1-54222C63F5DA}
sp
p
p
sp
sp
p
p
s
p
180°
直线形
180°
Cl
Cl
Be
例如: Sp 杂化 —— BeCl2分子的形成
Be原子:1s22s2 没有单个电子,
sp
sp杂化
Cl
Cl
sp
px
px
练习1:分析C2H2的杂化方式
C
{5940675A-B579-460E-94D1-54222C63F5DA}
2p2
{5940675A-B579-460E-94D1-54222C63F5DA}
2s2
基态原子:
H
{5940675A-B579-460E-94D1-54222C63F5DA}
1s1
激发态原子:
C
{5940675A-B579-460E-94D1-54222C63F5DA}
2p3
{5940675A-B579-460E-94D1-54222C63F5DA}
2s1
杂化后:
sp2杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分每两个轨道间的夹角为120°,呈平面三角形
sp2杂化:1个s 轨道与2个p 轨道进行的杂化, 形成3个sp2 杂化轨道。
SP2杂化
中心原子的1个_____轨道和2个____轨道杂化得到夹角为_________的_________杂化轨道。
s
p
120°
平面三角形
{5940675A-B579-460E-94D1-54222C63F5DA}
{5940675A-B579-460E-94D1-54222C63F5DA}
s
p
p
p
{5940675A-B579-460E-94D1-54222C63F5DA}
{5940675A-B579-460E-94D1-54222C63F5DA}
sp2
p
点拨:sp、sp2两种杂化形式中还有未参与杂化的p轨道,可用于形成π键,而杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子对。
120°
F
F
F
B
例如: Sp2 杂化 —— BF3分子的形成
B: 1s22s22p1 没有3个单电子
sp2
sp2杂化
练习2:分析C2H4的杂化方式
C
{5940675A-B579-460E-94D1-54222C63F5DA}
{5940675A-B579-460E-94D1-54222C63F5DA}
2s2
基态原子:
H
{5940675A-B579-460E-94D1-54222C63F5DA}
1s1
激发态原子:
C
{5940675A-B579-460E-94D1-54222C63F5DA}
2p3
{5940675A-B579-460E-94D1-54222C63F5DA}
2s1
杂化后:
H
H
H
H
2p2
练习3:请结合价键理论分析BH3的分子结构
B
H
{5940675A-B579-460E-94D1-54222C63F5DA}
2p1
{5940675A-B579-460E-94D1-54222C63F5DA}
2s2
{5940675A-B579-460E-94D1-54222C63F5DA}
1s1
基态原子:
激发态原子:
B
{5940675A-B579-460E-94D1-54222C63F5DA}
2p2
{5940675A-B579-460E-94D1-54222C63F5DA}
2s1
杂化后:
H
H
H
sp3杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
sp3杂化:1个s 轨道与3个p 轨道进行的杂化,形成4个sp3 杂化轨道。
每个sp3杂化轨道的形状也为一头大,一头小, 含有 1/4 s 轨道和 3/4 p 轨道的成分每两个轨道间的夹角为109.5°,空间构型为正四面体形
中心原子的1个_____轨道和3个____轨道杂化得到夹角为_________的_________杂化轨道。
sp3杂化
s
p
109°28″
正四面体形
{5940675A-B579-460E-94D1-54222C63F5DA}
{5940675A-B579-460E-94D1-54222C63F5DA}
s
p
p
p
{5940675A-B579-460E-94D1-54222C63F5DA}
sp3
例如: Sp3 杂化 —— CH4分子的形成
sp3
C:2s22p2
杂化轨道类型及分子的空间结构
杂化类型
sp
sp2
sp3
参与杂化的原
子轨道及数目
1个s轨道和
1个p轨道
1个s轨道和
2个p轨道
1个s轨道和
3个p轨道
杂化轨道的数目
2
3
4
杂化轨道间的夹角
180°
120°
109°28'
空间结构名称
直线形
平面三角形
正四面体形
实例
CO2、C2H2
BF3、CH2O
CH4、CCl4
在形成多原子分子时,中心原子价电子层上的某些能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程,叫做轨道的杂化(双原子分子中,不存在杂化过程)。例如sp杂化、sp2杂化的过程如下:
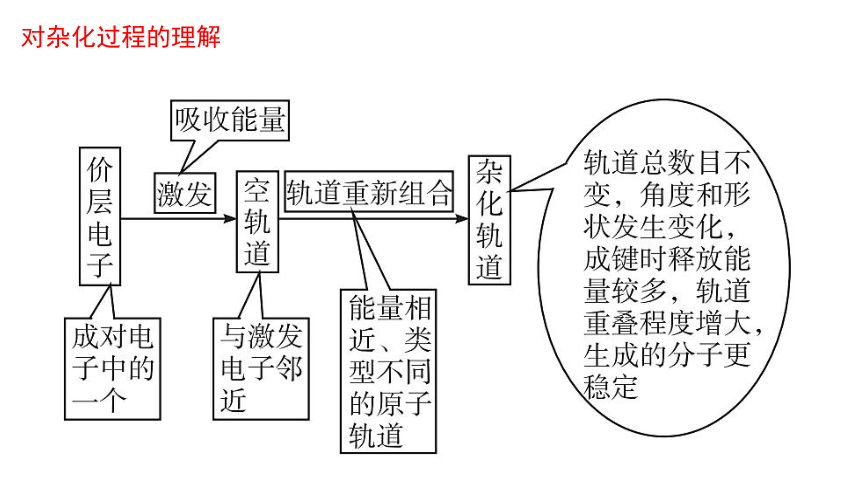
(1)观察上述杂化过程,分析原子轨道杂化后,数量和能量有什么变化?
提示:杂化轨道与参与杂化的原子轨道数目相同,但能量不同。s轨道与p轨道的能量不同,杂化后,形成的一组杂化轨道的能量相同。
思考与讨论
(2)2s轨道与3p轨道能否形成sp2杂化轨道?
提示:不能。只有能量相近的原子轨道才能形成杂化轨道。2s轨道与3p轨道不在同一能层,能量相差较大。
(3)用杂化轨道理论解释NH3、H2O的空间结构。
提示:N原子的价电子排布式为2s22p3,在形成NH3分子的过程中,N原子的1个2s轨道和3个2p轨道经杂化后形成4个sp3杂化轨道,其中3个杂化轨道中各有1个未成对电子,分别与H原子的1s轨道形成共价键,另1个杂化轨道中是成对电子,未与H原子形成共价键,4个sp3杂化轨道在空间构成正四面体形;NH3分子中,由于N原子上的孤电子对的排斥作用,使3个N—H键的键角变小,成为三角锥形的空间结构。
O原子的价电子排布式为2s22p4,在形成H2O分子的过程中,O原子的1个2s轨道和3个2p轨道经杂化后形成4个sp3杂化轨道,其中2个杂化轨道中各有1个未成对电子,分别与H原子的1s轨道形成共价键,另2个杂化轨道中是成对电子,未与H原子形成共价键;4个sp3杂化轨道在空间构成正四面体形,但由于2对孤电子对的排斥作用,使2个O—H键的键角变得更小,使H2O分子成为V形的空间结构。
思考与讨论
(4)CH4、NH3、H2O中心原子的杂化类型都是sp3,键角为什么依次减小?从杂化轨道理论的角度比较键角大小时有什么方法?
提示:CH4、NH3、H2O中心原子都采取sp3杂化,中心原子上的孤电子对数依次为0、1、2。由于孤电子对对共用电子对的排斥作用使键角变小,孤电子对数越多排斥作用越大,键角越小。比较键角时,先看中心原子杂化类型,杂化类型不同时:键角一般按sp、sp2、sp3顺序依次减小;杂化类型相同时,中心原子孤电子对数越多,键角越小。
6.杂化类型判断:
A的价电子对数
2
3
4
A的杂化轨道数
杂化类型
A的价电子空间构型(VSEPR模型)
A的杂化轨道空间构型
ABm型分子或离子空间构型
对于ABm型分子或离子,其中心原子A的杂化轨道数恰好与A的价电子对数相等。
2
3
4
sp
sp2
sp3
直线型
平面三角形
正四面体
直线型
平面三角形
正四面体
直线型
平面三角形或V形
正四面体三角锥形或V形
1.价电子对之间的夹角越小,排斥力越小。 ( )
2.NH3分子的VSEPR模型与分子空间结构不一致。( )
3.五原子分子的空间结构都是正四面体形。( )
4.杂化轨道与参与杂化的原子轨道的数目相同,但能量不同。( )
5.凡是中心原子采取sp3杂化轨道成键的分子,其空间结构都是正四面体形。( )
6.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键。( )
1.判断正误(正确的打“√”,错误的打“×”)
√
√
×
×
×
×
2.根据价层电子对互斥模型及原子杂化轨道理论判断NF3分子的空间结构和中心原子的杂化方式为( )
A.直线形 sp杂化
B.平面三角形 sp2杂化
C.三角锥形 sp2杂化
D.三角锥形 sp3杂化
解析:判断分子的杂化方式要根据中心原子的孤电子对数以及与中心原子相连的原子个数。在NF3分子中N原子的孤电子对数为1,与其相连的原子数为3,根据原子杂化轨道理论可推知中心原子的杂化方式为sp3杂化,NF3分子的空间结构为三角锥形,类似于NH3。
D
解析:分子中的两个碳原子都是采取sp2杂化,溴原子的价电子排布式为4s24p5,4p轨道上的一个未成对电子与碳原子的一个sp2杂化轨道成键。
3.在BrCH=CHBr分子中,C—Br键采用的成键轨道是( )
A.sp-p B.sp2-s
C.sp2-p D.sp3-p
C
4.指出下列原子的杂化轨道类型、分子的结构式及空间结构。
(1)CS2分子中的C为 杂化,分子的结构式为 ,空间结构为 ;?
(2)CH2O中的C为 杂化,分子的结构式为 ,空间结构为 ;?
(3)CCl4分子中的C为 杂化,分子的结构式为 ,空间结构为 ;?
(4)H2S分子中的S为 杂化,分子的结构式为 ,空间结构为 。?
解析:轨道杂化所用原子轨道的能量相近,且杂化轨道只能用于形成σ键,未参与杂化的p轨道还可以形成π键。杂化轨道类型决定了分子(或离子)的空间结构,如sp2杂化轨道之间的夹角为120°,空间结构为平面三角形。因此,也可根据分子的空间结构确定分子(或离子)中杂化轨道的类型,如CO2为直线形分子,因此分子中C原子的杂化轨道类型为sp杂化。
第二节 分子的空间结构
第三课时 杂化轨道理论简介
写出碳原子的核外电子排布图,思考为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
C原子 电子排布图
(轨道表示式)
1s2
2s2
2p2
H 电子排布图
1s1
思考与讨论
按照我们已经学过的价键理论,甲烷的4个C — H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p 轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到正四面体构型
的甲烷分子
C
C
如何解决这一矛盾,鲍林提出了杂化轨道理论
sp3
C:2s22p2
由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状完全相同的轨道。我们把这种轨道称之为 sp3杂化轨道。
为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的伸展方向成什么立体构型?
四个H原子分别以4个s轨道与C原子上的四个sp3杂化轨道相互重叠后,就形成了四个性质、能量和键角都完全相同的S-SP3σ键,从而构成一个正四面体形的分子。
109°28’
四、杂化理论简介
1.概念:外界条件下,能量相近的原子轨道混杂起来,重新组合新轨道的过程叫做原子轨道的杂化,杂化后的新轨道就称为杂化轨道。
2.要点:
(1)参与杂化的原子轨道能量相近
(同一能级组或相近能级组的轨道)
(2)杂化前后原子轨道数目不变:
参加杂化的轨道数目等于形成的杂化轨道数目;
杂化改变了原子轨道的形状方向,成键时更有利于轨道间的重叠。
(3)杂化前后原子轨道在空间取最大夹角分布,能使相互间排斥力最小。
3.杂化的条件:
(1).只有在形成化学键时才能杂化
(2).只有能量相近的轨道间才能杂化
4.杂化轨道的特征
(1)杂化前后轨道数不变
(2)杂化过程中轨道的形状发生变化
(3)杂化后形成的化学键更稳定
(4)杂化后的新轨道能量、形状都相同
(5)杂化后的轨道之间尽可能远离。
(6)杂化轨道只用于形成σ键和容纳孤电子对
原子轨道杂化与杂化轨道
对杂化过程的理解
sp杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分两个轨道间的夹角为180°,呈直线形
sp 杂化:1个s 轨道与1个p 轨道进行的杂化, 形成2个sp杂化轨道。
5.杂化类型及分子的空间构型
sp杂化
中心原子的1个_____轨道和1个____轨道杂化得到夹角为_________的_________杂化轨道。
{5940675A-B579-460E-94D1-54222C63F5DA}
{5940675A-B579-460E-94D1-54222C63F5DA}
s
p
p
p
{5940675A-B579-460E-94D1-54222C63F5DA}
{5940675A-B579-460E-94D1-54222C63F5DA}
sp
p
p
sp
sp
p
p
s
p
180°
直线形
180°
Cl
Cl
Be
例如: Sp 杂化 —— BeCl2分子的形成
Be原子:1s22s2 没有单个电子,
sp
sp杂化
Cl
Cl
sp
px
px
练习1:分析C2H2的杂化方式
C
{5940675A-B579-460E-94D1-54222C63F5DA}
2p2
{5940675A-B579-460E-94D1-54222C63F5DA}
2s2
基态原子:
H
{5940675A-B579-460E-94D1-54222C63F5DA}
1s1
激发态原子:
C
{5940675A-B579-460E-94D1-54222C63F5DA}
2p3
{5940675A-B579-460E-94D1-54222C63F5DA}
2s1
杂化后:
sp2杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分每两个轨道间的夹角为120°,呈平面三角形
sp2杂化:1个s 轨道与2个p 轨道进行的杂化, 形成3个sp2 杂化轨道。
SP2杂化
中心原子的1个_____轨道和2个____轨道杂化得到夹角为_________的_________杂化轨道。
s
p
120°
平面三角形
{5940675A-B579-460E-94D1-54222C63F5DA}
{5940675A-B579-460E-94D1-54222C63F5DA}
s
p
p
p
{5940675A-B579-460E-94D1-54222C63F5DA}
{5940675A-B579-460E-94D1-54222C63F5DA}
sp2
p
点拨:sp、sp2两种杂化形式中还有未参与杂化的p轨道,可用于形成π键,而杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子对。
120°
F
F
F
B
例如: Sp2 杂化 —— BF3分子的形成
B: 1s22s22p1 没有3个单电子
sp2
sp2杂化
练习2:分析C2H4的杂化方式
C
{5940675A-B579-460E-94D1-54222C63F5DA}
{5940675A-B579-460E-94D1-54222C63F5DA}
2s2
基态原子:
H
{5940675A-B579-460E-94D1-54222C63F5DA}
1s1
激发态原子:
C
{5940675A-B579-460E-94D1-54222C63F5DA}
2p3
{5940675A-B579-460E-94D1-54222C63F5DA}
2s1
杂化后:
H
H
H
H
2p2
练习3:请结合价键理论分析BH3的分子结构
B
H
{5940675A-B579-460E-94D1-54222C63F5DA}
2p1
{5940675A-B579-460E-94D1-54222C63F5DA}
2s2
{5940675A-B579-460E-94D1-54222C63F5DA}
1s1
基态原子:
激发态原子:
B
{5940675A-B579-460E-94D1-54222C63F5DA}
2p2
{5940675A-B579-460E-94D1-54222C63F5DA}
2s1
杂化后:
H
H
H
sp3杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
sp3杂化:1个s 轨道与3个p 轨道进行的杂化,形成4个sp3 杂化轨道。
每个sp3杂化轨道的形状也为一头大,一头小, 含有 1/4 s 轨道和 3/4 p 轨道的成分每两个轨道间的夹角为109.5°,空间构型为正四面体形
中心原子的1个_____轨道和3个____轨道杂化得到夹角为_________的_________杂化轨道。
sp3杂化
s
p
109°28″
正四面体形
{5940675A-B579-460E-94D1-54222C63F5DA}
{5940675A-B579-460E-94D1-54222C63F5DA}
s
p
p
p
{5940675A-B579-460E-94D1-54222C63F5DA}
sp3
例如: Sp3 杂化 —— CH4分子的形成
sp3
C:2s22p2
杂化轨道类型及分子的空间结构
杂化类型
sp
sp2
sp3
参与杂化的原
子轨道及数目
1个s轨道和
1个p轨道
1个s轨道和
2个p轨道
1个s轨道和
3个p轨道
杂化轨道的数目
2
3
4
杂化轨道间的夹角
180°
120°
109°28'
空间结构名称
直线形
平面三角形
正四面体形
实例
CO2、C2H2
BF3、CH2O
CH4、CCl4
在形成多原子分子时,中心原子价电子层上的某些能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程,叫做轨道的杂化(双原子分子中,不存在杂化过程)。例如sp杂化、sp2杂化的过程如下:
(1)观察上述杂化过程,分析原子轨道杂化后,数量和能量有什么变化?
提示:杂化轨道与参与杂化的原子轨道数目相同,但能量不同。s轨道与p轨道的能量不同,杂化后,形成的一组杂化轨道的能量相同。
思考与讨论
(2)2s轨道与3p轨道能否形成sp2杂化轨道?
提示:不能。只有能量相近的原子轨道才能形成杂化轨道。2s轨道与3p轨道不在同一能层,能量相差较大。
(3)用杂化轨道理论解释NH3、H2O的空间结构。
提示:N原子的价电子排布式为2s22p3,在形成NH3分子的过程中,N原子的1个2s轨道和3个2p轨道经杂化后形成4个sp3杂化轨道,其中3个杂化轨道中各有1个未成对电子,分别与H原子的1s轨道形成共价键,另1个杂化轨道中是成对电子,未与H原子形成共价键,4个sp3杂化轨道在空间构成正四面体形;NH3分子中,由于N原子上的孤电子对的排斥作用,使3个N—H键的键角变小,成为三角锥形的空间结构。
O原子的价电子排布式为2s22p4,在形成H2O分子的过程中,O原子的1个2s轨道和3个2p轨道经杂化后形成4个sp3杂化轨道,其中2个杂化轨道中各有1个未成对电子,分别与H原子的1s轨道形成共价键,另2个杂化轨道中是成对电子,未与H原子形成共价键;4个sp3杂化轨道在空间构成正四面体形,但由于2对孤电子对的排斥作用,使2个O—H键的键角变得更小,使H2O分子成为V形的空间结构。
思考与讨论
(4)CH4、NH3、H2O中心原子的杂化类型都是sp3,键角为什么依次减小?从杂化轨道理论的角度比较键角大小时有什么方法?
提示:CH4、NH3、H2O中心原子都采取sp3杂化,中心原子上的孤电子对数依次为0、1、2。由于孤电子对对共用电子对的排斥作用使键角变小,孤电子对数越多排斥作用越大,键角越小。比较键角时,先看中心原子杂化类型,杂化类型不同时:键角一般按sp、sp2、sp3顺序依次减小;杂化类型相同时,中心原子孤电子对数越多,键角越小。
6.杂化类型判断:
A的价电子对数
2
3
4
A的杂化轨道数
杂化类型
A的价电子空间构型(VSEPR模型)
A的杂化轨道空间构型
ABm型分子或离子空间构型
对于ABm型分子或离子,其中心原子A的杂化轨道数恰好与A的价电子对数相等。
2
3
4
sp
sp2
sp3
直线型
平面三角形
正四面体
直线型
平面三角形
正四面体
直线型
平面三角形或V形
正四面体三角锥形或V形
1.价电子对之间的夹角越小,排斥力越小。 ( )
2.NH3分子的VSEPR模型与分子空间结构不一致。( )
3.五原子分子的空间结构都是正四面体形。( )
4.杂化轨道与参与杂化的原子轨道的数目相同,但能量不同。( )
5.凡是中心原子采取sp3杂化轨道成键的分子,其空间结构都是正四面体形。( )
6.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键。( )
1.判断正误(正确的打“√”,错误的打“×”)
√
√
×
×
×
×
2.根据价层电子对互斥模型及原子杂化轨道理论判断NF3分子的空间结构和中心原子的杂化方式为( )
A.直线形 sp杂化
B.平面三角形 sp2杂化
C.三角锥形 sp2杂化
D.三角锥形 sp3杂化
解析:判断分子的杂化方式要根据中心原子的孤电子对数以及与中心原子相连的原子个数。在NF3分子中N原子的孤电子对数为1,与其相连的原子数为3,根据原子杂化轨道理论可推知中心原子的杂化方式为sp3杂化,NF3分子的空间结构为三角锥形,类似于NH3。
D
解析:分子中的两个碳原子都是采取sp2杂化,溴原子的价电子排布式为4s24p5,4p轨道上的一个未成对电子与碳原子的一个sp2杂化轨道成键。
3.在BrCH=CHBr分子中,C—Br键采用的成键轨道是( )
A.sp-p B.sp2-s
C.sp2-p D.sp3-p
C
4.指出下列原子的杂化轨道类型、分子的结构式及空间结构。
(1)CS2分子中的C为 杂化,分子的结构式为 ,空间结构为 ;?
(2)CH2O中的C为 杂化,分子的结构式为 ,空间结构为 ;?
(3)CCl4分子中的C为 杂化,分子的结构式为 ,空间结构为 ;?
(4)H2S分子中的S为 杂化,分子的结构式为 ,空间结构为 。?
解析:轨道杂化所用原子轨道的能量相近,且杂化轨道只能用于形成σ键,未参与杂化的p轨道还可以形成π键。杂化轨道类型决定了分子(或离子)的空间结构,如sp2杂化轨道之间的夹角为120°,空间结构为平面三角形。因此,也可根据分子的空间结构确定分子(或离子)中杂化轨道的类型,如CO2为直线形分子,因此分子中C原子的杂化轨道类型为sp杂化。
