不同价态含硫物质的转化
图片预览



文档简介
不同价态含硫物质的转化
[复习提问]1.氧化还原反应:在反应过程中有元素化合价变化的化学反应。
2.常用的氧化剂:有酸性KMnO4溶液、氯水、硝酸、氧气等;
常用的还原剂:有硫化氢、碘化钾、金属单质、氢气、一氧化碳等。
3.标出硫黄(S)、SO2、H2SO4中硫元素的价态。
0
+4
+6
[引入新课]含硫元素的物质在自然界中依靠大自然的作用进行相互转化,这节课我们自己设计实验,探究在实验室里O、+4、+6价这三种价态硫元素间的转化。
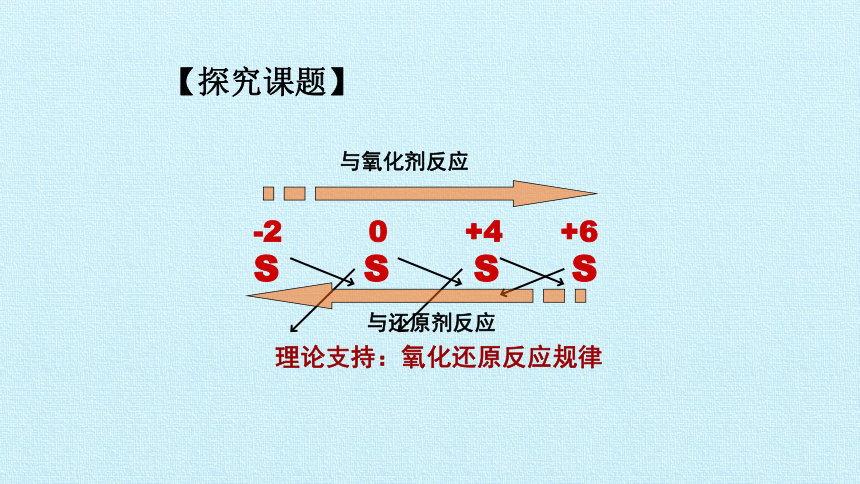
S S S S
-2 0 +4 +6
理论支持:氧化还原反应规律
与氧化剂反应
与还原剂反应
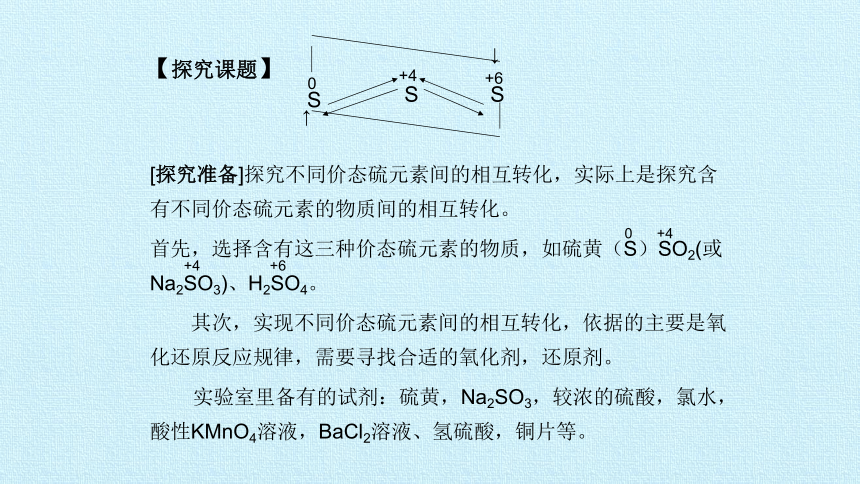
【探究课题】
[探究准备]探究不同价态硫元素间的相互转化,实际上是探究含有不同价态硫元素的物质间的相互转化。
首先,选择含有这三种价态硫元素的物质,如硫黄(S)SO2(或Na2SO3)、H2SO4。
其次,实现不同价态硫元素间的相互转化,依据的主要是氧化还原反应规律,需要寻找合适的氧化剂,还原剂。
实验室里备有的试剂:硫黄,Na2SO3,较浓的硫酸,氯水,酸性KMnO4溶液,BaCl2溶液、氢硫酸,铜片等。
0
+4
+6
+4
【探究课题】
S
S
S
↓
+4
0
↑
+6
S S S S
-2 0 +4 +6
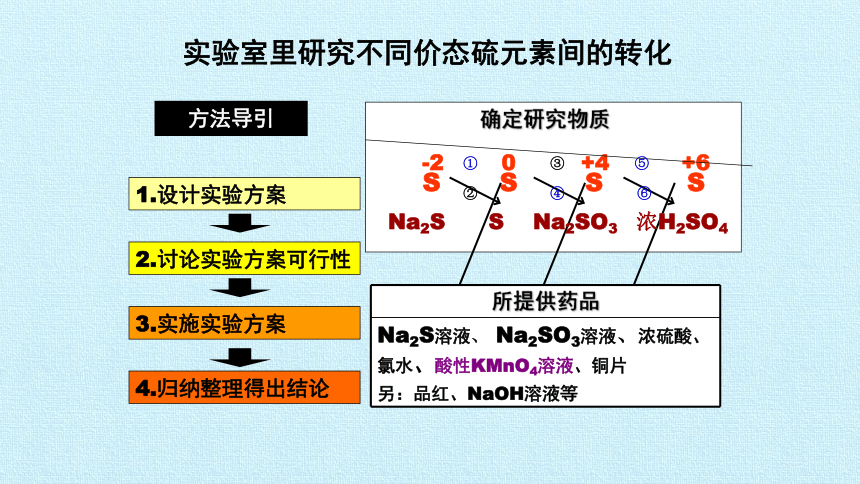
确定研究物质
① ③ ⑤
② ④ ⑥
Na2S S Na2SO3 浓H2SO4
方法导引
2.讨论实验方案可行性
3.实施实验方案
4.归纳整理得出结论
1.设计实验方案
实验室里研究不同价态硫元素间的转化
所提供药品
Na2S溶液、 Na2SO3溶液、浓硫酸、
氯水、酸性KMnO4溶液、铜片
另:品红、NaOH溶液等
S S
0
+4
实验1:硫在空气中燃烧(SO2有毒,妥善处理有毒气体)。
S S
+6
+4
实验2:二氧化硫与氯水反应
氧化剂
氧化剂
探究设计与实施
点燃
S+O2 === SO2
0
+4
SO2+Cl2+2H2O=H2SO4+2HCl
BaCl2+H2SO4=BaSO4↓+2HCl
+4
+6
S S
0
+4
S S
+4
+6
还原剂
还原剂
小结:①
②SO2,Na2SO3也可以被O2氧化:
2SO2+O2 ===2SO3
催化剂
△
S S S
+4
0
+6
氧化剂
氧化剂
小结:
S S S
+4
+6
还原剂
还原剂
0
实验4:铜与浓硫酸反应(需要加热)
原理: Cu +2H2SO4(浓)==CuSO4+SO2↑+2H2O
△
+4
+6
实验3:二氧化硫与氢硫酸反应
SO2 +2H2S==3S↓+2H2O
+4
-2
0
S实现的转化
实验方案
主要实验现象
1
向1mLNa2S溶液中滴加1-2mL酸性KMnO4溶液,振荡。
2
向1mLNa2SO3溶液中滴加2-3滴酸性KMnO4溶液,振荡。
3
将浓硫酸与铜片共热,并将生成的气体依次通入品红溶液和浸有浓氢氧化钠溶液的海绵中。
酸性KMnO4溶液紫色退去
酸性KMnO4溶液紫色退去,出现浅黄色浑浊
有气泡冒出,且品红溶液退色
+4→+6 ⑤
+6→+4 ⑥
-2→0 ①
S S S S
-2 0 +4 +6
① ③ ⑤
② ④ ⑥
归纳整理得出结论
溴水、HNO3、Fe3+ 、H2O2
MnO4(H+)、
Cu、C、
HI、H2S
H2S
Cl2、O2、 KMnO4(H+)
H2S
S
SO2
-2
0
+4
+6
H2SO4
O2
H2
不同价态硫元素间的相互转化
归纳总结
归纳总结
1.不同价态硫元素之间的相互转化关系:
2.含有不同价态硫元素的物质间的转化与氧化还原反应有关,只要选择合适的氧化剂、还原剂就可以实现其他含有不同价态硫元素物质间的相互转化。
强氧化剂
强还原剂
3.SO2和浓H2SO4的化学性质
SO2的化学性质
氧化性:SO2 +2H2S==3S↓+2H2O
还原性:
酸性氧化物:SO2+2NaOH =Na2SO3+H2O
2SO2+O2 ===2SO3
催化剂
△
浓H2SO4的化学性:强氧化性
①与金属单质反应:Cu+2H2SO4(浓) CuSO4+SO2 ↑+2H2O
②与非金属单质反应:C+2H2SO4(浓) CO2↑+2SO2 ↑+2H2O
③冷的浓H2SO4将Fe、Al钝化
△
△
[工业制H2SO4的流程]
第一步:制取SO2:
第二步:SO2的催化氧化:
第三步:SO3的吸收:SO3+H2O=H2SO4
2SO2+O2 ===2SO3
催化剂
△
点燃
S+O2 === SO2
谢 谢
[复习提问]1.氧化还原反应:在反应过程中有元素化合价变化的化学反应。
2.常用的氧化剂:有酸性KMnO4溶液、氯水、硝酸、氧气等;
常用的还原剂:有硫化氢、碘化钾、金属单质、氢气、一氧化碳等。
3.标出硫黄(S)、SO2、H2SO4中硫元素的价态。
0
+4
+6
[引入新课]含硫元素的物质在自然界中依靠大自然的作用进行相互转化,这节课我们自己设计实验,探究在实验室里O、+4、+6价这三种价态硫元素间的转化。
S S S S
-2 0 +4 +6
理论支持:氧化还原反应规律
与氧化剂反应
与还原剂反应
【探究课题】
[探究准备]探究不同价态硫元素间的相互转化,实际上是探究含有不同价态硫元素的物质间的相互转化。
首先,选择含有这三种价态硫元素的物质,如硫黄(S)SO2(或Na2SO3)、H2SO4。
其次,实现不同价态硫元素间的相互转化,依据的主要是氧化还原反应规律,需要寻找合适的氧化剂,还原剂。
实验室里备有的试剂:硫黄,Na2SO3,较浓的硫酸,氯水,酸性KMnO4溶液,BaCl2溶液、氢硫酸,铜片等。
0
+4
+6
+4
【探究课题】
S
S
S
↓
+4
0
↑
+6
S S S S
-2 0 +4 +6
确定研究物质
① ③ ⑤
② ④ ⑥
Na2S S Na2SO3 浓H2SO4
方法导引
2.讨论实验方案可行性
3.实施实验方案
4.归纳整理得出结论
1.设计实验方案
实验室里研究不同价态硫元素间的转化
所提供药品
Na2S溶液、 Na2SO3溶液、浓硫酸、
氯水、酸性KMnO4溶液、铜片
另:品红、NaOH溶液等
S S
0
+4
实验1:硫在空气中燃烧(SO2有毒,妥善处理有毒气体)。
S S
+6
+4
实验2:二氧化硫与氯水反应
氧化剂
氧化剂
探究设计与实施
点燃
S+O2 === SO2
0
+4
SO2+Cl2+2H2O=H2SO4+2HCl
BaCl2+H2SO4=BaSO4↓+2HCl
+4
+6
S S
0
+4
S S
+4
+6
还原剂
还原剂
小结:①
②SO2,Na2SO3也可以被O2氧化:
2SO2+O2 ===2SO3
催化剂
△
S S S
+4
0
+6
氧化剂
氧化剂
小结:
S S S
+4
+6
还原剂
还原剂
0
实验4:铜与浓硫酸反应(需要加热)
原理: Cu +2H2SO4(浓)==CuSO4+SO2↑+2H2O
△
+4
+6
实验3:二氧化硫与氢硫酸反应
SO2 +2H2S==3S↓+2H2O
+4
-2
0
S实现的转化
实验方案
主要实验现象
1
向1mLNa2S溶液中滴加1-2mL酸性KMnO4溶液,振荡。
2
向1mLNa2SO3溶液中滴加2-3滴酸性KMnO4溶液,振荡。
3
将浓硫酸与铜片共热,并将生成的气体依次通入品红溶液和浸有浓氢氧化钠溶液的海绵中。
酸性KMnO4溶液紫色退去
酸性KMnO4溶液紫色退去,出现浅黄色浑浊
有气泡冒出,且品红溶液退色
+4→+6 ⑤
+6→+4 ⑥
-2→0 ①
S S S S
-2 0 +4 +6
① ③ ⑤
② ④ ⑥
归纳整理得出结论
溴水、HNO3、Fe3+ 、H2O2
MnO4(H+)、
Cu、C、
HI、H2S
H2S
Cl2、O2、 KMnO4(H+)
H2S
S
SO2
-2
0
+4
+6
H2SO4
O2
H2
不同价态硫元素间的相互转化
归纳总结
归纳总结
1.不同价态硫元素之间的相互转化关系:
2.含有不同价态硫元素的物质间的转化与氧化还原反应有关,只要选择合适的氧化剂、还原剂就可以实现其他含有不同价态硫元素物质间的相互转化。
强氧化剂
强还原剂
3.SO2和浓H2SO4的化学性质
SO2的化学性质
氧化性:SO2 +2H2S==3S↓+2H2O
还原性:
酸性氧化物:SO2+2NaOH =Na2SO3+H2O
2SO2+O2 ===2SO3
催化剂
△
浓H2SO4的化学性:强氧化性
①与金属单质反应:Cu+2H2SO4(浓) CuSO4+SO2 ↑+2H2O
②与非金属单质反应:C+2H2SO4(浓) CO2↑+2SO2 ↑+2H2O
③冷的浓H2SO4将Fe、Al钝化
△
△
[工业制H2SO4的流程]
第一步:制取SO2:
第二步:SO2的催化氧化:
第三步:SO3的吸收:SO3+H2O=H2SO4
2SO2+O2 ===2SO3
催化剂
△
点燃
S+O2 === SO2
谢 谢
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
