高中化学必修一第四章__第三节硫和氮的氧化物
文档属性
| 名称 | 高中化学必修一第四章__第三节硫和氮的氧化物 |  | |
| 格式 | zip | ||
| 文件大小 | 9.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-17 18:04:35 | ||
图片预览




文档简介
(共15张PPT)
二氧化硫和三氧化硫
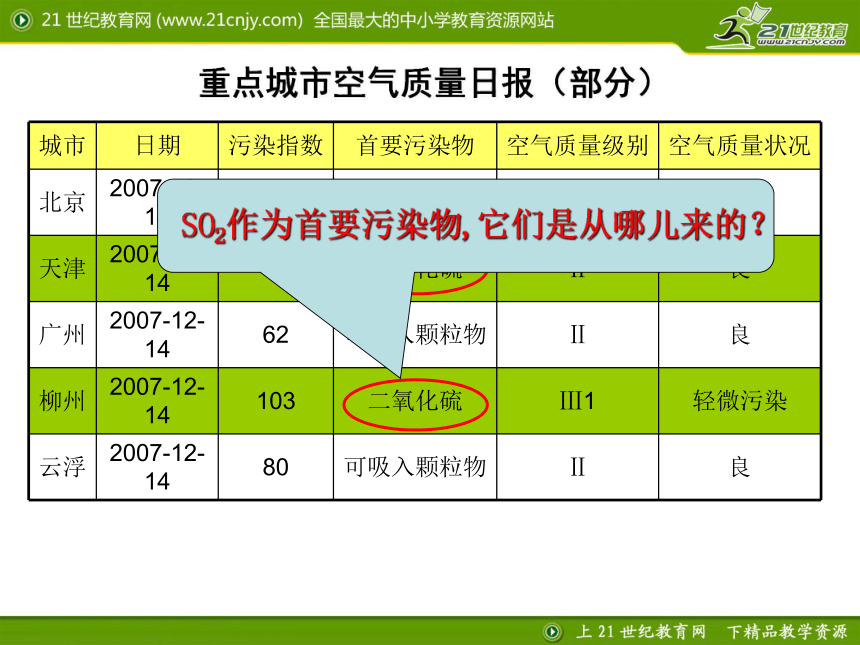
重点城市空气质量日报(部分)
城市 日期 污染指数 首要污染物 空气质量级别 空气质量状况
北京 2007-12-14 91 可吸入颗粒物 Ⅱ 良
天津 2007-12-14 82 二氧化硫 Ⅱ 良
广州 2007-12-14 62 可吸入颗粒物 Ⅱ 良
柳州 2007-12-14 103 二氧化硫 Ⅲ1 轻微污染
云浮 2007-12-14 80 可吸入颗粒物 Ⅱ 良
SO2作为首要污染物,它们是从哪儿来的?
二氧化硫
主要来源
点燃
S+O2===SO2
现象:
空气中:
微弱的淡蓝色火焰;
纯氧中:
明亮的蓝紫色火焰。
硫的存在和物理性质
存在
颜色
溶解性
硬度
自然界中游离态化合态同时存在
黄色
不溶于水,微溶于酒精,易溶cs2
质脆,易研成粉末
实验探究:二氧化硫的性质
观看视频
二氧化硫溶于水
二氧化硫的漂白性
实验现象:
①试管中的水面上升,溶液几乎充满整个试管
②石蕊试液变红
③加入品红溶液,品红溶液褪色
④加热后,溶液又变成红色,同时有刺激性气味的气体生成。
实验结论:
①SO2易溶于水,且与水反应
SO2 + H2O
逆反应
H2SO3
正反应
② SO2有漂白作用;但漂白后的新物质不稳定,易恢复原来的颜色
(检验SO2的存在)
归纳小结
二氧化硫的物理性质
1、无色、有刺激性气味、气体
2、易液化(-10℃)
3、密度大于空气
4、易溶于水(1:40)
5、有毒:SO2是污染大气主要有害物质之一。
1、二氧化硫跟水反应:
SO2 + H2O
逆反应
H2SO3
正反应
可逆反应:在同一条件下, 既能向正反应方向进行,
又能向逆反应方向进行。
特点
正反应和逆反应同时发生,均不彻底,
反应物和生成物共存。
(中强酸)
二氧化硫的化学性质
[思考]下列反应是否为可逆反应?
(1) CO2+H2O = H2CO3,H2CO3=H2O+CO2↑
(2) 2H2+O2 == 2H2O,2H2O == 2H2↑+O2↑
点燃
通电
2、二氧化硫的漂白性:
SO2漂白原理:
由于它能与某些有色物质生成不稳定的无色物质。无色物质容易分解而使有色物质恢复原来的颜色。
3、还原性:
可被X2(卤素单质)、O2、KMnO4(H+)、HNO3、Fe3+、Na2O2等许多氧化剂氧化。
2SO2 + O2 2SO3
催化剂
△
类比学习法
CO2 SO2 SO3
与H2O反应
与CaO反应
与NaOH反应
与Ca(OH)2
二氧化硫的用途
SO2 + O2 SO3
催化剂
△
SO3 + H2O = H2SO4
⑵可以漂白白纸浆、毛、丝、草编制品等。
⑶杀灭霉菌和细菌。
⑷作食物和干果的防腐剂。
⑴制造硫酸:
二氧化硫和三氧化硫
重点城市空气质量日报(部分)
城市 日期 污染指数 首要污染物 空气质量级别 空气质量状况
北京 2007-12-14 91 可吸入颗粒物 Ⅱ 良
天津 2007-12-14 82 二氧化硫 Ⅱ 良
广州 2007-12-14 62 可吸入颗粒物 Ⅱ 良
柳州 2007-12-14 103 二氧化硫 Ⅲ1 轻微污染
云浮 2007-12-14 80 可吸入颗粒物 Ⅱ 良
SO2作为首要污染物,它们是从哪儿来的?
二氧化硫
主要来源
点燃
S+O2===SO2
现象:
空气中:
微弱的淡蓝色火焰;
纯氧中:
明亮的蓝紫色火焰。
硫的存在和物理性质
存在
颜色
溶解性
硬度
自然界中游离态化合态同时存在
黄色
不溶于水,微溶于酒精,易溶cs2
质脆,易研成粉末
实验探究:二氧化硫的性质
观看视频
二氧化硫溶于水
二氧化硫的漂白性
实验现象:
①试管中的水面上升,溶液几乎充满整个试管
②石蕊试液变红
③加入品红溶液,品红溶液褪色
④加热后,溶液又变成红色,同时有刺激性气味的气体生成。
实验结论:
①SO2易溶于水,且与水反应
SO2 + H2O
逆反应
H2SO3
正反应
② SO2有漂白作用;但漂白后的新物质不稳定,易恢复原来的颜色
(检验SO2的存在)
归纳小结
二氧化硫的物理性质
1、无色、有刺激性气味、气体
2、易液化(-10℃)
3、密度大于空气
4、易溶于水(1:40)
5、有毒:SO2是污染大气主要有害物质之一。
1、二氧化硫跟水反应:
SO2 + H2O
逆反应
H2SO3
正反应
可逆反应:在同一条件下, 既能向正反应方向进行,
又能向逆反应方向进行。
特点
正反应和逆反应同时发生,均不彻底,
反应物和生成物共存。
(中强酸)
二氧化硫的化学性质
[思考]下列反应是否为可逆反应?
(1) CO2+H2O = H2CO3,H2CO3=H2O+CO2↑
(2) 2H2+O2 == 2H2O,2H2O == 2H2↑+O2↑
点燃
通电
2、二氧化硫的漂白性:
SO2漂白原理:
由于它能与某些有色物质生成不稳定的无色物质。无色物质容易分解而使有色物质恢复原来的颜色。
3、还原性:
可被X2(卤素单质)、O2、KMnO4(H+)、HNO3、Fe3+、Na2O2等许多氧化剂氧化。
2SO2 + O2 2SO3
催化剂
△
类比学习法
CO2 SO2 SO3
与H2O反应
与CaO反应
与NaOH反应
与Ca(OH)2
二氧化硫的用途
SO2 + O2 SO3
催化剂
△
SO3 + H2O = H2SO4
⑵可以漂白白纸浆、毛、丝、草编制品等。
⑶杀灭霉菌和细菌。
⑷作食物和干果的防腐剂。
⑴制造硫酸:
