2020-2021学年高一化学1.1.3 核素精编课件(人教版必修二)(共17张ppt)
文档属性
| 名称 | 2020-2021学年高一化学1.1.3 核素精编课件(人教版必修二)(共17张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-18 08:26:15 | ||
图片预览




文档简介
第一节 元素周期表
第三课时 核素
第一章 物质结构 元素周期律
【考纲要求】
1.了解元素、核素和同位素的含义。
2.了解原子的构成。
3.了解原子序数、核电荷数、质子数、中子数、
核外电子数以及它们之间的相互关系。
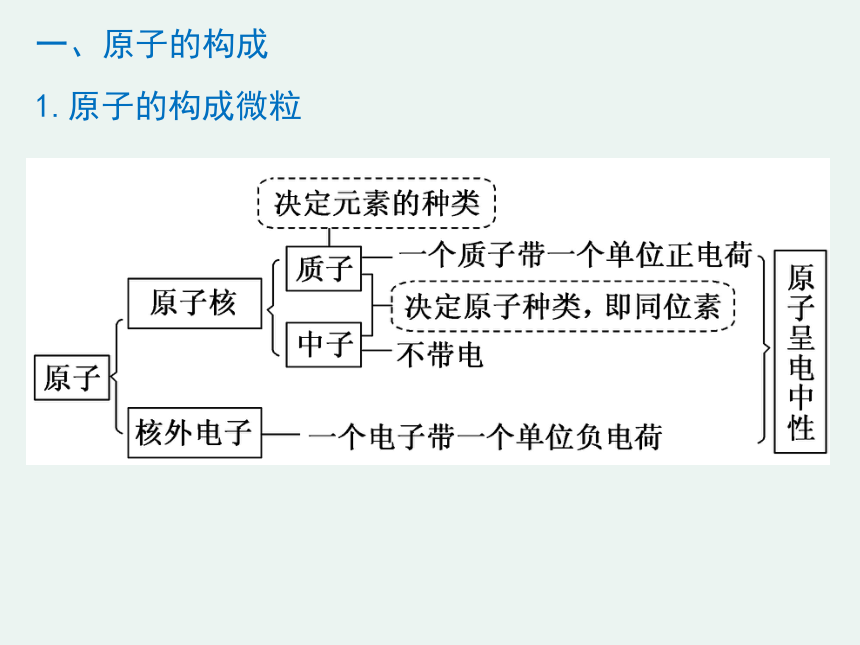
一、原子的构成
1.原子的构成微粒
核外电子数
阳离子
阴离子
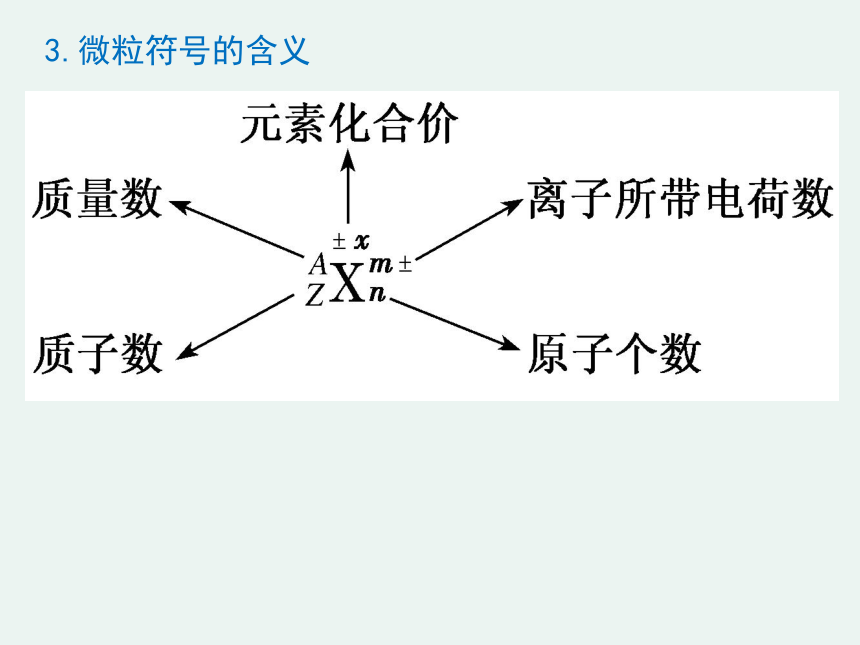
3.微粒符号的含义
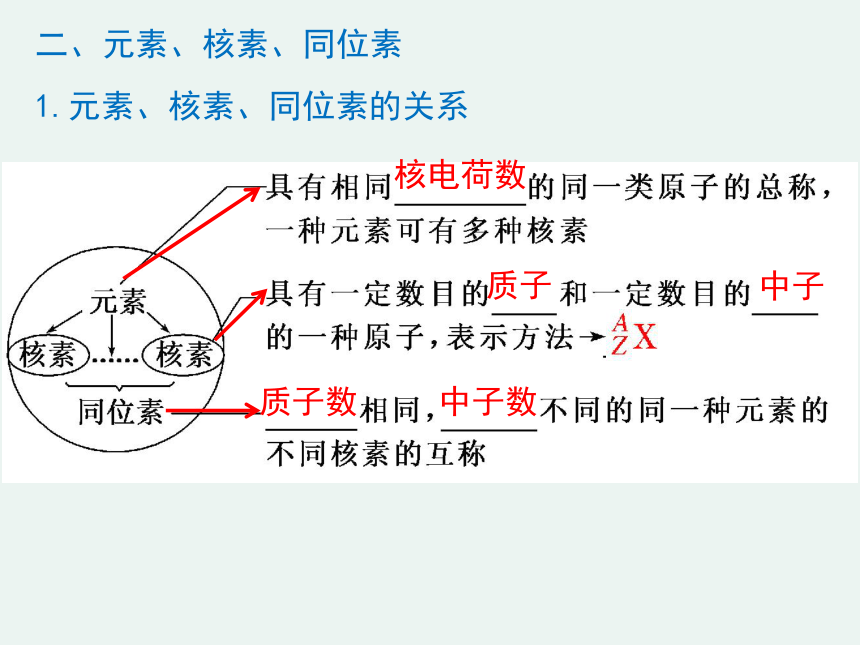
二、元素、核素、同位素
1.元素、核素、同位素的关系
质子数
中子数
质子
中子
核电荷数
4.几种核素的重要用途
三、相对原子质量
原子的近似相对原子质量===质量数
【跟踪检测】
1.在粒子NH3D+中,电子数、质子数和中子数之比为
( )
A.10∶7∶11 B.11∶11∶8
C.10∶11∶8 D.11∶8∶10
C
2.2016年IUPAC命名117号元素为Ts(中文名“ ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是( )
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是 Ts
D
3.氢元素有三种同位素H、D、T,氯元素有两种同位素35Cl、37Cl。当用一种仪器分别测定10 000个氯化氢的相对分子质量,所得数值最多有多少种( )
A.2种 B.5种
C.6种 D.10 000种
解析:1H35Cl:36,1H37Cl:38,D35Cl:37,D37Cl:39,T35Cl:38,T37Cl:40,共有5种。
B
C
D
本课结束
第三课时 核素
第一章 物质结构 元素周期律
【考纲要求】
1.了解元素、核素和同位素的含义。
2.了解原子的构成。
3.了解原子序数、核电荷数、质子数、中子数、
核外电子数以及它们之间的相互关系。
一、原子的构成
1.原子的构成微粒
核外电子数
阳离子
阴离子
3.微粒符号的含义
二、元素、核素、同位素
1.元素、核素、同位素的关系
质子数
中子数
质子
中子
核电荷数
4.几种核素的重要用途
三、相对原子质量
原子的近似相对原子质量===质量数
【跟踪检测】
1.在粒子NH3D+中,电子数、质子数和中子数之比为
( )
A.10∶7∶11 B.11∶11∶8
C.10∶11∶8 D.11∶8∶10
C
2.2016年IUPAC命名117号元素为Ts(中文名“ ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是( )
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是 Ts
D
3.氢元素有三种同位素H、D、T,氯元素有两种同位素35Cl、37Cl。当用一种仪器分别测定10 000个氯化氢的相对分子质量,所得数值最多有多少种( )
A.2种 B.5种
C.6种 D.10 000种
解析:1H35Cl:36,1H37Cl:38,D35Cl:37,D37Cl:39,T35Cl:38,T37Cl:40,共有5种。
B
C
D
本课结束
