2020-2021学年高一化学1.2.1 原子核外电子的排布精编课件(人教版必修二)(共21张ppt)
文档属性
| 名称 | 2020-2021学年高一化学1.2.1 原子核外电子的排布精编课件(人教版必修二)(共21张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-18 00:00:00 | ||
图片预览







文档简介
(共21张PPT)
第一章第二节
元素周期律
第一课时
原子核外电子的排布
【考纲要求】
1.了解元素原子核外电子排布规律。
2.掌握原子结构示意图的表示方法。
一.核外电子的分层排布
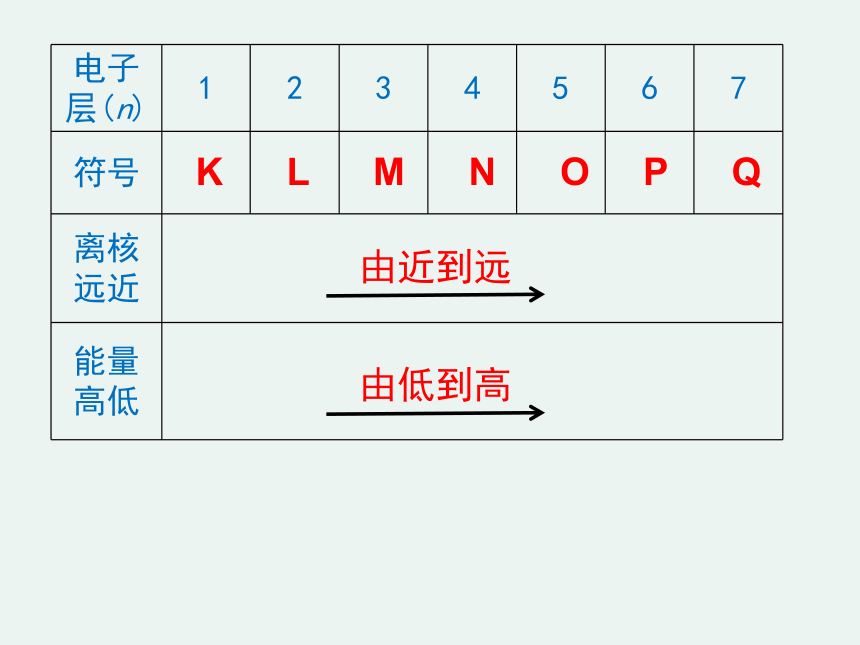
在多电子的原子里,电子分别在能量不同的区域内运动,在离核较近的区域内运动的电子能量较
,在离核较远的区域内运动的电子能量较
,把不同的区域简化为不连续的壳层,也称作
(如右图)。电子总是先从
层排起,这又叫核外电子的分层排布。
低
高
电子层
内
电子层(n)
1
2
3
4
5
6
7
符号
离核远近
能量高低
K
L
M
N
O
P
Q
由近到远
由低到高
1.核外电子排布的规律
(1)各电子层最多容纳
个电子;
(2)最外层电子数不超过____个
(K层为最外层时不超过____个);
(3)次外层电子数不超过____个;倒数第三层电子数不超过____个
(4)核外电子总是尽先排布在能量
的电子层,然后由里向外,依次排布在能量逐步
的电子层。
2n2
8
2
18
32
较低
较高
以上四条规律相互联系和制约,
如K原子为
而不能写成
因为尽管第三层最多可排2×32=18个,但作为最外层不能超过8个。
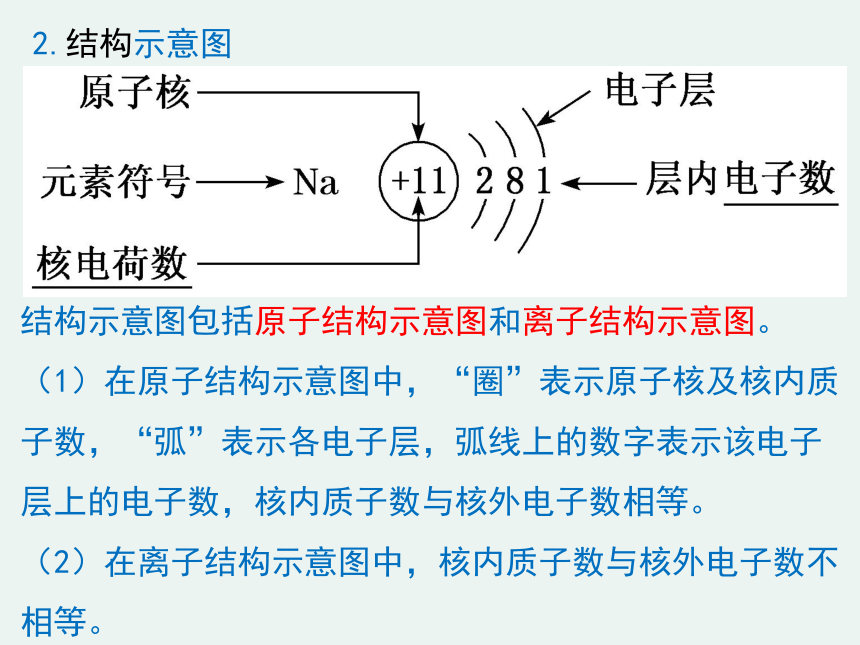
2.结构示意图
结构示意图包括原子结构示意图和离子结构示意图。
(1)在原子结构示意图中,“圈”表示原子核及核内质子数,“弧”表示各电子层,弧线上的数字表示该电子层上的电子数,核内质子数与核外电子数相等。
(2)在离子结构示意图中,核内质子数与核外电子数不相等。
试用原子结构示意图表示下列粒子:Na+、O、S2-、Cl-
练习
3.核外电子排布与元素性质的关系
(1)金属元素原子的最外层电子数一般小于4,较易
电子,形成阳离子,表现出
性,在化合物中显正化合价。
(2)非金属元素原子的最外层电子数一般大于或等于4,较易
电子,活泼非金属原子易形成阴离子,表现出
。在化合物中主要显负化合价。
(3)稀有气体元素的原子最外层为
电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为
价。
失
得
还原
氧化
8
0
二.元素的原子结构和原子半径及主要化合价的变化规律
1.原子半径大小的比较
同主族从上到下,原子半径逐渐
。
同周期从左到右,原子半径逐渐
。
例:
Li、Na、K
;
Na、Mg、Al
。
增大
减小
Na
>
Mg
>
Al
Li
<
Na
<
K
2.离子半径大小的比较
(1)具有相同电子层结构的离子半径大小的比较,
“序大径小”
电子层数相同,随着核电荷数的增加,原子核对核外电子的吸引能力
,半径
。
增强
减小
例:
比较O2-、Na+、Mg2+、Al3+
半径大小:
;
O2-
>
Na+
>
Mg2+
>
Al3+
(2)同主族离子半径大小的比较
元素周期表中从上到下,电子层数逐渐
,离子半径逐渐
。
(3)同一元素的不同粒子的半径大小比较
同种元素的各种微粒核外电子数越多,半径
,高价阳离子半径
低价离子半径。
增加
增大
越大
小于
例:
F-、Cl-、Br-
;
Fe、Fe2+、Fe3+
。
F-
<
Cl-
<
Br-
Fe
>
Fe2+
>
Fe3+
3.主要化合价
原子序数
最高正价或最低负价的变化
1~2
+1
3~10
+1
+4
+5
-4
-1
11~18
+1
+4
+5
+7
-4
-1
①主族元素的最高正化合价
=__________=___________
②非金属最高正价+|最低负化合价|=______
8
最外层电子数
主族序数
(1)常见的“10电子”微粒
三.常见的“10电子”“18电子”微粒
(2)常见的“18电子”微粒
跟踪检测
1.不符合原子核外电子排布基本规律的是( )
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
解析:A项为能量最低原理,正确;K层离核最近,能量最低,B正确;次外层电子数不超过18,C正确;各电子层最多容纳电子数为2n2,D错误。
D
2.在元素周期表的前18号元素中,最外层电子数是其电子层数的2倍的元素共有( )
A.1种
B.2种
C.3种
D.4种
解析:He、C、S符合题意。
C
3.X、Y、Z三种短周期元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的次外层电子数是最外层电子数的2倍,Z原子的次外层电子数是最外层电子数的4倍。则X、Y、Z三种元素可能的组合是( )
A.C、Si、Mg
B.Li、C、Mg
C.C、Mg、Li
D.C、O、Mg
解析:短周期元素中最外层电子数是次外层电子数的2倍的元素是C,次外层电子数是最外层电子数2倍的有Li和Si,次外层电子数是最外层电子数4倍的是Mg,故答案为A项。
A
4.某元素X,其原子的电子层数为(n-1),最外层电子数为(2n-1)。下列有关元素X的说法中正确的是( )
A.X可能是金属元素
B.由X形成的含氧酸均为强酸
C.X不能形成化学式为KXO4的含氧酸盐
D.元素X的气态氢化物一定极易溶于水
解析:
由X原子的最外层电子数为(2n-1)可以推知n≤4,则X的电子层数≤3,X为短周期元素。当n=4时,X为Cl元素;当n=3时,X为N元素;当n=2时,不符合题意。HNO2和HClO均为弱酸,B错误;Cl元素能形成KClO4,C错误;NH3和HCl均极易溶于水,D正确。
D
5.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
答案:(1)B (2)C (3)D
把与下面的元素有关性质相符的曲线图的序号填在相应横线上。
(1)第ⅡA族元素的最外层电子数:________。
(2)第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径:________。
(3)第二、三周期主族元素随原子序数递增,原子半径的变化:________。
本课结束
第一章第二节
元素周期律
第一课时
原子核外电子的排布
【考纲要求】
1.了解元素原子核外电子排布规律。
2.掌握原子结构示意图的表示方法。
一.核外电子的分层排布
在多电子的原子里,电子分别在能量不同的区域内运动,在离核较近的区域内运动的电子能量较
,在离核较远的区域内运动的电子能量较
,把不同的区域简化为不连续的壳层,也称作
(如右图)。电子总是先从
层排起,这又叫核外电子的分层排布。
低
高
电子层
内
电子层(n)
1
2
3
4
5
6
7
符号
离核远近
能量高低
K
L
M
N
O
P
Q
由近到远
由低到高
1.核外电子排布的规律
(1)各电子层最多容纳
个电子;
(2)最外层电子数不超过____个
(K层为最外层时不超过____个);
(3)次外层电子数不超过____个;倒数第三层电子数不超过____个
(4)核外电子总是尽先排布在能量
的电子层,然后由里向外,依次排布在能量逐步
的电子层。
2n2
8
2
18
32
较低
较高
以上四条规律相互联系和制约,
如K原子为
而不能写成
因为尽管第三层最多可排2×32=18个,但作为最外层不能超过8个。
2.结构示意图
结构示意图包括原子结构示意图和离子结构示意图。
(1)在原子结构示意图中,“圈”表示原子核及核内质子数,“弧”表示各电子层,弧线上的数字表示该电子层上的电子数,核内质子数与核外电子数相等。
(2)在离子结构示意图中,核内质子数与核外电子数不相等。
试用原子结构示意图表示下列粒子:Na+、O、S2-、Cl-
练习
3.核外电子排布与元素性质的关系
(1)金属元素原子的最外层电子数一般小于4,较易
电子,形成阳离子,表现出
性,在化合物中显正化合价。
(2)非金属元素原子的最外层电子数一般大于或等于4,较易
电子,活泼非金属原子易形成阴离子,表现出
。在化合物中主要显负化合价。
(3)稀有气体元素的原子最外层为
电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为
价。
失
得
还原
氧化
8
0
二.元素的原子结构和原子半径及主要化合价的变化规律
1.原子半径大小的比较
同主族从上到下,原子半径逐渐
。
同周期从左到右,原子半径逐渐
。
例:
Li、Na、K
;
Na、Mg、Al
。
增大
减小
Na
>
Mg
>
Al
Li
<
Na
<
K
2.离子半径大小的比较
(1)具有相同电子层结构的离子半径大小的比较,
“序大径小”
电子层数相同,随着核电荷数的增加,原子核对核外电子的吸引能力
,半径
。
增强
减小
例:
比较O2-、Na+、Mg2+、Al3+
半径大小:
;
O2-
>
Na+
>
Mg2+
>
Al3+
(2)同主族离子半径大小的比较
元素周期表中从上到下,电子层数逐渐
,离子半径逐渐
。
(3)同一元素的不同粒子的半径大小比较
同种元素的各种微粒核外电子数越多,半径
,高价阳离子半径
低价离子半径。
增加
增大
越大
小于
例:
F-、Cl-、Br-
;
Fe、Fe2+、Fe3+
。
F-
<
Cl-
<
Br-
Fe
>
Fe2+
>
Fe3+
3.主要化合价
原子序数
最高正价或最低负价的变化
1~2
+1
3~10
+1
+4
+5
-4
-1
11~18
+1
+4
+5
+7
-4
-1
①主族元素的最高正化合价
=__________=___________
②非金属最高正价+|最低负化合价|=______
8
最外层电子数
主族序数
(1)常见的“10电子”微粒
三.常见的“10电子”“18电子”微粒
(2)常见的“18电子”微粒
跟踪检测
1.不符合原子核外电子排布基本规律的是( )
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
解析:A项为能量最低原理,正确;K层离核最近,能量最低,B正确;次外层电子数不超过18,C正确;各电子层最多容纳电子数为2n2,D错误。
D
2.在元素周期表的前18号元素中,最外层电子数是其电子层数的2倍的元素共有( )
A.1种
B.2种
C.3种
D.4种
解析:He、C、S符合题意。
C
3.X、Y、Z三种短周期元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的次外层电子数是最外层电子数的2倍,Z原子的次外层电子数是最外层电子数的4倍。则X、Y、Z三种元素可能的组合是( )
A.C、Si、Mg
B.Li、C、Mg
C.C、Mg、Li
D.C、O、Mg
解析:短周期元素中最外层电子数是次外层电子数的2倍的元素是C,次外层电子数是最外层电子数2倍的有Li和Si,次外层电子数是最外层电子数4倍的是Mg,故答案为A项。
A
4.某元素X,其原子的电子层数为(n-1),最外层电子数为(2n-1)。下列有关元素X的说法中正确的是( )
A.X可能是金属元素
B.由X形成的含氧酸均为强酸
C.X不能形成化学式为KXO4的含氧酸盐
D.元素X的气态氢化物一定极易溶于水
解析:
由X原子的最外层电子数为(2n-1)可以推知n≤4,则X的电子层数≤3,X为短周期元素。当n=4时,X为Cl元素;当n=3时,X为N元素;当n=2时,不符合题意。HNO2和HClO均为弱酸,B错误;Cl元素能形成KClO4,C错误;NH3和HCl均极易溶于水,D正确。
D
5.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
答案:(1)B (2)C (3)D
把与下面的元素有关性质相符的曲线图的序号填在相应横线上。
(1)第ⅡA族元素的最外层电子数:________。
(2)第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径:________。
(3)第二、三周期主族元素随原子序数递增,原子半径的变化:________。
本课结束
