2020-2021学年高一化学1.1.1 元素周期表精编课件(人教版必修二)(共18张ppt)
文档属性
| 名称 | 2020-2021学年高一化学1.1.1 元素周期表精编课件(人教版必修二)(共18张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-18 00:00:00 | ||
图片预览




文档简介
(共18张PPT)
第一节
元素周期表
第一课时
元素周期表
第一章
物质结构
元素周期律
【考纲要求】
1.了解周期、主族序数和原子结构的关系;
2.了解元素周期表的结构,了解元素周期表周期和族及其应用。
1869年门捷列夫在继承和分析了前人工作的基础上,对大量实验事实进行了订正、分析和概括,成功地对元素进行了科学分类。他总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着相对原子质量的递增而呈现周期性的变化。
他还预言了一些未知元素的性质都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原因。
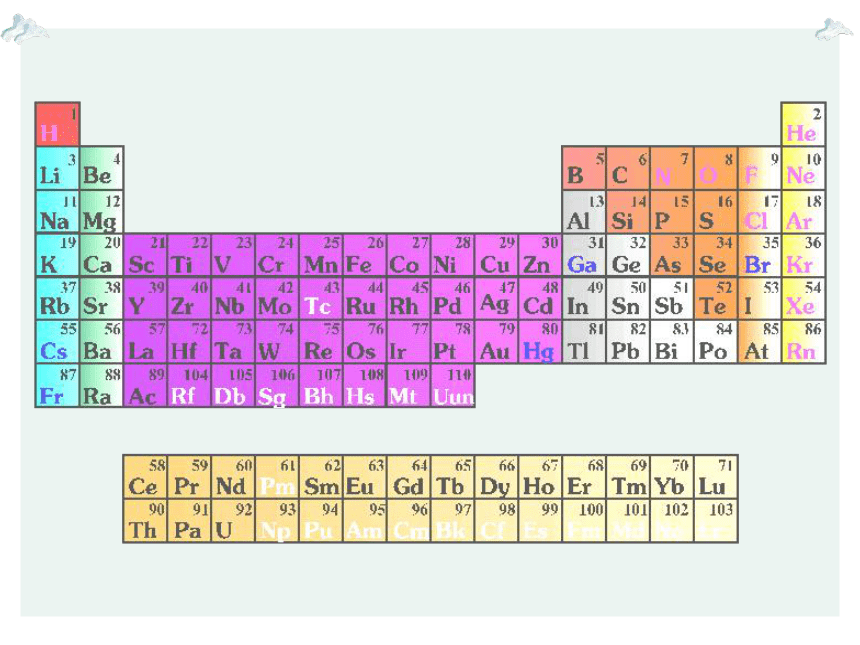
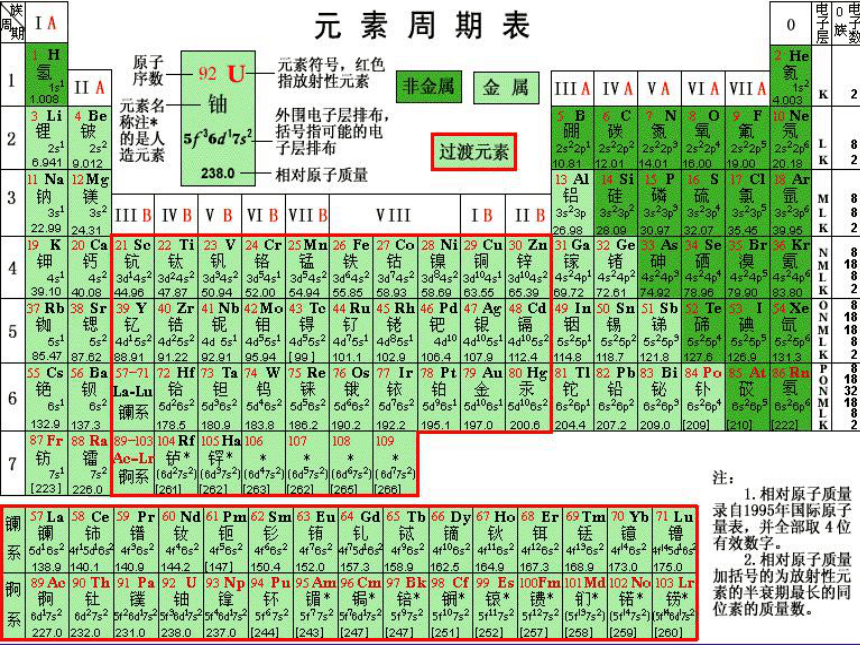
元素周期表
1.编排原则
原子序数=质子数=核电荷数=核外电子数
类别
周期序数
起止元素
包括元素种数
核外电子层数
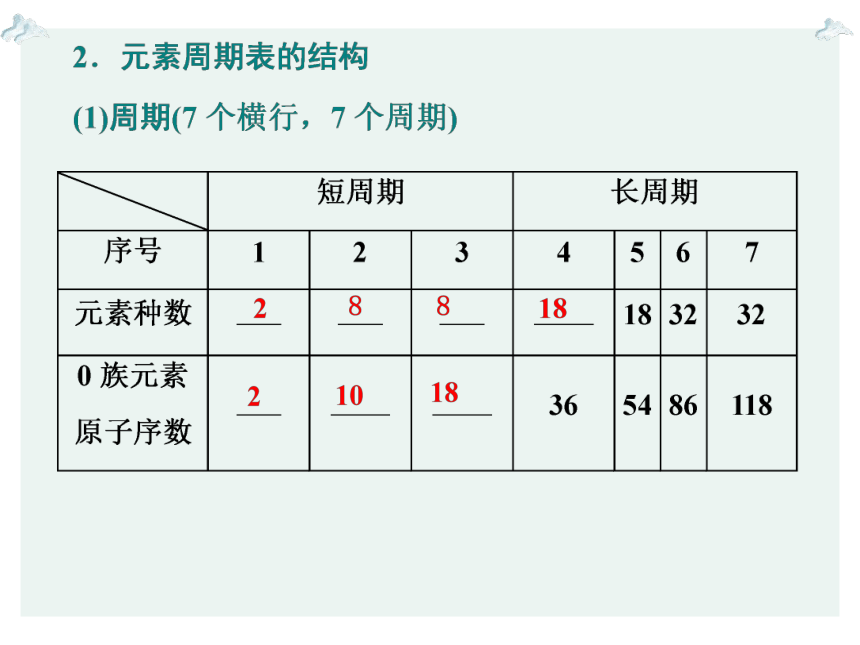
短周期
1
H—He
2
1
2
Li—Ne
8
2
3
Na—Ar
8
3
长周期
4
K—Kr
18
4
5
Rb—Xe
18
5
6
Cs—Rn
32
6
7
Fr—118号
32
7
总结:
周期
(7个)
族
(16个)
短周期
长周期
第
1周期
第
2周期
第
6周期
第
3周期
第
5周期
第
4周期
第
7周期
——
2
种
——
8
种
——
8
种
——
18
种
——
18
种
——
32
种
——
26
种
主族
副族
第VIII族
0
族
共
7
个主族,包括短周期和长周期元素
共
7
个副族,只包括在长周期中
包括第8、9、10
纵行
稀有气体元素
七横七周期
,三短和四长
。
十八纵列十六族,七主七副零VIII三
3.元素位置
①周期序数与电子层数的关系:
周期序数=核外电子层数
②主族序数与最外层电子数的关系:
主族序数=最外层电子数
4.常见族名
ⅠA(除H外)称为碱金属元素
ⅡA称为碱土金属元素
ⅣA称为碳族元素
ⅤA称为氮族元素
ⅥA称为氧族元素
ⅦA称为卤族元素
副族和第Ⅷ族全部是金属元素;又称为过渡金属元素
【当堂检测】
1.某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于(
)
A.第二周期
B.第三周期
C.ⅣA族
D.ⅥA族
2.同主族元素原子的核外电子数差值可能为(
)
A.6
B.12
C.26
D.30
AC
C
3.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是
(
)
A.HF
B.H3O+
C.NaH
D.H2O2
4.某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数
(
)
A.只有x+1
B.可能是x+8
C.可能是x+2
D.可能是x+1或x+11或x+25
C
D
A
C
B
氮
硫
氯
NH3+H2SO4==(NH4)2SO4
三
ⅥA
5.A、B、C为短周期元素,在周期表中所处位置如
图所示。A、C两元素的原子核外电子数之和等于B
原子的质子数。B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称
、
、
。
(2)B位于元素周期表第
周期,第
族。
(3)写出A的氢化物与B的最高价氧化物对应水化物反应的化学反应方程式
。
本课结束
第一节
元素周期表
第一课时
元素周期表
第一章
物质结构
元素周期律
【考纲要求】
1.了解周期、主族序数和原子结构的关系;
2.了解元素周期表的结构,了解元素周期表周期和族及其应用。
1869年门捷列夫在继承和分析了前人工作的基础上,对大量实验事实进行了订正、分析和概括,成功地对元素进行了科学分类。他总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着相对原子质量的递增而呈现周期性的变化。
他还预言了一些未知元素的性质都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原因。
元素周期表
1.编排原则
原子序数=质子数=核电荷数=核外电子数
类别
周期序数
起止元素
包括元素种数
核外电子层数
短周期
1
H—He
2
1
2
Li—Ne
8
2
3
Na—Ar
8
3
长周期
4
K—Kr
18
4
5
Rb—Xe
18
5
6
Cs—Rn
32
6
7
Fr—118号
32
7
总结:
周期
(7个)
族
(16个)
短周期
长周期
第
1周期
第
2周期
第
6周期
第
3周期
第
5周期
第
4周期
第
7周期
——
2
种
——
8
种
——
8
种
——
18
种
——
18
种
——
32
种
——
26
种
主族
副族
第VIII族
0
族
共
7
个主族,包括短周期和长周期元素
共
7
个副族,只包括在长周期中
包括第8、9、10
纵行
稀有气体元素
七横七周期
,三短和四长
。
十八纵列十六族,七主七副零VIII三
3.元素位置
①周期序数与电子层数的关系:
周期序数=核外电子层数
②主族序数与最外层电子数的关系:
主族序数=最外层电子数
4.常见族名
ⅠA(除H外)称为碱金属元素
ⅡA称为碱土金属元素
ⅣA称为碳族元素
ⅤA称为氮族元素
ⅥA称为氧族元素
ⅦA称为卤族元素
副族和第Ⅷ族全部是金属元素;又称为过渡金属元素
【当堂检测】
1.某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于(
)
A.第二周期
B.第三周期
C.ⅣA族
D.ⅥA族
2.同主族元素原子的核外电子数差值可能为(
)
A.6
B.12
C.26
D.30
AC
C
3.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是
(
)
A.HF
B.H3O+
C.NaH
D.H2O2
4.某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数
(
)
A.只有x+1
B.可能是x+8
C.可能是x+2
D.可能是x+1或x+11或x+25
C
D
A
C
B
氮
硫
氯
NH3+H2SO4==(NH4)2SO4
三
ⅥA
5.A、B、C为短周期元素,在周期表中所处位置如
图所示。A、C两元素的原子核外电子数之和等于B
原子的质子数。B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称
、
、
。
(2)B位于元素周期表第
周期,第
族。
(3)写出A的氢化物与B的最高价氧化物对应水化物反应的化学反应方程式
。
本课结束
