2020-2021学年高一化学1.2.3 元素周期表和元素周期律的应用精编课件(人教版必修二)(共20张ppt)
文档属性
| 名称 | 2020-2021学年高一化学1.2.3 元素周期表和元素周期律的应用精编课件(人教版必修二)(共20张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-18 08:29:14 | ||
图片预览






文档简介
(共20张PPT)
第一章第二节
元素周期律
第三课时
元素周期表和
元素周期律的应用
【考纲要求】
1.掌握元素金属性和非金属性的递变规律.
2.了解元素在周期表中的位置、原子结构及其性质三者之间的关系
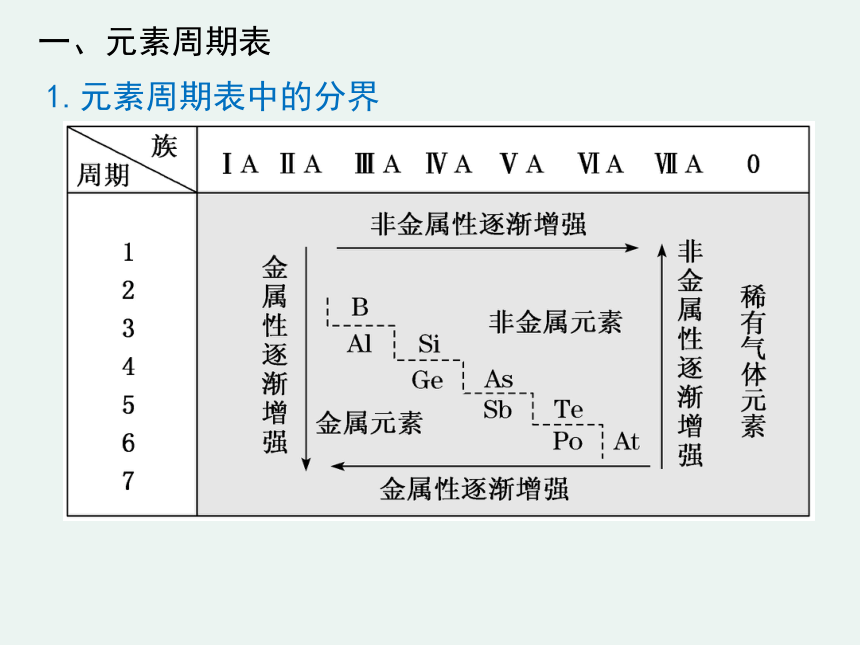
一、元素周期表
1.元素周期表中的分界
铝、锗
硼、硅
金属
非金属
金属
非金属
①从元素周期表的分区中可以看出,非金属性最强的
是F,金属性最强的是Cs(放射性元素除外)。
②金属元素和非金属元素分界线右侧都是非金属,但左侧的并不都是金属元素,如氢元素。
③过渡元素都是金属元素,金属元素只有正价,
没有负价。
④处在金属元素和非金属元素分界线上下的元素单质并不一定是半导体,如Al是导体,B(硼)不导电。
注意
(1)同周期序数差规律
①短周期元素原子序数差=族序数差。
②两元素分布在过渡元素同侧时,
原子序数差=族序数差。
③两元素分布在过渡元素两侧时,
第四或五周期元素原子序数差=族序数差+10;
第六周期元素原子序数差=族序数差+24。
如第ⅡA族与第ⅢA族元素的原子序数之差:
第四、五周期的都为11,第六周期为25。
2.元素周期表中的序数规律
(2)同主族元素的原子序数差的关系
①位于过渡元素左侧的主族元素,即第ⅠA族、第ⅡA族,同主族、邻周期元素原子序数之差为上一周期元素所在周期所含元素种数。如钠、钾的原子序数之差为
19-11=8(钠所在第三周期所含元素的种数)。
②位于过渡元素右侧的主族元素,即第ⅢA~第ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。如氯和溴的原子序数之差为
35-17=18(溴所在第四周期所含元素的种数)。
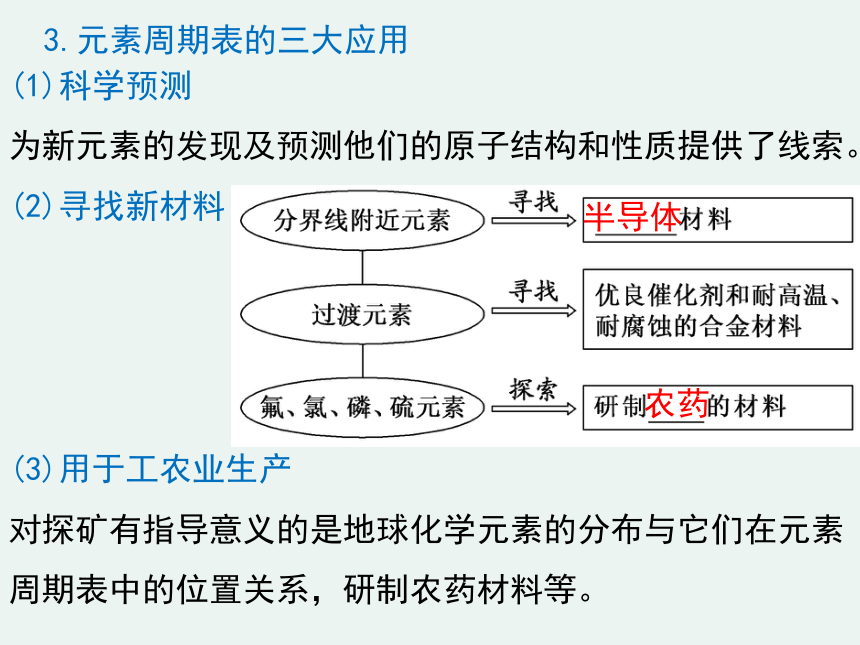
3.元素周期表的三大应用
(1)科学预测
为新元素的发现及预测他们的原子结构和性质提供了线索。
(2)寻找新材料
(3)用于工农业生产
对探矿有指导意义的是地球化学元素的分布与它们在元素周期表中的位置关系,研制农药材料等。
半导体
农药
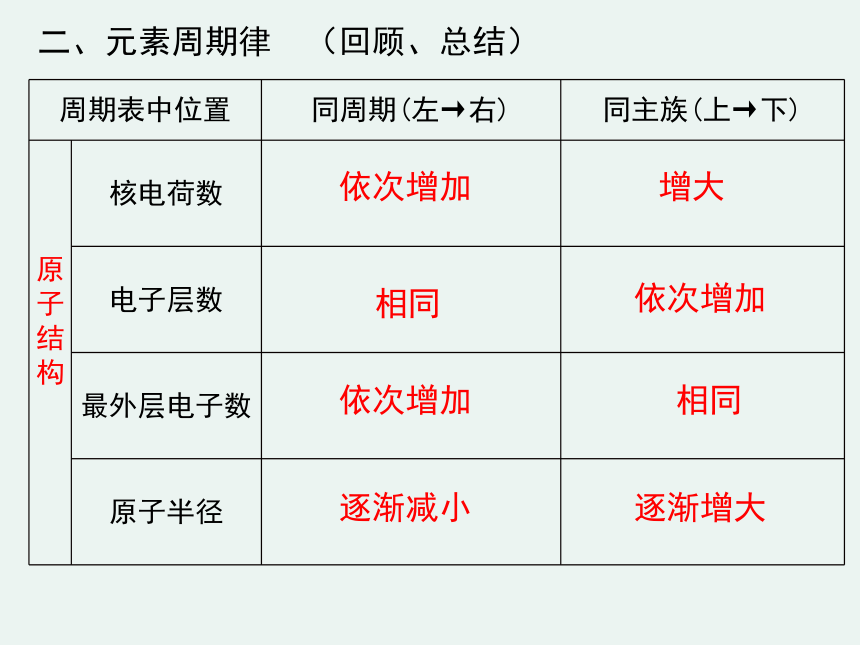
二、元素周期律
(回顾、总结)
周期表中位置
同周期(左→右)
同主族(上→下)
原子结构
核电荷数
电子层数
最外层电子数
原子半径
依次增加
依次增加
依次增加
增大
相同
相同
逐渐减小
逐渐增大
周期表中位置
同周期(左→右)
同主族(上→下)
性质
主要化合价
元素的金属性和非金属性
最高价氧化物对应水化物的酸、碱性
非金属气态氢化物的稳定性
原子得失电子能力
最高正价由+1→7
(O、F除外)
最低负化合价=
-(8-主族序数)
相同,
最高正化合价=主族序数(O、F除外)
金属性减弱
非金属性增强
金属性增强
非金属性减弱
最高价氧化物对应水化物的碱(酸)碱性减弱(酸性增强)
最高价氧化物对应水化物的碱(酸)碱性增强(酸性减弱)
增强
减弱
原子得电子能力增强,
失电子能力减弱
原子得电子能力减弱,
失电子能力增强
三、元素周期表和元素周期律的关系
元素周期表是元素周期律的具体表现形式,
即元素周期表是依据元素周期律而编排出来的。
元素周期表中“位”、“构”、“性”三者的辩证关系
例题1.(2019·金安区模拟)请运用元素周期表的有关理论分析判断,下面几种元素及其化合物性质的推断中正确的是( )
A.铊(Tl)的氧化物的水化物可能具有两性
B.砹(At)为无色固体,HAt不稳定,AgAt具有感光性,且不溶于水
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.H2Se
是无色、有毒、比H2S稳定的气体
C
【解析】
同主族元素从上到下金属性增强,Tl的金属性大于Al的金属性,则铊(Tl)的氧化物的水化物为强碱,故A错误;同主族元素从上到下非金属性减弱,且化合物性质相似,则砹(At)为有色固体,HAt不稳定,AgAt具有感光性,且不溶于水,故B错误;硫酸钡、硫酸钙均不溶于水,则硫酸锶(SrSO4)是难溶于水的白色固体,故C正确;非金属性:S>Se,可知H2Se
是无色、有毒、不如H2S稳定的气体,故D错误。
例题2.(2019·天元区模拟)砷(As)为第四周期第ⅤA族元素,根据元素周期表和元素周期律的知识,下列有关推测不正确的是( )
A.砷有-3、+3、+5等多种化合价
B.原子半径:As>P
C.酸性:H3AsO4>H2SO4
D.热稳定性:HBr>AsH3
C
【解析】
砷为第ⅤA族元素,可以有-3、+3、+5等多种化合价,故A正确;同主族元素从上到下原子半径增大,原子半径:As>P,故B正确;同主族元素从上到下非金属性减弱,非金属性:P>As,则H3AsO4的酸性比H3PO4弱,同周期元素从左到右非金属性增强,H2SO4酸性大于H3PO4,酸性:H3AsO4<H2SO4,故C错误;非金属性:Br>As,热稳定性:HBr>AsH3,故D正确。
例题3.在元素周期表中,某些主族元素与右下方主族元素的有些性质是相似的,被称为“对角线”规则,如:Li和Mg、Be和Al、B和Si。下列说法不正确的是(
)
A.Li在N2中燃烧生成Li3N
B.LiOH是极易溶的强碱
C.Be(OH)2既能溶于强酸又能溶于强碱溶液
D.硼酸钠溶液显碱性
B
【解析】
A.镁在氮气中钠燃烧,则Li在N2中也能燃烧生成Li3N,A正确;
B.氢氧化镁是难溶于水的中强碱,因此LiOH不可能极易溶于水,B错误;
C.氢氧化铝是两性氢氧化物,则Be(OH)2也是两性氢氧化物,既能溶于强酸又能溶于强碱溶液,C正确;
D.硅酸钠溶液显进行,则硼酸钠溶液显碱性,D正确;
例题4.下列有关物质性质的比较正确的是(
)
①同主族元素的单质从上到下,氧化性逐渐减弱,熔点逐渐升高
②元素的非金属性越强,气态氢化物的热稳定性越弱
③单质与水反应的剧烈程度:F2>Cl2>Br2>I2
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2﹣>Se2﹣
⑥酸性:HNO3>H3PO4.
⑦原子半径:K>Cl>S>O>F
A.①③
B.②④⑦
C.③⑥
D.⑤⑥⑦
C
【解析】
①碱金属从上到下熔点降低;而卤族元素的单质从上到下,非金属性逐渐减弱,氧化性逐渐减弱;分子间作用力越来越大,所以熔点逐渐升高,错误;
②非金属性越强,气态氢化物的热稳定性越强,错误;
③非金属性越强,对应单质与水反应越剧烈,则单质与水反应的剧烈程度:F2>Cl2>Br2>I2,正确;
④非金属性越强,最高价氧化物的水化物酸性越强,而不能比较氢化物的酸性,错误;
⑤非金属性S>Se,对应离子的还原性为S2-<Se2-,错误;
⑥非金属性N>P,最高价氧化物的水化物酸性为HNO3>H3PO4,正确;
⑦同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径:K>S>Cl>O>F,错误;
结合以上分析可知,正确的只有③⑥,故答案选C。
本课结束
第一章第二节
元素周期律
第三课时
元素周期表和
元素周期律的应用
【考纲要求】
1.掌握元素金属性和非金属性的递变规律.
2.了解元素在周期表中的位置、原子结构及其性质三者之间的关系
一、元素周期表
1.元素周期表中的分界
铝、锗
硼、硅
金属
非金属
金属
非金属
①从元素周期表的分区中可以看出,非金属性最强的
是F,金属性最强的是Cs(放射性元素除外)。
②金属元素和非金属元素分界线右侧都是非金属,但左侧的并不都是金属元素,如氢元素。
③过渡元素都是金属元素,金属元素只有正价,
没有负价。
④处在金属元素和非金属元素分界线上下的元素单质并不一定是半导体,如Al是导体,B(硼)不导电。
注意
(1)同周期序数差规律
①短周期元素原子序数差=族序数差。
②两元素分布在过渡元素同侧时,
原子序数差=族序数差。
③两元素分布在过渡元素两侧时,
第四或五周期元素原子序数差=族序数差+10;
第六周期元素原子序数差=族序数差+24。
如第ⅡA族与第ⅢA族元素的原子序数之差:
第四、五周期的都为11,第六周期为25。
2.元素周期表中的序数规律
(2)同主族元素的原子序数差的关系
①位于过渡元素左侧的主族元素,即第ⅠA族、第ⅡA族,同主族、邻周期元素原子序数之差为上一周期元素所在周期所含元素种数。如钠、钾的原子序数之差为
19-11=8(钠所在第三周期所含元素的种数)。
②位于过渡元素右侧的主族元素,即第ⅢA~第ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。如氯和溴的原子序数之差为
35-17=18(溴所在第四周期所含元素的种数)。
3.元素周期表的三大应用
(1)科学预测
为新元素的发现及预测他们的原子结构和性质提供了线索。
(2)寻找新材料
(3)用于工农业生产
对探矿有指导意义的是地球化学元素的分布与它们在元素周期表中的位置关系,研制农药材料等。
半导体
农药
二、元素周期律
(回顾、总结)
周期表中位置
同周期(左→右)
同主族(上→下)
原子结构
核电荷数
电子层数
最外层电子数
原子半径
依次增加
依次增加
依次增加
增大
相同
相同
逐渐减小
逐渐增大
周期表中位置
同周期(左→右)
同主族(上→下)
性质
主要化合价
元素的金属性和非金属性
最高价氧化物对应水化物的酸、碱性
非金属气态氢化物的稳定性
原子得失电子能力
最高正价由+1→7
(O、F除外)
最低负化合价=
-(8-主族序数)
相同,
最高正化合价=主族序数(O、F除外)
金属性减弱
非金属性增强
金属性增强
非金属性减弱
最高价氧化物对应水化物的碱(酸)碱性减弱(酸性增强)
最高价氧化物对应水化物的碱(酸)碱性增强(酸性减弱)
增强
减弱
原子得电子能力增强,
失电子能力减弱
原子得电子能力减弱,
失电子能力增强
三、元素周期表和元素周期律的关系
元素周期表是元素周期律的具体表现形式,
即元素周期表是依据元素周期律而编排出来的。
元素周期表中“位”、“构”、“性”三者的辩证关系
例题1.(2019·金安区模拟)请运用元素周期表的有关理论分析判断,下面几种元素及其化合物性质的推断中正确的是( )
A.铊(Tl)的氧化物的水化物可能具有两性
B.砹(At)为无色固体,HAt不稳定,AgAt具有感光性,且不溶于水
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.H2Se
是无色、有毒、比H2S稳定的气体
C
【解析】
同主族元素从上到下金属性增强,Tl的金属性大于Al的金属性,则铊(Tl)的氧化物的水化物为强碱,故A错误;同主族元素从上到下非金属性减弱,且化合物性质相似,则砹(At)为有色固体,HAt不稳定,AgAt具有感光性,且不溶于水,故B错误;硫酸钡、硫酸钙均不溶于水,则硫酸锶(SrSO4)是难溶于水的白色固体,故C正确;非金属性:S>Se,可知H2Se
是无色、有毒、不如H2S稳定的气体,故D错误。
例题2.(2019·天元区模拟)砷(As)为第四周期第ⅤA族元素,根据元素周期表和元素周期律的知识,下列有关推测不正确的是( )
A.砷有-3、+3、+5等多种化合价
B.原子半径:As>P
C.酸性:H3AsO4>H2SO4
D.热稳定性:HBr>AsH3
C
【解析】
砷为第ⅤA族元素,可以有-3、+3、+5等多种化合价,故A正确;同主族元素从上到下原子半径增大,原子半径:As>P,故B正确;同主族元素从上到下非金属性减弱,非金属性:P>As,则H3AsO4的酸性比H3PO4弱,同周期元素从左到右非金属性增强,H2SO4酸性大于H3PO4,酸性:H3AsO4<H2SO4,故C错误;非金属性:Br>As,热稳定性:HBr>AsH3,故D正确。
例题3.在元素周期表中,某些主族元素与右下方主族元素的有些性质是相似的,被称为“对角线”规则,如:Li和Mg、Be和Al、B和Si。下列说法不正确的是(
)
A.Li在N2中燃烧生成Li3N
B.LiOH是极易溶的强碱
C.Be(OH)2既能溶于强酸又能溶于强碱溶液
D.硼酸钠溶液显碱性
B
【解析】
A.镁在氮气中钠燃烧,则Li在N2中也能燃烧生成Li3N,A正确;
B.氢氧化镁是难溶于水的中强碱,因此LiOH不可能极易溶于水,B错误;
C.氢氧化铝是两性氢氧化物,则Be(OH)2也是两性氢氧化物,既能溶于强酸又能溶于强碱溶液,C正确;
D.硅酸钠溶液显进行,则硼酸钠溶液显碱性,D正确;
例题4.下列有关物质性质的比较正确的是(
)
①同主族元素的单质从上到下,氧化性逐渐减弱,熔点逐渐升高
②元素的非金属性越强,气态氢化物的热稳定性越弱
③单质与水反应的剧烈程度:F2>Cl2>Br2>I2
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2﹣>Se2﹣
⑥酸性:HNO3>H3PO4.
⑦原子半径:K>Cl>S>O>F
A.①③
B.②④⑦
C.③⑥
D.⑤⑥⑦
C
【解析】
①碱金属从上到下熔点降低;而卤族元素的单质从上到下,非金属性逐渐减弱,氧化性逐渐减弱;分子间作用力越来越大,所以熔点逐渐升高,错误;
②非金属性越强,气态氢化物的热稳定性越强,错误;
③非金属性越强,对应单质与水反应越剧烈,则单质与水反应的剧烈程度:F2>Cl2>Br2>I2,正确;
④非金属性越强,最高价氧化物的水化物酸性越强,而不能比较氢化物的酸性,错误;
⑤非金属性S>Se,对应离子的还原性为S2-<Se2-,错误;
⑥非金属性N>P,最高价氧化物的水化物酸性为HNO3>H3PO4,正确;
⑦同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径:K>S>Cl>O>F,错误;
结合以上分析可知,正确的只有③⑥,故答案选C。
本课结束
