2020-2021学年高一化学1.3.2 共价键精编课件(人教版必修二)(共20张ppt)
文档属性
| 名称 | 2020-2021学年高一化学1.3.2 共价键精编课件(人教版必修二)(共20张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-18 08:30:05 | ||
图片预览








文档简介
第一章第三节
化学键
第二课时 共价键
【考纲要求】
1.了解共价键的定义和共价键的形成。
2.了解共价化合物的概念,掌握常见共价化合物及分子电子式的书写。
3.了解分子间作用力和氢键及其对物质性质的影响。
共价键的形成
非金属元素之间的成键情况?
双方都不想失去电子。
我是非金属,我很少失电子
我才不会失电子给你
共用电子对
1.定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。
2.成键微粒:原子
3.成键本质:共用电子对
4.成键条件:一般形成于两个非金属原子之间
5.存在:共价键存在于非金属单质的多原子分子中,共价化合物和某些离子化合物中的离子团。
一、共价键
二、共价化合物
1.概念:原子之间通过共用电子对形成的化合物
2.判断:只含有共价键的化合物属于共价化合物(即若存在离子键,一定为离子化合物)
3.常见物质类别:
(1)非金属氧化物
(2)非金属氢化物
(3)酸
(4)绝大部分有机物
三、共价键的表示
1.电子式
用电子式表示共价化合物时,不需要加“[ ]”和标电荷。
如:Cl2的电子式为 ,HCl的电子式为 ,
N2的电子式为 ,CO2的电子式为 。
练习1.写出下列物质的电子式并判断其中存在的化学键:
NH3、NaOH、NH4Cl。
判断电子式是否正确应注意以下几点:
①每个原子周围是否满足了8电子稳定结构(H为2电子稳定结构)
共价化合物中8电子稳定结构的判断规律
ⅰ.对原子序数不大于5的元素,形成化合物时,一般不可能为8电子稳定结构。如HCl中的H,BeCl2中的Be,BF3中的B等。
ⅱ.对原子序数大于5的元素,形成化合物时,
若|元素化合价|+原子最外层电子数=8,
则该化合物中该元素满足8电子稳定结构;否则不满足。
如CO2中的C:|+4|+4=8,满足,O:|-2|+6=8,也满足;PCl5中的P:|+5|+5=10≠8,不满足,Cl:|-1|+7=8,满足。
ⅲ。对于共价单质,方法与上面类似,只是将“|元素的化合价|”换成共用电子对数即可。
②所标的电子总数是否等于所有原子的最外层电子数之和。
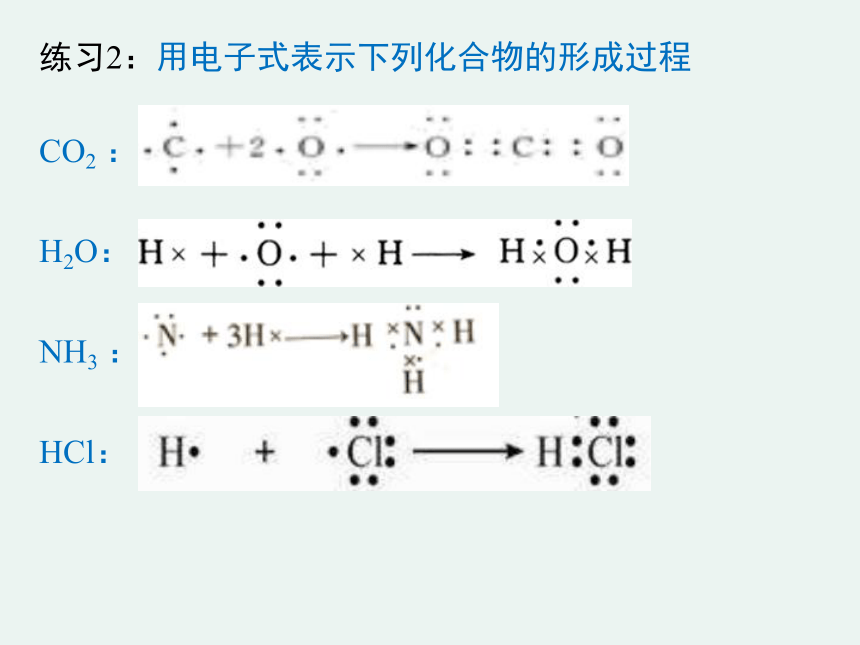
练习2:用电子式表示下列化合物的形成过程
CO2 :
H2O:
NH3 :
HCl:
2.结构式
在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去,这样的式子叫做结构式。如:
化学式
结构式
化学式
结构式
N2
N≡N
CH4
NH3
CO2
O=C=O
HCl
H—Cl
H2O
H—O—H
四、极性键和非极性键
非极性键
极性键
定义
同种元素原子形成的共价键,共用电子对不发生偏移
不同种元素原子形成的共价键,共用电子对发生偏移
原子吸引电子能力
相同
不同
共价键中元素化合价的体现:形成非极性键的原子间共用电子对不偏移,不会产生化合价的升降;而形成极性键的过程中,
电子对偏离的元素化合价升高,电子对偏向的元素化合价降低。
练习3:下列物质中,
(1)F2 (2)O2 (3)NH3 (4)CH4 (5)SO2
以极性键结合的( ),
以非极性键结合的( )
(3)(4)(5)
(1)(2)
离子键
共价键
非极性键
极性键
概念
阴、阳离子通过静电作用所形成的化学键
原子间通过共用电子对(电子云重叠)而形成的化学键
成键
粒子
______________
_____
成键
实质
_____________________
共用电子对不偏向任何一方
共用电子对偏向一方原子
形成
条件
活泼金属元素与活泼非金属元素经电子得失,形成离子键
同种元素原子之间成键
不同种元素原子之间成键
形成的物质
离子化合物
非金属单质;某些共价化合物或离子化合物
共价化合物或离子化合物
对比归纳
五、化学键与化学反应的实质
1.化学键
(1)使离子相结合或原子相结合的作用力。
(2)分类:化学键
2.化学反应的实质:
化学反应的实质是旧化学键的断裂和新化学键的形成。
注意:
①化学反应的本质是旧化学键的断裂和新化学键的形成,只有化学键的断裂,不一定是化学变化,如熔融NaCl。
②物质中不一定都存在化学键,如He等稀有气体分子。
③非金属元素的两个原子之间能形成共价键,但多个非金属元素原子间也可能形成离子键,如NH4Cl。
六、分子间作用力和氢键
1.分子间作用力
熔点
沸点
共价化合物
单质
越大
越高
> > >
2.氢键
稍强
N﹑O﹑F
升高
冰中氢键的存在使冰的结构中有空隙,造成其密度低于液态水。
【跟踪检测】
1.(2020·重庆八中高一月考)下列叙述正确的是( )
A.H2O分子间存在着极性共价键
B.盐酸中存在H+和Cl-,故HCl为离子化合物
C.Na2O2内存在非极性共价键
D.非金属原子只能形成共价键
C
2.(2019·高台县第一中学高一期中)下列各组化合物中,化学键类型完全相同的是:( )
A.HCl 和NaOH
B.Na2O 和Na2O2
C.CO2和 CaO
D.CaCl2和 Na2S
D
3.(2020·河北承德第一中学高一月考)下列分子中所有原子都满足最外层8电子稳定结构的是( )
A.BeCl2 B.CH4 C.BF3 D.PCl3
D
本课结束
化学键
第二课时 共价键
【考纲要求】
1.了解共价键的定义和共价键的形成。
2.了解共价化合物的概念,掌握常见共价化合物及分子电子式的书写。
3.了解分子间作用力和氢键及其对物质性质的影响。
共价键的形成
非金属元素之间的成键情况?
双方都不想失去电子。
我是非金属,我很少失电子
我才不会失电子给你
共用电子对
1.定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。
2.成键微粒:原子
3.成键本质:共用电子对
4.成键条件:一般形成于两个非金属原子之间
5.存在:共价键存在于非金属单质的多原子分子中,共价化合物和某些离子化合物中的离子团。
一、共价键
二、共价化合物
1.概念:原子之间通过共用电子对形成的化合物
2.判断:只含有共价键的化合物属于共价化合物(即若存在离子键,一定为离子化合物)
3.常见物质类别:
(1)非金属氧化物
(2)非金属氢化物
(3)酸
(4)绝大部分有机物
三、共价键的表示
1.电子式
用电子式表示共价化合物时,不需要加“[ ]”和标电荷。
如:Cl2的电子式为 ,HCl的电子式为 ,
N2的电子式为 ,CO2的电子式为 。
练习1.写出下列物质的电子式并判断其中存在的化学键:
NH3、NaOH、NH4Cl。
判断电子式是否正确应注意以下几点:
①每个原子周围是否满足了8电子稳定结构(H为2电子稳定结构)
共价化合物中8电子稳定结构的判断规律
ⅰ.对原子序数不大于5的元素,形成化合物时,一般不可能为8电子稳定结构。如HCl中的H,BeCl2中的Be,BF3中的B等。
ⅱ.对原子序数大于5的元素,形成化合物时,
若|元素化合价|+原子最外层电子数=8,
则该化合物中该元素满足8电子稳定结构;否则不满足。
如CO2中的C:|+4|+4=8,满足,O:|-2|+6=8,也满足;PCl5中的P:|+5|+5=10≠8,不满足,Cl:|-1|+7=8,满足。
ⅲ。对于共价单质,方法与上面类似,只是将“|元素的化合价|”换成共用电子对数即可。
②所标的电子总数是否等于所有原子的最外层电子数之和。
练习2:用电子式表示下列化合物的形成过程
CO2 :
H2O:
NH3 :
HCl:
2.结构式
在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去,这样的式子叫做结构式。如:
化学式
结构式
化学式
结构式
N2
N≡N
CH4
NH3
CO2
O=C=O
HCl
H—Cl
H2O
H—O—H
四、极性键和非极性键
非极性键
极性键
定义
同种元素原子形成的共价键,共用电子对不发生偏移
不同种元素原子形成的共价键,共用电子对发生偏移
原子吸引电子能力
相同
不同
共价键中元素化合价的体现:形成非极性键的原子间共用电子对不偏移,不会产生化合价的升降;而形成极性键的过程中,
电子对偏离的元素化合价升高,电子对偏向的元素化合价降低。
练习3:下列物质中,
(1)F2 (2)O2 (3)NH3 (4)CH4 (5)SO2
以极性键结合的( ),
以非极性键结合的( )
(3)(4)(5)
(1)(2)
离子键
共价键
非极性键
极性键
概念
阴、阳离子通过静电作用所形成的化学键
原子间通过共用电子对(电子云重叠)而形成的化学键
成键
粒子
______________
_____
成键
实质
_____________________
共用电子对不偏向任何一方
共用电子对偏向一方原子
形成
条件
活泼金属元素与活泼非金属元素经电子得失,形成离子键
同种元素原子之间成键
不同种元素原子之间成键
形成的物质
离子化合物
非金属单质;某些共价化合物或离子化合物
共价化合物或离子化合物
对比归纳
五、化学键与化学反应的实质
1.化学键
(1)使离子相结合或原子相结合的作用力。
(2)分类:化学键
2.化学反应的实质:
化学反应的实质是旧化学键的断裂和新化学键的形成。
注意:
①化学反应的本质是旧化学键的断裂和新化学键的形成,只有化学键的断裂,不一定是化学变化,如熔融NaCl。
②物质中不一定都存在化学键,如He等稀有气体分子。
③非金属元素的两个原子之间能形成共价键,但多个非金属元素原子间也可能形成离子键,如NH4Cl。
六、分子间作用力和氢键
1.分子间作用力
熔点
沸点
共价化合物
单质
越大
越高
> > >
2.氢键
稍强
N﹑O﹑F
升高
冰中氢键的存在使冰的结构中有空隙,造成其密度低于液态水。
【跟踪检测】
1.(2020·重庆八中高一月考)下列叙述正确的是( )
A.H2O分子间存在着极性共价键
B.盐酸中存在H+和Cl-,故HCl为离子化合物
C.Na2O2内存在非极性共价键
D.非金属原子只能形成共价键
C
2.(2019·高台县第一中学高一期中)下列各组化合物中,化学键类型完全相同的是:( )
A.HCl 和NaOH
B.Na2O 和Na2O2
C.CO2和 CaO
D.CaCl2和 Na2S
D
3.(2020·河北承德第一中学高一月考)下列分子中所有原子都满足最外层8电子稳定结构的是( )
A.BeCl2 B.CH4 C.BF3 D.PCl3
D
本课结束
