2020-2021学年高一化学2.2.1 原电池原理精编课件(人教版必修二)(共31张ppt)
文档属性
| 名称 | 2020-2021学年高一化学2.2.1 原电池原理精编课件(人教版必修二)(共31张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-18 08:31:13 | ||
图片预览











文档简介
(共31张PPT)
第二章
化学反应与能量
第二节
化学能与电能
第1课时
原电池原理
【考纲要求】
1.了解能源的分类、化学能与电能的相互转化。
2.理解原电池的构成、工作原理及应用。
3.能写出电极反应和总反应方程式。
一.能源分类
1.一次能源:
直接从自然界取得的能源
例如:流水、风力、原油、原煤、太阳能、天然气、天然铀矿等
2.二次能源:
一次能源经过加工转换得到的能源
例如:电力、蒸汽等
水电站,水能是一次能源,
发电所获得的电能是二次能源
水电站
【练习】下列关于能源的说法正确的是(
)
A、电能是二级能源
B、水力是二级能源
C、天然气是一级能源
D、煤气是一级能源
AC
二、化学能与电能的相互转化
1.火力发电的能量转化关系
化学能
热能
机械能
电能
【练习】电力在国民经济及日常生活中占有重要的地位,现阶段我国工农业生产、生活上等的用电主要是(
)产生的
A、火力发电
B、水力发电
C、风力发电
D、核力发电
A
【火力发电原理及过程】
2018年我国电力分产业用电量统计分析、火电、水电、核电、风电发电量分别占比
火电占比仍然为75%
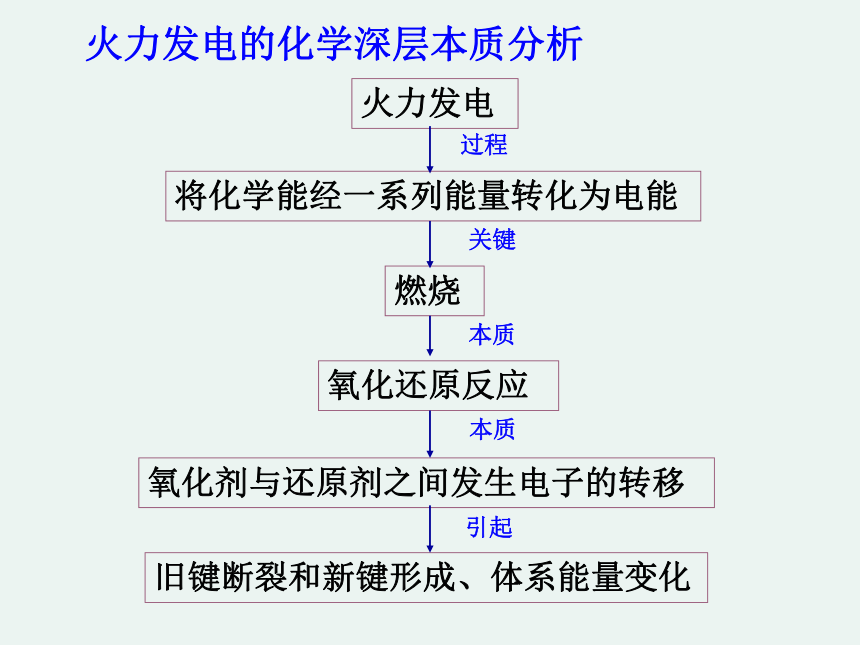
火力发电的化学深层本质分析
燃烧
氧化还原反应
氧化剂与还原剂之间发生电子的转移
火力发电
将化学能经一系列能量转化为电能
旧键断裂和新键形成、体系能量变化
过程
关键
本质
本质
引起
2.原电池原理
原电池是一种
装置。
将化学能转化为电能的
【实验探究】参照实验2-4填写以下表格
现
象
铜
片
锌
片
电流表
铜片上有气泡产生
锌片不断溶解
指针发生偏转
稀H2SO4
Zn
Cu
(1)原电池的电极
负极:发生氧化反应,
电子流出(流向正极)的一极
正极:发生还原反应,
电子流入(来自负极)的一极
【练习】原电池产生电流的本质原因是
(
)
A、原电池中溶液能电离出自由移动的离子
B、有两根导线将两个活动性不同的电极连接
C、电极上进行的氧化还原反应的生成物为电子
D、电极上进行的氧化还原反应中会有电子的转移
D
(2)原电池的工作原理
原电池中电子的流动方向是从
极到
极;
电流方向是从
极到
极。
负
负
正
正
[说明] ①图乙盐桥中通常装有含琼脂的KCl饱和溶液。
②盐桥的作用:使整个装置构成闭合回路,代替两溶液直接接触;平衡电荷;提高电池效率。
电极名称
负极
正极
电极材料
Zn片
Cu片
电极反应
Zn-2e-===Zn2+
Cu2++2e-===Cu
反应类型
氧化反应
还原反应
电子流向
由Zn片沿导线流向Cu片
(3)原电池工作时导电粒子流向
电子流向(外电路):
负极→导线→正极(电流方向与电子流向相反)。
离子流向(内电路):
阴离子向负极移动,阳离子向正极移动。
外电路
内电路
(4)组成原电池的条件
①
自发进行的氧化还原反应
②
活泼性不同的两个电极
③
闭合回路
④
电解质溶液(熔融电解质)
【练习】一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的组成正确的是(
)
【答案】C
A
B
C
D
正极
Zn
Ag
Cu
Cu
负极
Cu
Cu
Zn
Zn
电解质溶液
CuCl2
H2S04
CuSO4
FeCl2
(5)原电池正、负极的判断
【练习】判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)在原电池中,发生氧化反应的一极一定是负极( )
(2)由于CaO+H2O===Ca(OH)2可以放出大量的热,故可把该反应设计成原电池( )
(3)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生( )
(4)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动( )
(5)两种活泼性不同的金属组成原电池的两极,活泼金属一定作负极
( )
(6)原电池原理的应用
①比较金属活动性强弱。一般作负极的金属比作正极的金属活泼。
②金属的防护。使被保护的金属制品作原电池正极而得到保护。
③设计制作化学电源。化学能转化为电能。
④加快化学反应速率。自发进行的氧化还原反应,形成原电池时会使反应速率加快。
【练习】(2020·山西忻州一中高一)将两份过量的锌粉
a、b
分别加入定量的稀硫酸,同时向
a
中加入少量的
CuSO4
溶液,产生H2
的体积
V(L)与时间
t(min)的关系正确的是(
)
A.
B.
C.
D.
【答案】B
三.原电池电极反应式的书写
1.一般电极反应式的书写,以离子方程式形式表示
(1)书写步骤
A.列物质,标得失:按照负极氧化反应,正极还原反应,判断电极反应物、生成物,标出电子得失。
B.看环境,配守恒:电极产物在电解质溶液的环境中应能稳定存在,如酸性介质中,OH-不能存在,应生成水;碱性介质中,H+不能存在,应生成水;电极反应式同样要遵循电荷守恒、原子守恒、得失电子守恒。
C.两式加,验总式:正负极反应式相加,与总反应离子方程式验证。
(2)常见介质
常见介质
注意事项
中性溶液
反应物若是H+得电子或OH-失电子,
则H+或OH-均来自于水的电离
酸性溶液
反应物或生成物中均没有OH-
碱性溶液
反应物或生成物中均没有H+
水溶液
不能出现O2-
2.利用总反应式书写电极反应式
①根据总反应式找出
氧化剂、还原剂、氧化产物和还原产物
②确定介质的酸碱性或者其它特性。
③书写电极反应式。
负极反应:还原剂-ne-=氧化产物
正极反应:氧化剂+ne-=还原产物
④书写技巧:若某电极反应式较难写出时,可先写出较易写的电极反应式,然后根据得失电子守恒,用总反应式减去较易写的电极反应式,即可得出较难写的电极反应式。
【练习】Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( )
A.负极反应式为Mg-2e-===Mg2+
B.正极反应式为Ag++e-===Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑
解析:
Mg—AgCl电池的电极反应:负极Mg-2e-=Mg2+,正极2AgCl+2e-=2Ag+2Cl-,A项正确,B项错误;在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极,C项正确;Mg是活泼金属,能和H2O发生反应生成Mg(OH)2和H2,D项正确。
B
1.(2020·福建省仙游县枫亭中学高二期中)下列关于原电池的叙述中错误的是(
)
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.原电池放电时,电流的方向是从正极到负极
【答案】A
2.(2020·广东华南师大附中高三专题练习)下图各装置中,溶液均为稀硫酸,不能构成原电池的是(
)
A.
B.
C.
D.
【答案】D
3.(2019·河南高二学业考试)右图为铜锌原电池示意图,下列说法中正确的是
(
)
A.锌片逐渐溶解
B.烧杯中溶液逐渐呈蓝色
C.电子由铜片通过导线流向锌片
D.该装置能够将电能转化为化学能
【答案】A
4.(2020·山西忻州一中高一)如图:电流计的指针会偏转,M极变粗,N极变细符合这种现象的是(
)
A.M是铜,N是锌,R是硫酸溶液
B.M是锌,N是铜,R是硫酸铜溶液
C.M是银,N是锌,R是硝酸银溶液
D.M是铁,N是铜,R是硝酸铜溶液
【答案】C
5.(2020·山西忻州一中高一)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是(
)
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S=6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
【答案】B
6.(2019·湖南省长沙县第九中学高一期末)四中某学习小组依据氧化还原反应原理:2Ag++Cu=Cu2++2Ag设计成的原电池如右图所示。
(1)
从能量转化角度分析,上述原电池将
化学能转化为_________
;
(2)
负极的电极材料为_____________;
(3)
正极发生的电极反应______________;
(4)
假设反应初两电极质量相等,当反应进行到一段时间后(AgNO3溶液足量),取出两电极洗净干燥后称量,测得两电极质量差为11.2
g,则该时间内原电池反应转移的电子数为__________。(设NA表示阿伏加德罗常数的值)
【答案】(1)电能
(2)Cu
(或铜)
(3)Ag+
+
e-
=
Ag
(4)0.08NA
本课结束
第二章
化学反应与能量
第二节
化学能与电能
第1课时
原电池原理
【考纲要求】
1.了解能源的分类、化学能与电能的相互转化。
2.理解原电池的构成、工作原理及应用。
3.能写出电极反应和总反应方程式。
一.能源分类
1.一次能源:
直接从自然界取得的能源
例如:流水、风力、原油、原煤、太阳能、天然气、天然铀矿等
2.二次能源:
一次能源经过加工转换得到的能源
例如:电力、蒸汽等
水电站,水能是一次能源,
发电所获得的电能是二次能源
水电站
【练习】下列关于能源的说法正确的是(
)
A、电能是二级能源
B、水力是二级能源
C、天然气是一级能源
D、煤气是一级能源
AC
二、化学能与电能的相互转化
1.火力发电的能量转化关系
化学能
热能
机械能
电能
【练习】电力在国民经济及日常生活中占有重要的地位,现阶段我国工农业生产、生活上等的用电主要是(
)产生的
A、火力发电
B、水力发电
C、风力发电
D、核力发电
A
【火力发电原理及过程】
2018年我国电力分产业用电量统计分析、火电、水电、核电、风电发电量分别占比
火电占比仍然为75%
火力发电的化学深层本质分析
燃烧
氧化还原反应
氧化剂与还原剂之间发生电子的转移
火力发电
将化学能经一系列能量转化为电能
旧键断裂和新键形成、体系能量变化
过程
关键
本质
本质
引起
2.原电池原理
原电池是一种
装置。
将化学能转化为电能的
【实验探究】参照实验2-4填写以下表格
现
象
铜
片
锌
片
电流表
铜片上有气泡产生
锌片不断溶解
指针发生偏转
稀H2SO4
Zn
Cu
(1)原电池的电极
负极:发生氧化反应,
电子流出(流向正极)的一极
正极:发生还原反应,
电子流入(来自负极)的一极
【练习】原电池产生电流的本质原因是
(
)
A、原电池中溶液能电离出自由移动的离子
B、有两根导线将两个活动性不同的电极连接
C、电极上进行的氧化还原反应的生成物为电子
D、电极上进行的氧化还原反应中会有电子的转移
D
(2)原电池的工作原理
原电池中电子的流动方向是从
极到
极;
电流方向是从
极到
极。
负
负
正
正
[说明] ①图乙盐桥中通常装有含琼脂的KCl饱和溶液。
②盐桥的作用:使整个装置构成闭合回路,代替两溶液直接接触;平衡电荷;提高电池效率。
电极名称
负极
正极
电极材料
Zn片
Cu片
电极反应
Zn-2e-===Zn2+
Cu2++2e-===Cu
反应类型
氧化反应
还原反应
电子流向
由Zn片沿导线流向Cu片
(3)原电池工作时导电粒子流向
电子流向(外电路):
负极→导线→正极(电流方向与电子流向相反)。
离子流向(内电路):
阴离子向负极移动,阳离子向正极移动。
外电路
内电路
(4)组成原电池的条件
①
自发进行的氧化还原反应
②
活泼性不同的两个电极
③
闭合回路
④
电解质溶液(熔融电解质)
【练习】一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的组成正确的是(
)
【答案】C
A
B
C
D
正极
Zn
Ag
Cu
Cu
负极
Cu
Cu
Zn
Zn
电解质溶液
CuCl2
H2S04
CuSO4
FeCl2
(5)原电池正、负极的判断
【练习】判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)在原电池中,发生氧化反应的一极一定是负极( )
(2)由于CaO+H2O===Ca(OH)2可以放出大量的热,故可把该反应设计成原电池( )
(3)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生( )
(4)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动( )
(5)两种活泼性不同的金属组成原电池的两极,活泼金属一定作负极
( )
(6)原电池原理的应用
①比较金属活动性强弱。一般作负极的金属比作正极的金属活泼。
②金属的防护。使被保护的金属制品作原电池正极而得到保护。
③设计制作化学电源。化学能转化为电能。
④加快化学反应速率。自发进行的氧化还原反应,形成原电池时会使反应速率加快。
【练习】(2020·山西忻州一中高一)将两份过量的锌粉
a、b
分别加入定量的稀硫酸,同时向
a
中加入少量的
CuSO4
溶液,产生H2
的体积
V(L)与时间
t(min)的关系正确的是(
)
A.
B.
C.
D.
【答案】B
三.原电池电极反应式的书写
1.一般电极反应式的书写,以离子方程式形式表示
(1)书写步骤
A.列物质,标得失:按照负极氧化反应,正极还原反应,判断电极反应物、生成物,标出电子得失。
B.看环境,配守恒:电极产物在电解质溶液的环境中应能稳定存在,如酸性介质中,OH-不能存在,应生成水;碱性介质中,H+不能存在,应生成水;电极反应式同样要遵循电荷守恒、原子守恒、得失电子守恒。
C.两式加,验总式:正负极反应式相加,与总反应离子方程式验证。
(2)常见介质
常见介质
注意事项
中性溶液
反应物若是H+得电子或OH-失电子,
则H+或OH-均来自于水的电离
酸性溶液
反应物或生成物中均没有OH-
碱性溶液
反应物或生成物中均没有H+
水溶液
不能出现O2-
2.利用总反应式书写电极反应式
①根据总反应式找出
氧化剂、还原剂、氧化产物和还原产物
②确定介质的酸碱性或者其它特性。
③书写电极反应式。
负极反应:还原剂-ne-=氧化产物
正极反应:氧化剂+ne-=还原产物
④书写技巧:若某电极反应式较难写出时,可先写出较易写的电极反应式,然后根据得失电子守恒,用总反应式减去较易写的电极反应式,即可得出较难写的电极反应式。
【练习】Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( )
A.负极反应式为Mg-2e-===Mg2+
B.正极反应式为Ag++e-===Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑
解析:
Mg—AgCl电池的电极反应:负极Mg-2e-=Mg2+,正极2AgCl+2e-=2Ag+2Cl-,A项正确,B项错误;在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极,C项正确;Mg是活泼金属,能和H2O发生反应生成Mg(OH)2和H2,D项正确。
B
1.(2020·福建省仙游县枫亭中学高二期中)下列关于原电池的叙述中错误的是(
)
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.原电池放电时,电流的方向是从正极到负极
【答案】A
2.(2020·广东华南师大附中高三专题练习)下图各装置中,溶液均为稀硫酸,不能构成原电池的是(
)
A.
B.
C.
D.
【答案】D
3.(2019·河南高二学业考试)右图为铜锌原电池示意图,下列说法中正确的是
(
)
A.锌片逐渐溶解
B.烧杯中溶液逐渐呈蓝色
C.电子由铜片通过导线流向锌片
D.该装置能够将电能转化为化学能
【答案】A
4.(2020·山西忻州一中高一)如图:电流计的指针会偏转,M极变粗,N极变细符合这种现象的是(
)
A.M是铜,N是锌,R是硫酸溶液
B.M是锌,N是铜,R是硫酸铜溶液
C.M是银,N是锌,R是硝酸银溶液
D.M是铁,N是铜,R是硝酸铜溶液
【答案】C
5.(2020·山西忻州一中高一)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是(
)
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S=6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
【答案】B
6.(2019·湖南省长沙县第九中学高一期末)四中某学习小组依据氧化还原反应原理:2Ag++Cu=Cu2++2Ag设计成的原电池如右图所示。
(1)
从能量转化角度分析,上述原电池将
化学能转化为_________
;
(2)
负极的电极材料为_____________;
(3)
正极发生的电极反应______________;
(4)
假设反应初两电极质量相等,当反应进行到一段时间后(AgNO3溶液足量),取出两电极洗净干燥后称量,测得两电极质量差为11.2
g,则该时间内原电池反应转移的电子数为__________。(设NA表示阿伏加德罗常数的值)
【答案】(1)电能
(2)Cu
(或铜)
(3)Ag+
+
e-
=
Ag
(4)0.08NA
本课结束
