2020-2021学年高一化学2.3.2 化学反应的限度精编课件(人教版必修二)(共27张ppt)
文档属性
| 名称 | 2020-2021学年高一化学2.3.2 化学反应的限度精编课件(人教版必修二)(共27张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-18 08:32:01 | ||
图片预览





文档简介
(共27张PPT)
第三节
化学反应的速率和限度
第二课时
化学反应的限度
第二章
化学反应与能量
【考纲要求】
1.了解化学反应的可逆性及化学平衡的建立。
2.掌握化学平衡的特征及判断。
炼铁高炉尾气之谜
C+O2==CO2
C+CO2==2CO
Fe2O3+3CO==2Fe+3CO2
高温
教材:炼制1t生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,且从高炉炉顶出来的气体中含有没有利用的CO气体。
可逆反应
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
高温
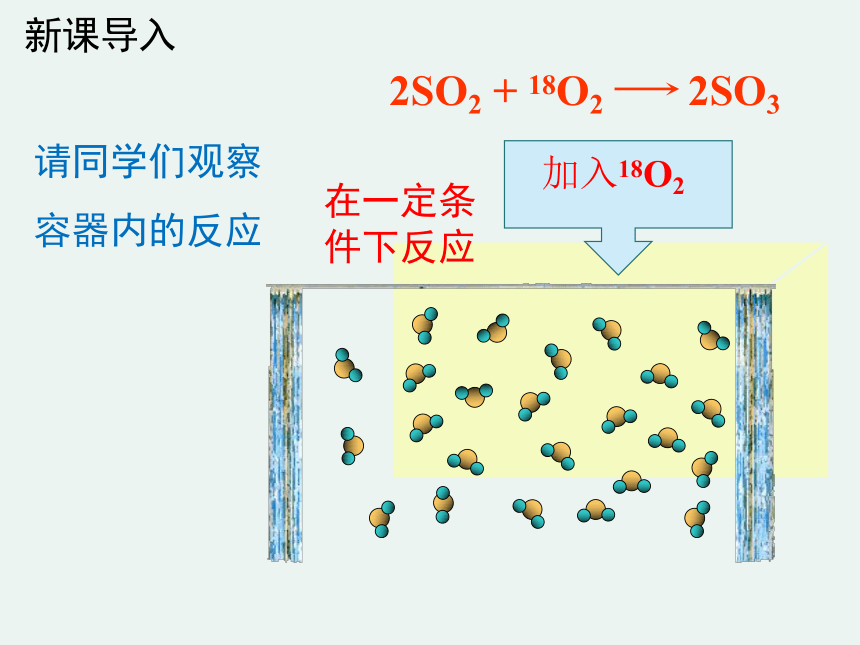
新课导入
2SO2
+
18O2
2SO3
新课导入
请同学们观察容器内的反应
加入18O2
在一定条件下反应
2SO2
+
18O2
2SO3
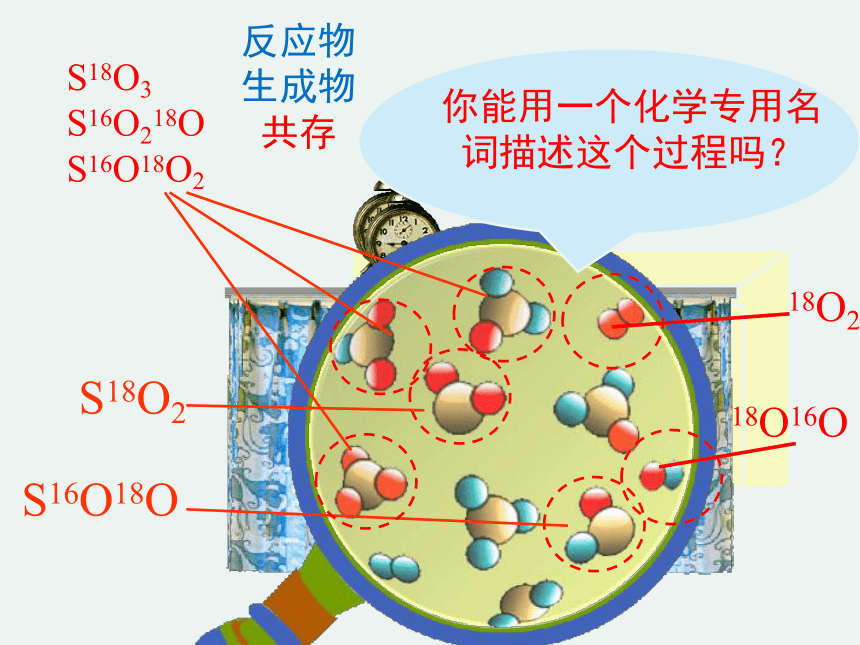
S18O2
S16O18O
你能用一个化学专用名词描述这个过程吗?
18O2
18O16O
S18O3
S16O218O
S16O18O2
反应物生成物共存
一.可逆反应
1.概念:在相同条件下,既能向
,同时又能向
的反应。
2.特征:三同:
,
,
;
反应不能进行完全,
即任一反应物的转化率均
100%。
3.表示:化学方程式中用
表示。
正反应方向进行
正反应方向进行
相同条件
正逆反应同时进行
反应物、生成物同时存在
小于
?
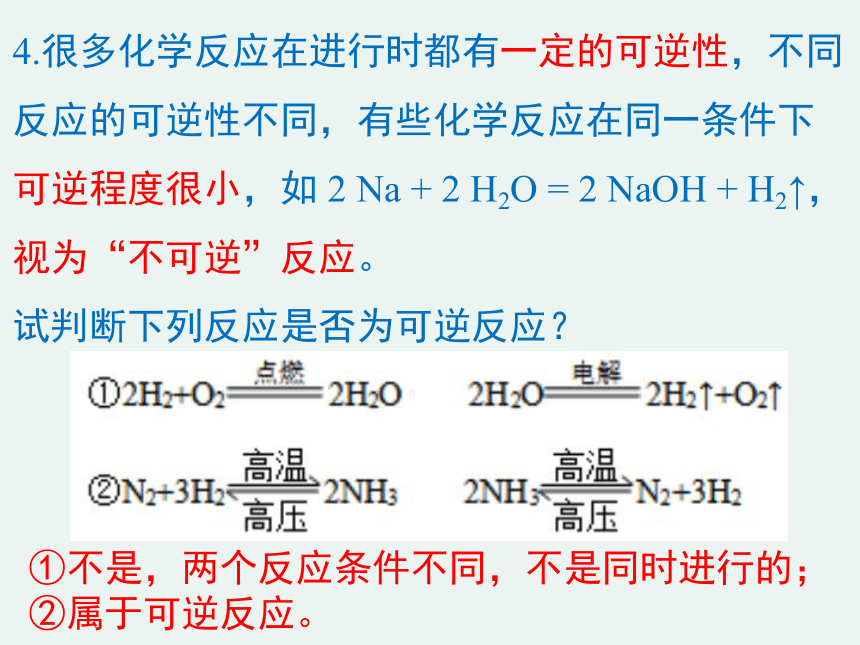
4.很多化学反应在进行时都有一定的可逆性,不同反应的可逆性不同,有些化学反应在同一条件下可逆程度很小,如
2
Na
+
2
H2O
=
2
NaOH
+
H2↑,
视为“不可逆”反应。
试判断下列反应是否为可逆反应?
①不是,两个反应条件不同,不是同时进行的;②属于可逆反应。
典型的可逆反应有:
H2+I2?2HI
,
2SO2+O2?2SO3
,
SO2+H2O?H2SO3
,NH3+H2O?NH3﹒H2O
等。
例题1.在密闭容器中进行反应X+2Y?2Z,已知反应中起始浓度分别为X、Y、Z,在一定条件下,当反应达到化学平衡时,各物质的浓度可能是(
)
A.X为0.20mol/L
B.Y为0.50mol/L
C.Z为0.35mol/L
D.Y为0.10mol/L
【答案】C
二.化学反应的限度
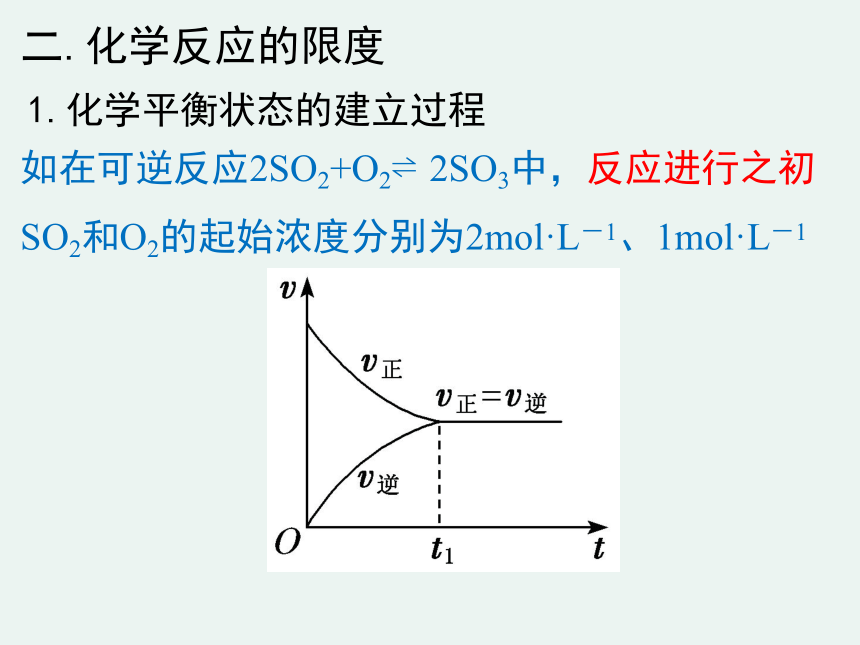
1.化学平衡状态的建立过程
如在可逆反应2SO2+O2?2SO3中,反应进行之初SO2和O2的起始浓度分别为2mol·L-1、1mol·L-1
反应刚开始时,
正反应速率v正最大,逆反应速率v逆为零。
反应过程中,
反应物浓度逐渐减小,正反应速率逐渐减小;生成物浓度逐渐增大,逆反应速率逐渐增大。
最终在时刻t时,反应物浓度不再改变,生成物浓度不再改变。正反应速率和逆反应速率相等。
反应是否停止?反应并没有停止,动态平衡。
2.化学平衡状态的含义
可逆反应在一定条件下进行到一定程度时,正反应速率与逆反应速率相等,反应物和生产物的浓度不在改变,此反应达到一种表面静止状态,我们称为化学平衡状态。
化学平衡状态是可逆反应的一种特殊状态,是反应在一定条件下所能达到或完成的最大程度,即该反应的限度。化学反应的限度决定了反应在该条件下的最大转化率。
3.化学平衡状态的特征
可逆
动态
相等
v正=v逆≠0
4.化学平衡状态的判断方法—“两看”“两标志”
(1)“两看”
一看
题干条件
恒温恒容或恒温恒压或绝热容器
二看
化学反应特点(物质状态、气体计量系数)
全部是气体参与,是等体积反应还是
非等体积反应
有固体或液体参与,是等体积反应还是非等体积反应
(2)“两标志”
正、逆反应速率相等
同一物质表示的正、逆反应速率相等v正=v逆,或者不同物质表示的正、逆速率(或变化的物质的量、浓度)之比等于化学计量数之比
变量
不变
题目中的变量,指的是随着反应的进行而改变的量,(如某物质的质量、浓度、百分含量,n总(气体)、压强、气体密度、气体平均分子质量、颜色等),当“变量”不再变化(保持恒定)时,证明可逆反应达到平衡,但“定量”无法证明。
例题2.(2020·广东华南师大附中高三专题练习)可逆反应达化学平衡时,下列说法不正确的是
(
)
A.正反应速率等于逆反应速率
B.不再继续反应
C.混合物的各成分的百分含量不变
D.同时存在反应物和生成物
【答案】B
例题3.(2020·山东高二期末)一定条件下,a
L密闭容器中放入1molN2和3molH2发生N2+3H2?2NH3的反应,下列选项中能说明反应已达到平衡状态的是(
)
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.2v(H2)=3v(NH3)
C.单位时间内1个N≡N键断裂同时,有6个N-H键断裂
D.单位时间消耗0.1molN2的同时,生成0.2molNH3
【答案】C
三.化学反应条件的控制
(一)
在生产和生活中,人们希望促进有利的化学反应(提高反应物的转化率即原料的利用率,加快反应速率等),抑制有害的化学反应(减缓反应速率,减少甚至消除有害物质的产生,控制副反应的发生等),即通过控制化学反应的条件,使反应向着我们有利的方向进行。
案例分析:如何提高煤的燃烧效率?
1.煤的状态与煤燃烧的速率有何关系?与煤的充分燃烧有何关系?
固体表面积增大,反应速率加快,能使煤燃烧更充分。
2.空气用量对煤的充分燃烧及热能利用有什么影响?原因是什么?
空气过少,煤不能充分燃烧;空气过多,会带走热量,热量散失增多。
3.应选择什么样的炉(灶)膛材料?理由是什么?
选择隔热保温耐热效果好的,减少热量散失。
4.如何充分利用煤燃烧后烟道废气中的热量?
回收热量,产生蒸汽,转化为动能;循环冷却水,居民供暖。
(二)基本措施
①改变化学反应速率:
改变反应体系的温度、物质的浓度、气体的压强、固体的表面积以及催化剂的合理使用等。
②改变可逆反应进行的限度:
改变可逆反应体系的温度、物质的浓度、气体的压强等。
四、有关化学平衡的简单计算
规律总结:解答有关化学反应速率和化学平衡的计算题时,一般需要写出化学方程式,列出起始量、变化量及平衡量,再根据题设其他条件和定律列方程求解。
如:
m
A(g)+n
B(g)
p
C(g)+q
D(g)
起始/mol
a
b
0
0
转化/mol
mx
nx
px
qx
平衡/mol
a-mx
b-nx
px
qx
(1)关于反应物转化率的计算
A的转化率=
×100%
(2)关于某组分平衡时的体积分数的计算
A的体积分数=
×100%
例题4.(2019·四川三台中学实验学校高二开学考试)在一定温度时,将1molA和2molB放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)?C(g)+2D(g),经5min后达到平衡,测得容器内B物质的浓度减少了0.2mol·L-1。下列叙述不正确的是(
)
A.在5min内该反应用C的浓度变化表示的反应速率
0.02mol·L-1·min-1
B.平衡时B的体积分数为33.3%
C.初始压强和平衡时压强比为4:5
D.平衡时B的转化率为50%
B
1.(2019·武汉质检)对于可逆反应2SO2+O2?2SO3
ΔH<0,在混合气体中充入一定量的
18O2,经足够长的时间后,下列有关说法中正确的是(
)
A.18O只存在于O2中
B.18O只存在于O2和SO3中
C.某个二氧化硫分子的相对分子质量可能为66
D.三氧化硫的相对分子质量均为82
【答案】C
2.下列说法中不正确的是(
)
A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等
C.可以通过控制反应条件,使2
mol
SO2与1
mol
O2反应生成2
mol
SO3
D.化学反应的限度可以通过改变条件来改变
【答案】C
3.对于可逆反应M
+
3N?2Q达到平衡时,下列说法正确的是(
)
A.M、N、Q三种物质的浓度一定相等
B.M、N全部变成了Q
C.反应混合物各组分的浓度不再变化
D.反应已经停止
【答案】C
4.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)
=
5v逆(NO)
B.若单位时间内生成x
mol
NO的同时,消耗x
mol
NH3,
则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率
减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)
=
3v正(H2O)
【答案】A
本课结束
第三节
化学反应的速率和限度
第二课时
化学反应的限度
第二章
化学反应与能量
【考纲要求】
1.了解化学反应的可逆性及化学平衡的建立。
2.掌握化学平衡的特征及判断。
炼铁高炉尾气之谜
C+O2==CO2
C+CO2==2CO
Fe2O3+3CO==2Fe+3CO2
高温
教材:炼制1t生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,且从高炉炉顶出来的气体中含有没有利用的CO气体。
可逆反应
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
高温
新课导入
2SO2
+
18O2
2SO3
新课导入
请同学们观察容器内的反应
加入18O2
在一定条件下反应
2SO2
+
18O2
2SO3
S18O2
S16O18O
你能用一个化学专用名词描述这个过程吗?
18O2
18O16O
S18O3
S16O218O
S16O18O2
反应物生成物共存
一.可逆反应
1.概念:在相同条件下,既能向
,同时又能向
的反应。
2.特征:三同:
,
,
;
反应不能进行完全,
即任一反应物的转化率均
100%。
3.表示:化学方程式中用
表示。
正反应方向进行
正反应方向进行
相同条件
正逆反应同时进行
反应物、生成物同时存在
小于
?
4.很多化学反应在进行时都有一定的可逆性,不同反应的可逆性不同,有些化学反应在同一条件下可逆程度很小,如
2
Na
+
2
H2O
=
2
NaOH
+
H2↑,
视为“不可逆”反应。
试判断下列反应是否为可逆反应?
①不是,两个反应条件不同,不是同时进行的;②属于可逆反应。
典型的可逆反应有:
H2+I2?2HI
,
2SO2+O2?2SO3
,
SO2+H2O?H2SO3
,NH3+H2O?NH3﹒H2O
等。
例题1.在密闭容器中进行反应X+2Y?2Z,已知反应中起始浓度分别为X、Y、Z,在一定条件下,当反应达到化学平衡时,各物质的浓度可能是(
)
A.X为0.20mol/L
B.Y为0.50mol/L
C.Z为0.35mol/L
D.Y为0.10mol/L
【答案】C
二.化学反应的限度
1.化学平衡状态的建立过程
如在可逆反应2SO2+O2?2SO3中,反应进行之初SO2和O2的起始浓度分别为2mol·L-1、1mol·L-1
反应刚开始时,
正反应速率v正最大,逆反应速率v逆为零。
反应过程中,
反应物浓度逐渐减小,正反应速率逐渐减小;生成物浓度逐渐增大,逆反应速率逐渐增大。
最终在时刻t时,反应物浓度不再改变,生成物浓度不再改变。正反应速率和逆反应速率相等。
反应是否停止?反应并没有停止,动态平衡。
2.化学平衡状态的含义
可逆反应在一定条件下进行到一定程度时,正反应速率与逆反应速率相等,反应物和生产物的浓度不在改变,此反应达到一种表面静止状态,我们称为化学平衡状态。
化学平衡状态是可逆反应的一种特殊状态,是反应在一定条件下所能达到或完成的最大程度,即该反应的限度。化学反应的限度决定了反应在该条件下的最大转化率。
3.化学平衡状态的特征
可逆
动态
相等
v正=v逆≠0
4.化学平衡状态的判断方法—“两看”“两标志”
(1)“两看”
一看
题干条件
恒温恒容或恒温恒压或绝热容器
二看
化学反应特点(物质状态、气体计量系数)
全部是气体参与,是等体积反应还是
非等体积反应
有固体或液体参与,是等体积反应还是非等体积反应
(2)“两标志”
正、逆反应速率相等
同一物质表示的正、逆反应速率相等v正=v逆,或者不同物质表示的正、逆速率(或变化的物质的量、浓度)之比等于化学计量数之比
变量
不变
题目中的变量,指的是随着反应的进行而改变的量,(如某物质的质量、浓度、百分含量,n总(气体)、压强、气体密度、气体平均分子质量、颜色等),当“变量”不再变化(保持恒定)时,证明可逆反应达到平衡,但“定量”无法证明。
例题2.(2020·广东华南师大附中高三专题练习)可逆反应达化学平衡时,下列说法不正确的是
(
)
A.正反应速率等于逆反应速率
B.不再继续反应
C.混合物的各成分的百分含量不变
D.同时存在反应物和生成物
【答案】B
例题3.(2020·山东高二期末)一定条件下,a
L密闭容器中放入1molN2和3molH2发生N2+3H2?2NH3的反应,下列选项中能说明反应已达到平衡状态的是(
)
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.2v(H2)=3v(NH3)
C.单位时间内1个N≡N键断裂同时,有6个N-H键断裂
D.单位时间消耗0.1molN2的同时,生成0.2molNH3
【答案】C
三.化学反应条件的控制
(一)
在生产和生活中,人们希望促进有利的化学反应(提高反应物的转化率即原料的利用率,加快反应速率等),抑制有害的化学反应(减缓反应速率,减少甚至消除有害物质的产生,控制副反应的发生等),即通过控制化学反应的条件,使反应向着我们有利的方向进行。
案例分析:如何提高煤的燃烧效率?
1.煤的状态与煤燃烧的速率有何关系?与煤的充分燃烧有何关系?
固体表面积增大,反应速率加快,能使煤燃烧更充分。
2.空气用量对煤的充分燃烧及热能利用有什么影响?原因是什么?
空气过少,煤不能充分燃烧;空气过多,会带走热量,热量散失增多。
3.应选择什么样的炉(灶)膛材料?理由是什么?
选择隔热保温耐热效果好的,减少热量散失。
4.如何充分利用煤燃烧后烟道废气中的热量?
回收热量,产生蒸汽,转化为动能;循环冷却水,居民供暖。
(二)基本措施
①改变化学反应速率:
改变反应体系的温度、物质的浓度、气体的压强、固体的表面积以及催化剂的合理使用等。
②改变可逆反应进行的限度:
改变可逆反应体系的温度、物质的浓度、气体的压强等。
四、有关化学平衡的简单计算
规律总结:解答有关化学反应速率和化学平衡的计算题时,一般需要写出化学方程式,列出起始量、变化量及平衡量,再根据题设其他条件和定律列方程求解。
如:
m
A(g)+n
B(g)
p
C(g)+q
D(g)
起始/mol
a
b
0
0
转化/mol
mx
nx
px
qx
平衡/mol
a-mx
b-nx
px
qx
(1)关于反应物转化率的计算
A的转化率=
×100%
(2)关于某组分平衡时的体积分数的计算
A的体积分数=
×100%
例题4.(2019·四川三台中学实验学校高二开学考试)在一定温度时,将1molA和2molB放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)?C(g)+2D(g),经5min后达到平衡,测得容器内B物质的浓度减少了0.2mol·L-1。下列叙述不正确的是(
)
A.在5min内该反应用C的浓度变化表示的反应速率
0.02mol·L-1·min-1
B.平衡时B的体积分数为33.3%
C.初始压强和平衡时压强比为4:5
D.平衡时B的转化率为50%
B
1.(2019·武汉质检)对于可逆反应2SO2+O2?2SO3
ΔH<0,在混合气体中充入一定量的
18O2,经足够长的时间后,下列有关说法中正确的是(
)
A.18O只存在于O2中
B.18O只存在于O2和SO3中
C.某个二氧化硫分子的相对分子质量可能为66
D.三氧化硫的相对分子质量均为82
【答案】C
2.下列说法中不正确的是(
)
A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等
C.可以通过控制反应条件,使2
mol
SO2与1
mol
O2反应生成2
mol
SO3
D.化学反应的限度可以通过改变条件来改变
【答案】C
3.对于可逆反应M
+
3N?2Q达到平衡时,下列说法正确的是(
)
A.M、N、Q三种物质的浓度一定相等
B.M、N全部变成了Q
C.反应混合物各组分的浓度不再变化
D.反应已经停止
【答案】C
4.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)
=
5v逆(NO)
B.若单位时间内生成x
mol
NO的同时,消耗x
mol
NH3,
则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率
减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)
=
3v正(H2O)
【答案】A
本课结束
