2020-2021学年高一化学2.2.2 化学电源精编课件(人教版必修二)(共31张ppt)
文档属性
| 名称 | 2020-2021学年高一化学2.2.2 化学电源精编课件(人教版必修二)(共31张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-18 00:00:00 | ||
图片预览








文档简介
(共31张PPT)
第二章 化学反应与能量
第二节 化学能与电能 第2课时 化学电源
【考纲要求】
1.了解常见化学电源的种类及其工作原理。
2.掌握常见燃料电池工作原理及电极反应式书写。
电池
将化学能转换成
电能的装置
将太阳能转换成电能的装置
将放射性同位素自然衰变时
产生的热能通过热能转换器
转变为电能的装置
化学电池
太阳能电池
原子能电池
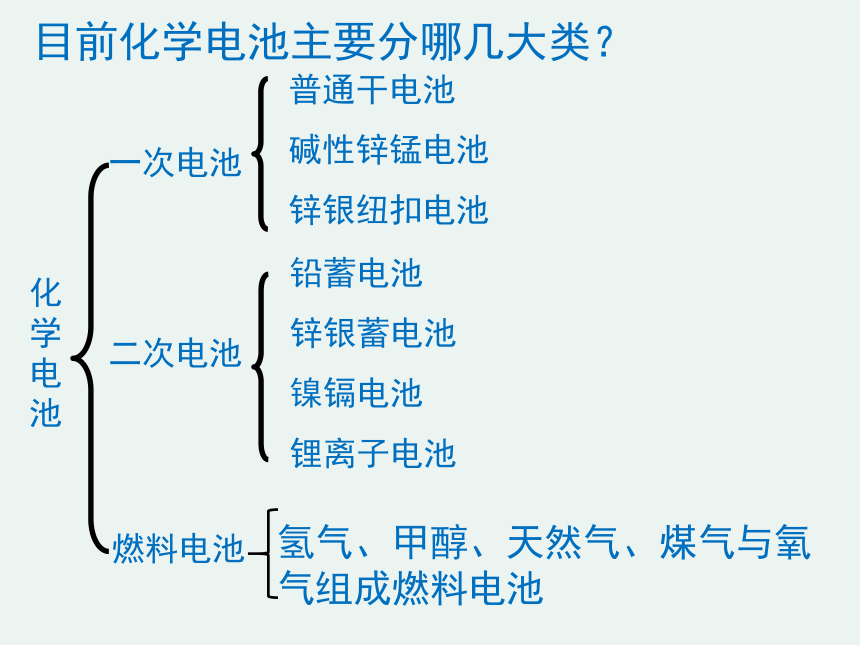
化学电池
一次电池
二次电池
燃料电池
氢气、甲醇、天然气、煤气与氧气组成燃料电池
铅蓄电池
锌银蓄电池
镍镉电池
锂离子电池
普通干电池
碱性锌锰电池
锌银纽扣电池
目前化学电池主要分哪几大类?
普通锌锰干电池、碱性锌锰干电池、锌银电池(钮扣电池)等。
一.一次电池
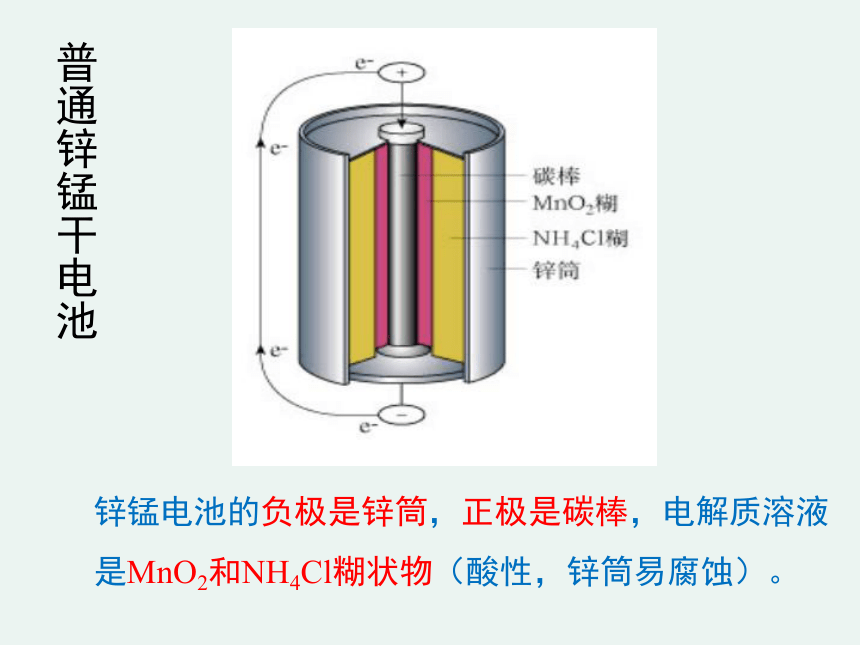
锌锰电池的负极是锌筒,正极是碳棒,电解质溶液 是MnO2和NH4Cl糊状物(酸性,锌筒易腐蚀)。
普通锌锰干电池
电极反应式:
负极:Zn - 2e-=Zn2+ ( 氧化反应)
正极:2MnO2 + 2NH4++ 2e- =Mn2O3+2NH3 +H2O
总反应:
Zn+2MnO2 + 2NH4Cl =
ZnCl2+Mn2O3+2NH3+H2O
体积小、性能好的碱性锌-锰干电池应运而生。这类电池的重要特征是电解液由原来的中性变为离子导电性更好的碱性,负极也由锌片改为锌粉,反应面积成倍增长,使放电电流大幅度提高。
碱性锌锰干电池
碱性锌锰电池
锌粉和KOH混合物
MnO2
金属外壳
负极(Zn):Zn - 2e- + 2OH- = Zn(OH)2
正极(MnO2):2MnO2+2e-+2H2O =2MnO(OH)+2OH-
电池总反应:
Zn+2MnO2+2H2O=Zn(OH)2 +2MnO(OH)
正极:Ag2O + H2O+ 2e- ==2Ag+2OH-
负极:Zn +2OH- _2e- ==Zn(OH)2
总反应:Zn+Ag2O+H2O==Zn(OH)2+2Ag
锌银纽扣电池
练习:锌-锰碱性电池以氢氧化钾溶液为电解液,总反应式为:
Zn s +2MnO2 s +H2O l =Zn OH 2 s +Mn2O3 s
下列说法错误的是( )
A 电池工作时,锌失去电子
B 电池工作时,电子由正极通过外电路流向负极
C 电池正极电极反应式为:
2MnO2 s +H2O l +2e =2MnO(OH) s +2OH aq
D 外电路中每通过0 2mol电子,锌的质量理论上减小6 5g
B
既可充电又可放电。如:铅蓄电池、手机锂电池等。
二.二次电池
铅蓄电池
正极材料上涂有棕褐色的PbO2,负极材料是海绵状的金属铅,两极浸在H2SO4溶液中。写出电极反应式。
正极:PbO2
负极:Pb
电解质:H2SO4溶液
铅蓄电池为典型的可充电电池,
其电极反应分为放电和充电两个过程。
放电过程总反应:
Pb(s)+PbO2(s)+2H2SO4(aq)==2PbSO4(s)+2H2O(l)
Pb(s) + SO42- (aq)-2e- ==PbSO4 (s)
正极:
PbO2(s) + 4H+(aq)+SO42- (aq)+2e- ==2PbSO4 (s) +2H2O(l)
氧化反应
还原反应
负极:
①放电过程
PbSO4 (s) +2e- ==Pb(s) + SO42- (aq)
阴极:
阳极:
2PbSO4 (s)+2H2O(l) -2e- == PbO2(s) + 4H+(aq) + SO42-(aq)
充电过程总反应:
2PbSO4(s)+2H2O(l)==Pb(s)+PbO2(s)+2H2SO4(aq)
②充电过程
氧化反应
还原反应
接电源负极
接电源正极
铅蓄电池的充放电过程:
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
放电
充电
练习:氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是: H2+NiO(OH)2 Ni(OH)2+H2O 。根据此
反应式判断,下列叙述中正确的是( ) A.电池放电时,H2是负极 B.电池放电时,氢元素被氧化 C.电池充电时,镍元素被还原 D.电池充电时,化学能转化为电能
放电
充电
A
练习:银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为: 在此电池放电时,负极上发生反应的物质是 ( ) A.Ag B.Zn(OH)2 C.Ag2O D.Zn
充电
2Ag + Zn(OH)2 Ag2O + Zn + H2O
放电
D
三.燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
氢氧燃料电池
1、电池材料
正极室:通氧气
负极室:通氢气
电解质:H2SO4溶液
(氧化剂)
(燃料)
使用铂电极
2、工作原理
总反应:2H2 + O2 = 2H2O
负极:2H2 - 4e- = 2H+
正极:O2 + 4H+ +4e- = 2H2O
介质 电池反应:2H2 +O2 == 2H2O
酸性 负极
正极
中性 负极
正极
碱性 负极
正极
氢氧燃料电池
2H2 - 4e- == 4H+
O2 + 4H+ + 4e-== 2H2O
2H2 - 4e- == 4H+
O2 + 2H2O + 4e-== 4OH-
2H2 +4OH-- 4e- == 4H2O
O2 + 2H2O + 4e-== 4OH-
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出;
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
缺点:体积较大、附属设备较多
优点:能量转换率高、清洁、对环境好
其它燃料电池:烃、肼、甲醇、氨、煤气燃料电池……
1. 燃料电池的规律:
2. 燃料电池与前几种电池的差别:
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
练习:氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
,
此时电池内总的反应式
。
KOH溶液
CH4
O2
H2O
a b
CH4+10OH- - 8e-==CO32- +7H2O
CH4+2O2+2KOH==K2CO3+3H2O
1.电池中含有大量的重金属、酸、碱等物质。
2.一粒小小的钮扣电池可污染600立方米水,相当于一个人一生的饮水量;一节一号电池烂在地里,能使一平方米的土地失去利用价值,并造成永久性公害。
四.电池的污染与回收
3.电池的回收
废旧电池中的有色金属是宝贵的自然资源,如果能回收再利用这些废旧电池,不仅可以减少对我们生存环境的破坏,而且也是对资源的节约。
防止重金属离子污染环境如Hg2+,Cd2+
回收利用有色金属,节约资源
1.(2020·包头市第六中学高二期中)下列说法中不正确的是( )
A.充电电池不能无限制地反复充电、放电
B.燃料电池是一种高效且对环境友好的新型电池
C.化学电池的反应原理是自发的氧化还原反应
D.铅蓄电池和锌锰干电池都是可充电电池
【答案】D
2.(2020·山东省高二月考)由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。如图是氢氧燃料电池驱动LED发光的装置。
【答案】B
①a处通入的气体是氢气,b处通入的气体是氧气;
②该装置中只涉及两种形式的能量变化;
③电池正极的电极反应式为O2+2H2O+4e-=4OH-;
④P型半导体连接的是电池负极。上述说法中正确的是
A.①② B.①③ C.③④ D.②④
3.(2018·湖南省高二学业考试)下图为氢氧燃料电池装置示意图,下列有关说法正确的是( )
A.电极A为正极
B.产物为水,
属于环境友好电池
C.电子流向:
电极B→导线→电极A
D.该电池的化学能可以100%转化为电能
【答案】B
4.(2020·安徽省高二期末)研究人员研制出一种新型储备电源-锂水电池(结构如图,高硅铸铁为惰性辅助电极),使用时加入水即可放电。下列关于该电池工作时的说法正确的是
A.高硅铸铁发生氧化反应
B.OH-向高硅铸铁电极移动
C.负极的电极反应式为Li-e-=Li+
D.电流的方向:锂电极→导线→高硅铸铁电极
【答案】C
本课结束
第二章 化学反应与能量
第二节 化学能与电能 第2课时 化学电源
【考纲要求】
1.了解常见化学电源的种类及其工作原理。
2.掌握常见燃料电池工作原理及电极反应式书写。
电池
将化学能转换成
电能的装置
将太阳能转换成电能的装置
将放射性同位素自然衰变时
产生的热能通过热能转换器
转变为电能的装置
化学电池
太阳能电池
原子能电池
化学电池
一次电池
二次电池
燃料电池
氢气、甲醇、天然气、煤气与氧气组成燃料电池
铅蓄电池
锌银蓄电池
镍镉电池
锂离子电池
普通干电池
碱性锌锰电池
锌银纽扣电池
目前化学电池主要分哪几大类?
普通锌锰干电池、碱性锌锰干电池、锌银电池(钮扣电池)等。
一.一次电池
锌锰电池的负极是锌筒,正极是碳棒,电解质溶液 是MnO2和NH4Cl糊状物(酸性,锌筒易腐蚀)。
普通锌锰干电池
电极反应式:
负极:Zn - 2e-=Zn2+ ( 氧化反应)
正极:2MnO2 + 2NH4++ 2e- =Mn2O3+2NH3 +H2O
总反应:
Zn+2MnO2 + 2NH4Cl =
ZnCl2+Mn2O3+2NH3+H2O
体积小、性能好的碱性锌-锰干电池应运而生。这类电池的重要特征是电解液由原来的中性变为离子导电性更好的碱性,负极也由锌片改为锌粉,反应面积成倍增长,使放电电流大幅度提高。
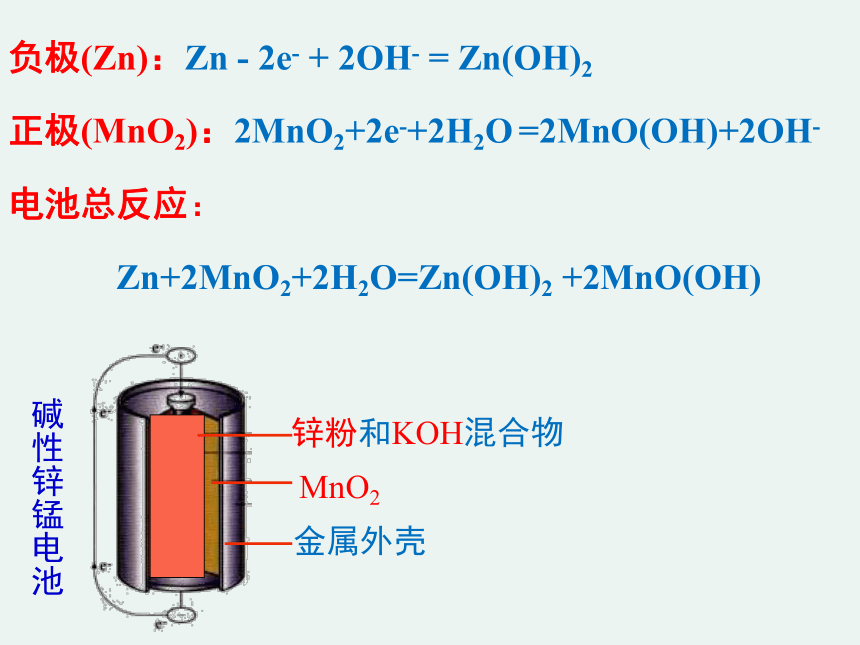
碱性锌锰干电池
碱性锌锰电池
锌粉和KOH混合物
MnO2
金属外壳
负极(Zn):Zn - 2e- + 2OH- = Zn(OH)2
正极(MnO2):2MnO2+2e-+2H2O =2MnO(OH)+2OH-
电池总反应:
Zn+2MnO2+2H2O=Zn(OH)2 +2MnO(OH)
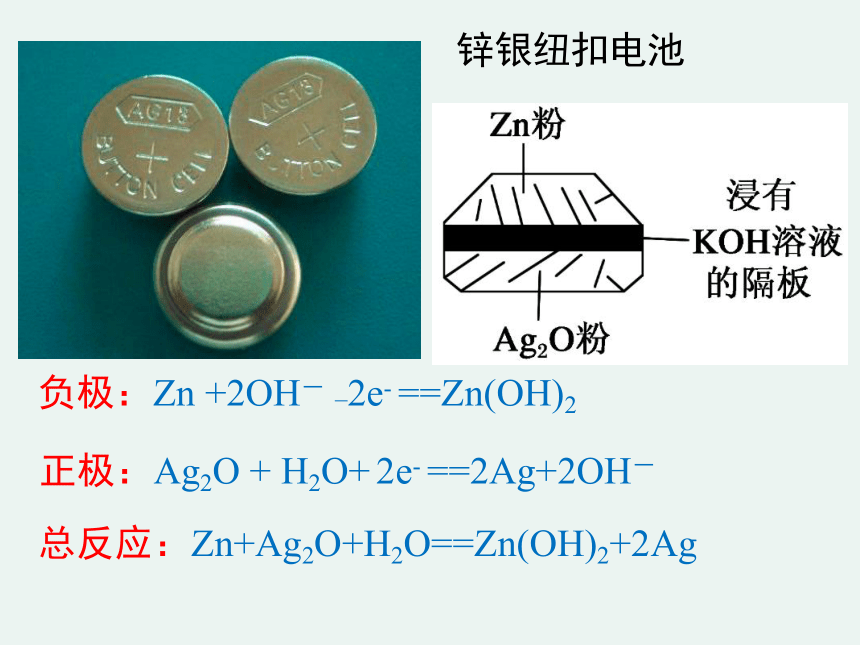
正极:Ag2O + H2O+ 2e- ==2Ag+2OH-
负极:Zn +2OH- _2e- ==Zn(OH)2
总反应:Zn+Ag2O+H2O==Zn(OH)2+2Ag
锌银纽扣电池
练习:锌-锰碱性电池以氢氧化钾溶液为电解液,总反应式为:
Zn s +2MnO2 s +H2O l =Zn OH 2 s +Mn2O3 s
下列说法错误的是( )
A 电池工作时,锌失去电子
B 电池工作时,电子由正极通过外电路流向负极
C 电池正极电极反应式为:
2MnO2 s +H2O l +2e =2MnO(OH) s +2OH aq
D 外电路中每通过0 2mol电子,锌的质量理论上减小6 5g
B
既可充电又可放电。如:铅蓄电池、手机锂电池等。
二.二次电池
铅蓄电池
正极材料上涂有棕褐色的PbO2,负极材料是海绵状的金属铅,两极浸在H2SO4溶液中。写出电极反应式。
正极:PbO2
负极:Pb
电解质:H2SO4溶液
铅蓄电池为典型的可充电电池,
其电极反应分为放电和充电两个过程。
放电过程总反应:
Pb(s)+PbO2(s)+2H2SO4(aq)==2PbSO4(s)+2H2O(l)
Pb(s) + SO42- (aq)-2e- ==PbSO4 (s)
正极:
PbO2(s) + 4H+(aq)+SO42- (aq)+2e- ==2PbSO4 (s) +2H2O(l)
氧化反应
还原反应
负极:
①放电过程
PbSO4 (s) +2e- ==Pb(s) + SO42- (aq)
阴极:
阳极:
2PbSO4 (s)+2H2O(l) -2e- == PbO2(s) + 4H+(aq) + SO42-(aq)
充电过程总反应:
2PbSO4(s)+2H2O(l)==Pb(s)+PbO2(s)+2H2SO4(aq)
②充电过程
氧化反应
还原反应
接电源负极
接电源正极
铅蓄电池的充放电过程:
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
放电
充电
练习:氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是: H2+NiO(OH)2 Ni(OH)2+H2O 。根据此
反应式判断,下列叙述中正确的是( ) A.电池放电时,H2是负极 B.电池放电时,氢元素被氧化 C.电池充电时,镍元素被还原 D.电池充电时,化学能转化为电能
放电
充电
A
练习:银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为: 在此电池放电时,负极上发生反应的物质是 ( ) A.Ag B.Zn(OH)2 C.Ag2O D.Zn
充电
2Ag + Zn(OH)2 Ag2O + Zn + H2O
放电
D
三.燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
氢氧燃料电池
1、电池材料
正极室:通氧气
负极室:通氢气
电解质:H2SO4溶液
(氧化剂)
(燃料)
使用铂电极
2、工作原理
总反应:2H2 + O2 = 2H2O
负极:2H2 - 4e- = 2H+
正极:O2 + 4H+ +4e- = 2H2O
介质 电池反应:2H2 +O2 == 2H2O
酸性 负极
正极
中性 负极
正极
碱性 负极
正极
氢氧燃料电池
2H2 - 4e- == 4H+
O2 + 4H+ + 4e-== 2H2O
2H2 - 4e- == 4H+
O2 + 2H2O + 4e-== 4OH-
2H2 +4OH-- 4e- == 4H2O
O2 + 2H2O + 4e-== 4OH-
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出;
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
缺点:体积较大、附属设备较多
优点:能量转换率高、清洁、对环境好
其它燃料电池:烃、肼、甲醇、氨、煤气燃料电池……
1. 燃料电池的规律:
2. 燃料电池与前几种电池的差别:
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
练习:氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
,
此时电池内总的反应式
。
KOH溶液
CH4
O2
H2O
a b
CH4+10OH- - 8e-==CO32- +7H2O
CH4+2O2+2KOH==K2CO3+3H2O
1.电池中含有大量的重金属、酸、碱等物质。
2.一粒小小的钮扣电池可污染600立方米水,相当于一个人一生的饮水量;一节一号电池烂在地里,能使一平方米的土地失去利用价值,并造成永久性公害。
四.电池的污染与回收
3.电池的回收
废旧电池中的有色金属是宝贵的自然资源,如果能回收再利用这些废旧电池,不仅可以减少对我们生存环境的破坏,而且也是对资源的节约。
防止重金属离子污染环境如Hg2+,Cd2+
回收利用有色金属,节约资源
1.(2020·包头市第六中学高二期中)下列说法中不正确的是( )
A.充电电池不能无限制地反复充电、放电
B.燃料电池是一种高效且对环境友好的新型电池
C.化学电池的反应原理是自发的氧化还原反应
D.铅蓄电池和锌锰干电池都是可充电电池
【答案】D
2.(2020·山东省高二月考)由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。如图是氢氧燃料电池驱动LED发光的装置。
【答案】B
①a处通入的气体是氢气,b处通入的气体是氧气;
②该装置中只涉及两种形式的能量变化;
③电池正极的电极反应式为O2+2H2O+4e-=4OH-;
④P型半导体连接的是电池负极。上述说法中正确的是
A.①② B.①③ C.③④ D.②④
3.(2018·湖南省高二学业考试)下图为氢氧燃料电池装置示意图,下列有关说法正确的是( )
A.电极A为正极
B.产物为水,
属于环境友好电池
C.电子流向:
电极B→导线→电极A
D.该电池的化学能可以100%转化为电能
【答案】B
4.(2020·安徽省高二期末)研究人员研制出一种新型储备电源-锂水电池(结构如图,高硅铸铁为惰性辅助电极),使用时加入水即可放电。下列关于该电池工作时的说法正确的是
A.高硅铸铁发生氧化反应
B.OH-向高硅铸铁电极移动
C.负极的电极反应式为Li-e-=Li+
D.电流的方向:锂电极→导线→高硅铸铁电极
【答案】C
本课结束
