2020-2021学年高一化学3.3.2 乙酸精编课件(人教版必修二)(共19张ppt)
文档属性
| 名称 | 2020-2021学年高一化学3.3.2 乙酸精编课件(人教版必修二)(共19张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-18 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
第三节
生活中常见的两种有机物
第二课时
乙酸
第三章
有机化合物
【考纲要求】
1.了解乙酸的组成、结构、性质及其重要应用。
2.了解酯化反应及反应过程中的化合键变化,了解酯的结构和性质及应用。
相传古代的时候醋是酒圣杜康的儿子黑塔发明的。杜康发明了酒,他儿子黑塔在作坊里提水、搬缸什么都干,慢慢也学会了酿酒技术。后来,黑塔酿酒后觉得酒糟扔掉可惜,就存放起来,在缸里浸泡。到了二十一日的酉时,一开缸,一股从来没有闻过的香气扑鼻而来。
在浓郁的香味诱惑下,黑塔尝了一口,酸甜兼备,味道很美,便贮藏着作为“调味浆”。黑塔把二十一日加“酉”字来命名这种调料叫“醋”。
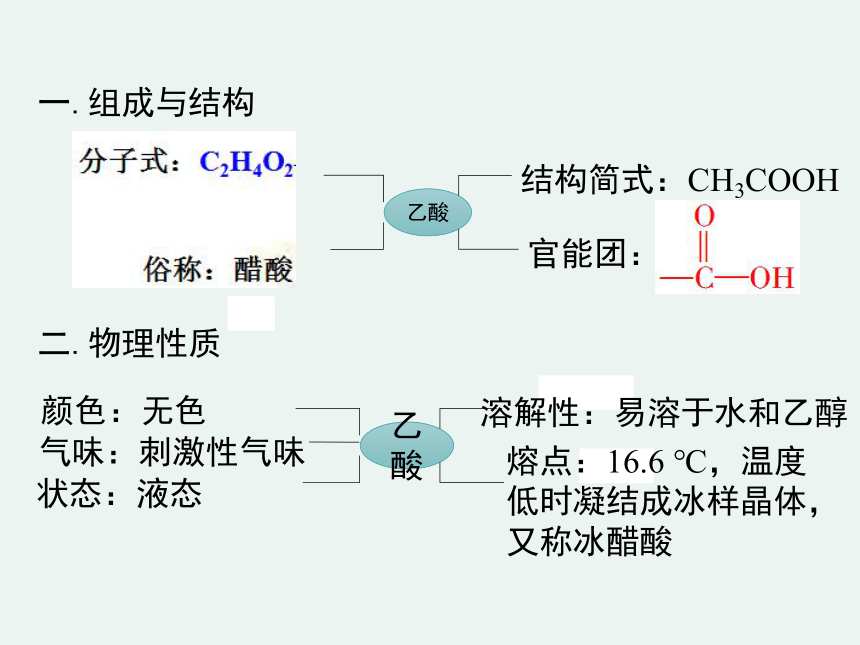
一.组成与结构
二.物理性质
乙酸
结构简式:CH3COOH
官能团:
乙酸
溶解性:易溶于水和乙醇
熔点:16.6
℃,温度低时凝结成冰样晶体,又称冰醋酸
颜色:无色
气味:刺激性气味
状态:液态
[练习1]关于乙酸的下列说法中,不正确的是
(
)
A.乙酸是具有强烈刺激性气味的液体
B.乙酸分子里含有4个氢原子,所以乙酸不是
一元酸
C.无水乙酸又称冰醋酸,它是纯净物
D.乙酸易溶于水和乙醇
【答案】B
三.化学性质
①遇酸碱指示剂变色;
②与活泼金属反应产生H2:
③与碱性氧化物反应生成盐和水:
④与碱发生中和反应:
⑤与盐发生复分解反应:
CaCO3+2CH3COOH→Ca(CH3COO)2+CO2↑+H2O
2CH3COOH+2Na→2CH3COONa+H2↑
2CH3COOH+CaO→Ca(CH3COO)2+H2O
CH3COOH+NaOH→CH3COONa+H2O
1.酸性
碳酸钠固体
乙酸溶液
澄清石灰水
Na2CO3+2CH3COOH
2CH3COONa+CO2↑+H2O
酸性:
乙酸>碳酸
比较装置的优缺点、并写出反应的化学方程式
澄清石灰水
2.乙酸乙酯的制备
药品:
实验装置
反应物混合方法:
向试管中依次加入:
乙醇、浓硫酸、乙酸
乙醇、乙酸、浓硫酸、饱和Na2CO3溶液
饱和Na2CO3溶液的作用:
1)由于乙酸乙酯的沸点比乙酸、乙醇都低,因此
从反应物中不断蒸出乙酸乙酯可提高其产率。
2)使用过量的乙醇,可提高乙酸转化为乙酸乙酯的产率。
根据化学平衡原理,提高乙酸乙酯产率的措施有:
3)使用浓H2SO4作吸水剂,提高乙醇、乙酸的转化率。
18
O
CH3—C—OH
+H—O—C2H5
18
O
CH3—C—O—C2H5+H2O
浓H2SO4
a.反应机理:酸脱羟基,醇脱氢
b.酯化反应可看作是取代反应,也可看作是分子间脱水的反应。
酯化反应机理
[练习2]写出乙酸与甲醇反应的化学方程式:
[练习3]除去乙酸乙酯中残留的乙酸,有效的处理方法是
(??
)
A.蒸馏
B?.水洗后分液
C
.用过量饱和碳酸钠溶液洗涤后分液
?
D
.用过量氯化钠溶液洗涤后分液
【答案】C
CH3COOH+CH3OH
CH3COOCH3+H2O
浓H2SO4
四.酯
1.酯
羧酸分子羧基中的
—OH
被-OR'取代后的产物称为酯,
简写为RCOOR',结构式为
R—C—O—R'
官能团为
酯基
—C—O—
2.物理性质
低级酯密度比水小
,难溶于水,易溶于有机溶剂,具有芳香气味。
3.用途
(1)用作香料,例如
饮料、糖果、化妆品中的香料
(2)用作溶剂,例如
指甲油、胶水的溶剂
O
O
4.化学性质
1.下列说法错误的是(
)
A.乙醇和乙酸都是常用调味品的主要成分
B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的
沸点和熔点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸之间能发生酯化反应,加入过量
的乙醇充分反应后,乙酸全部反应生成酯
【答案】D
2.关于乙酸的叙述不正确的是( )
A.可与乙醇反应
B.能溶解鸡蛋壳
C.食醋中含有乙酸
D.为一种无色无味的液体
【答案】D
3.(2019·郑州高一检测)下列关于乙酸性质的叙述中,错误的是(
)
A.乙酸的酸性比碳酸强,所以它可以跟碳酸盐
溶液反应,产生CO2气体
B.乙酸具有氧化性,能跟钠反应放出H2
C.乙酸分子中含有碳氧双键,所以它能使溴水
褪色
D.当温度低于16.6
℃时,乙酸凝结成冰状晶体
【答案】C
4.1?丁醇(CH3CH2CH2CH2OH)和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描述错误的是( )
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.1?丁醇和乙酸能反应完或
者其中一种能消耗完
D.为了提高反应速率,所以要加
入浓硫酸作催化剂并加热
【答案】C
5.巴豆酸的结构简式为CH3—CH===CH—COOH。现有①氯化氢、②溴水、③纯碱溶液、④乙醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是(
)
A.只有②④⑤
B.只有①③④
C.只有①②③④
D.全部
【答案】D
本课结束
第三节
生活中常见的两种有机物
第二课时
乙酸
第三章
有机化合物
【考纲要求】
1.了解乙酸的组成、结构、性质及其重要应用。
2.了解酯化反应及反应过程中的化合键变化,了解酯的结构和性质及应用。
相传古代的时候醋是酒圣杜康的儿子黑塔发明的。杜康发明了酒,他儿子黑塔在作坊里提水、搬缸什么都干,慢慢也学会了酿酒技术。后来,黑塔酿酒后觉得酒糟扔掉可惜,就存放起来,在缸里浸泡。到了二十一日的酉时,一开缸,一股从来没有闻过的香气扑鼻而来。
在浓郁的香味诱惑下,黑塔尝了一口,酸甜兼备,味道很美,便贮藏着作为“调味浆”。黑塔把二十一日加“酉”字来命名这种调料叫“醋”。
一.组成与结构
二.物理性质
乙酸
结构简式:CH3COOH
官能团:
乙酸
溶解性:易溶于水和乙醇
熔点:16.6
℃,温度低时凝结成冰样晶体,又称冰醋酸
颜色:无色
气味:刺激性气味
状态:液态
[练习1]关于乙酸的下列说法中,不正确的是
(
)
A.乙酸是具有强烈刺激性气味的液体
B.乙酸分子里含有4个氢原子,所以乙酸不是
一元酸
C.无水乙酸又称冰醋酸,它是纯净物
D.乙酸易溶于水和乙醇
【答案】B
三.化学性质
①遇酸碱指示剂变色;
②与活泼金属反应产生H2:
③与碱性氧化物反应生成盐和水:
④与碱发生中和反应:
⑤与盐发生复分解反应:
CaCO3+2CH3COOH→Ca(CH3COO)2+CO2↑+H2O
2CH3COOH+2Na→2CH3COONa+H2↑
2CH3COOH+CaO→Ca(CH3COO)2+H2O
CH3COOH+NaOH→CH3COONa+H2O
1.酸性
碳酸钠固体
乙酸溶液
澄清石灰水
Na2CO3+2CH3COOH
2CH3COONa+CO2↑+H2O
酸性:
乙酸>碳酸
比较装置的优缺点、并写出反应的化学方程式
澄清石灰水
2.乙酸乙酯的制备
药品:
实验装置
反应物混合方法:
向试管中依次加入:
乙醇、浓硫酸、乙酸
乙醇、乙酸、浓硫酸、饱和Na2CO3溶液
饱和Na2CO3溶液的作用:
1)由于乙酸乙酯的沸点比乙酸、乙醇都低,因此
从反应物中不断蒸出乙酸乙酯可提高其产率。
2)使用过量的乙醇,可提高乙酸转化为乙酸乙酯的产率。
根据化学平衡原理,提高乙酸乙酯产率的措施有:
3)使用浓H2SO4作吸水剂,提高乙醇、乙酸的转化率。
18
O
CH3—C—OH
+H—O—C2H5
18
O
CH3—C—O—C2H5+H2O
浓H2SO4
a.反应机理:酸脱羟基,醇脱氢
b.酯化反应可看作是取代反应,也可看作是分子间脱水的反应。
酯化反应机理
[练习2]写出乙酸与甲醇反应的化学方程式:
[练习3]除去乙酸乙酯中残留的乙酸,有效的处理方法是
(??
)
A.蒸馏
B?.水洗后分液
C
.用过量饱和碳酸钠溶液洗涤后分液
?
D
.用过量氯化钠溶液洗涤后分液
【答案】C
CH3COOH+CH3OH
CH3COOCH3+H2O
浓H2SO4
四.酯
1.酯
羧酸分子羧基中的
—OH
被-OR'取代后的产物称为酯,
简写为RCOOR',结构式为
R—C—O—R'
官能团为
酯基
—C—O—
2.物理性质
低级酯密度比水小
,难溶于水,易溶于有机溶剂,具有芳香气味。
3.用途
(1)用作香料,例如
饮料、糖果、化妆品中的香料
(2)用作溶剂,例如
指甲油、胶水的溶剂
O
O
4.化学性质
1.下列说法错误的是(
)
A.乙醇和乙酸都是常用调味品的主要成分
B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的
沸点和熔点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸之间能发生酯化反应,加入过量
的乙醇充分反应后,乙酸全部反应生成酯
【答案】D
2.关于乙酸的叙述不正确的是( )
A.可与乙醇反应
B.能溶解鸡蛋壳
C.食醋中含有乙酸
D.为一种无色无味的液体
【答案】D
3.(2019·郑州高一检测)下列关于乙酸性质的叙述中,错误的是(
)
A.乙酸的酸性比碳酸强,所以它可以跟碳酸盐
溶液反应,产生CO2气体
B.乙酸具有氧化性,能跟钠反应放出H2
C.乙酸分子中含有碳氧双键,所以它能使溴水
褪色
D.当温度低于16.6
℃时,乙酸凝结成冰状晶体
【答案】C
4.1?丁醇(CH3CH2CH2CH2OH)和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描述错误的是( )
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.1?丁醇和乙酸能反应完或
者其中一种能消耗完
D.为了提高反应速率,所以要加
入浓硫酸作催化剂并加热
【答案】C
5.巴豆酸的结构简式为CH3—CH===CH—COOH。现有①氯化氢、②溴水、③纯碱溶液、④乙醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是(
)
A.只有②④⑤
B.只有①③④
C.只有①②③④
D.全部
【答案】D
本课结束
