杂化轨道修改后2.1
图片预览





文档简介
(共22张PPT)
【杂化轨道理论简介】
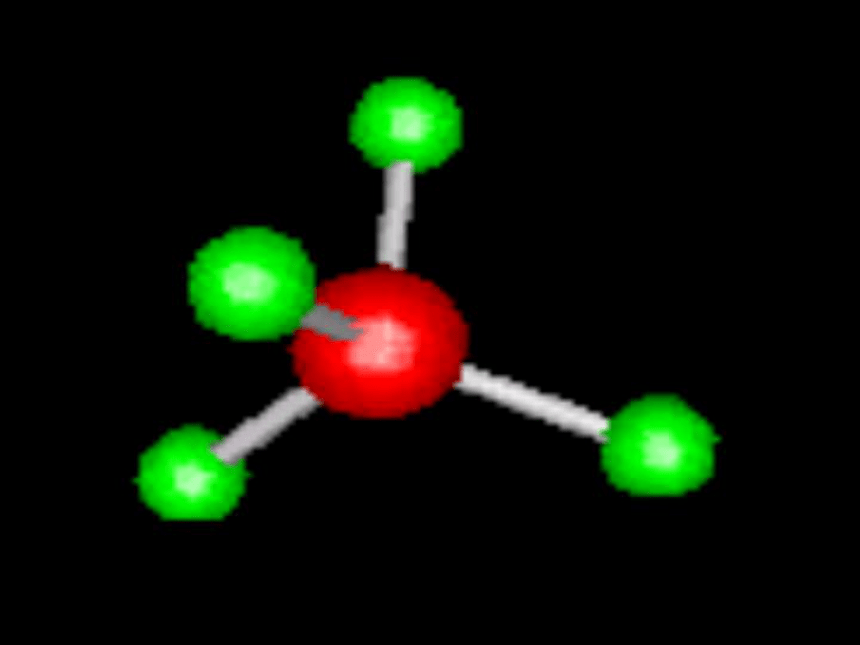
甲烷分子实测的空间构型和VSEPR模型预测的立体结构都是正四面体,则CH4中的C-H键的键长是相等的,但CH4里的中心原子碳的4个价电子层原子轨道——2s和2px,2py,2pz分别跟4个氢原子的1s原子轨道重叠形成σ键,由于碳原子的3个2p轨道是相互垂直,而2s轨道是球形的,用它们跟4个氢原子的1s原子轨道重叠,不可能得到正四面体构型的甲烷分子,因此,VSEPR模型理论无法解释甲烷为什么能形成正四面体的空间构型。
情境创设
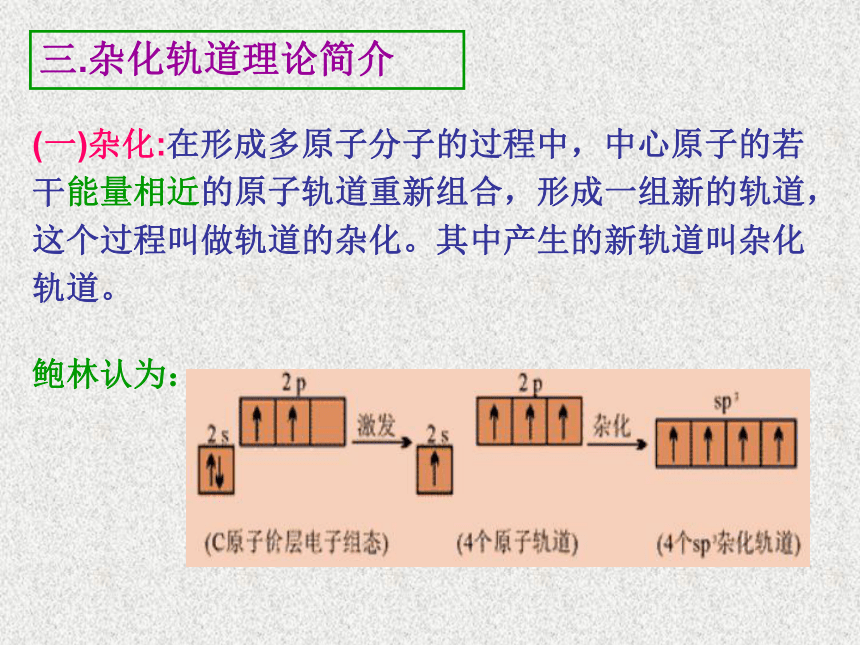
鲍林提出杂化轨道理论认为:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个能量相同的轨道,夹角为109°28′,成为sp3杂化轨道,形成4个键长和键角都相等的C-Hδ键,因此,CH4分子呈正四面体的立体结构。
三.杂化轨道理论简介
(一)杂化:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化。其中产生的新轨道叫杂化轨道。
鲍林认为:
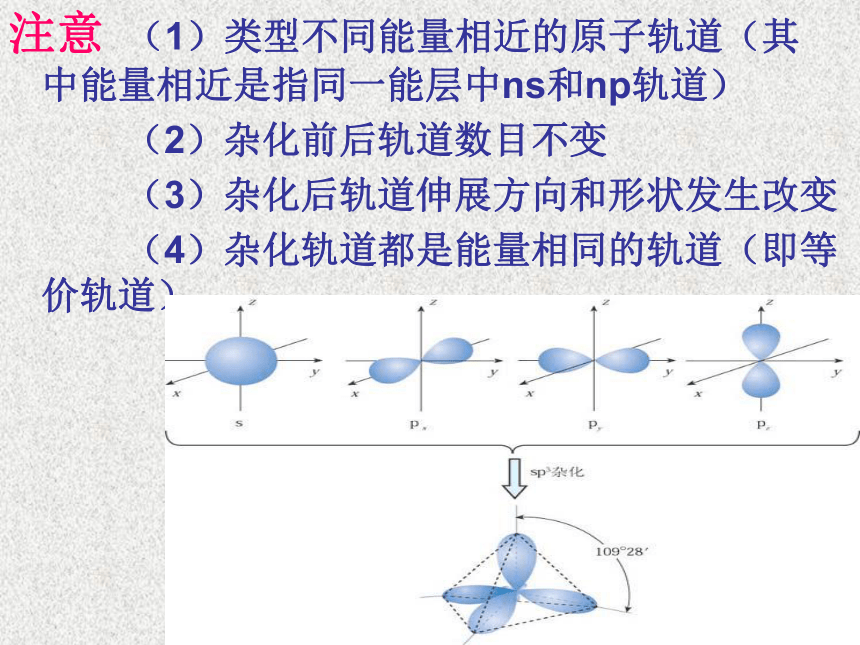
注意 (1)类型不同能量相近的原子轨道(其 中能量相近是指同一能层中ns和np轨道)
(2)杂化前后轨道数目不变
(3)杂化后轨道伸展方向和形状发生改变
(4)杂化轨道都是能量相同的轨道(即等价轨道)
(二)杂化过程:
杂化轨道理论认为:在形成分子时,通常存在激发、杂化和轨道重叠等过程。
(三)杂化轨道的类型:
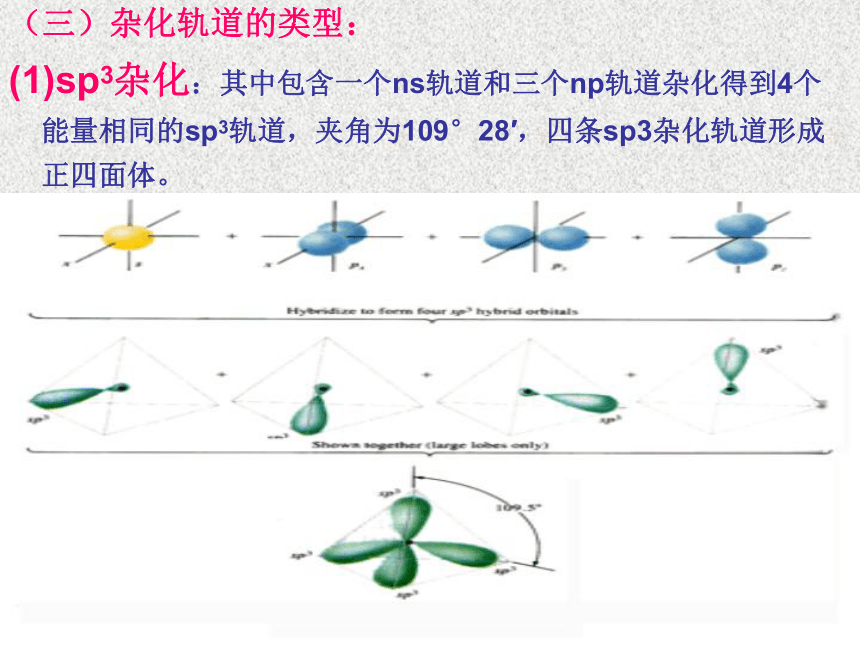
sp3杂化:其中包含一个ns轨道和三个np轨道杂化得到4个能量相同的sp3轨道,夹角为109°28′,四条sp3杂化轨道形成正四面体。
氮原子价电子的轨道排布式:
SP3杂化轨道
SP3杂化
2S 2P
N:
NH3中N以SP3杂化轨道成键
SP3杂化轨道
氧原子价电子的轨道排布式:
2S 2P
O:
SP3杂化
(2) sp2杂化:其中包含一个nS轨道和两个nP轨道杂化组合为三个能量相等的sp2杂化轨道,夹角为120°, 三条sp2杂化轨道形成平面正三角形
BF3中心原子B的SP2杂化
杂化前
杂化后
(3) sp 杂化:其中包含一个 ns 轨道和 一 个n p 轨道杂化组合成两个能量相等的 sp 杂化轨道,夹角为180°,两条sp 杂化轨道为直线形。
BeCl2分子中Be原子的SP杂化
(四)SP型的杂化方式间的对比
杂化类型 SP SP2 SP3
参与杂化的原子轨道数 1个S和1个P 1个S和2个P 1个S和3个P
杂化轨道数 2个等价的SP杂化轨道 3个等价的SP2杂化轨道 4个等价的SP3杂化轨道
轨道间的夹角 180° 120° 109°28′
空间构型 直线形 平面正三角形 正四面体形
典型事例 BeCl2,CO2 BF3,CH2O CH4,NH3,
H2O
注意:杂化轨道只用于形成 键或容纳未成键的孤电子对。
键的形成,只能由未参与杂化的P轨道重叠形成。
下面请同学们通过计算下表中典型例子的中心原子的价层电子对数,找出中心原子的价层电子对数与杂化轨道数目的关系。
(五)中心原子的价层电子对数与其杂化类型的关系
中心原子的价层电子对数=中心原子的杂化轨道数目
中心原子的价层电子对数 2 3 4
杂化轨道数 2 3 4
杂化方式 sp sp2 sp3
夹角 180° 120° 109°28′
VSEPR理想模型 直线形 平面三角形 四面体形
典型例子 CO2,BeCl2 BF3,CH2O CH4,H2O,NH3
思考与练习
请同学们结合价层电子对互斥理论判断一下分子的中心原子的杂化方式
分子或离子 中心原子价层电子对数 中心原子杂化方式 VSEPR理想模型
H3O+
BF3
NH4+
SO42-
CO2
(六)课后小结
思考与讨论
利用中心原子的价层电子对理论方便了我们判断单中心分子的杂化类型,请同学们回忆C2H4,C2H2,C6H6分子的空间构型及键角大小,并结合分子的空间构型及键角讨论:
(1)中心原子C 的杂化方式
(2)分子中双键和叁键是怎样形成的
【杂化轨道理论简介】
甲烷分子实测的空间构型和VSEPR模型预测的立体结构都是正四面体,则CH4中的C-H键的键长是相等的,但CH4里的中心原子碳的4个价电子层原子轨道——2s和2px,2py,2pz分别跟4个氢原子的1s原子轨道重叠形成σ键,由于碳原子的3个2p轨道是相互垂直,而2s轨道是球形的,用它们跟4个氢原子的1s原子轨道重叠,不可能得到正四面体构型的甲烷分子,因此,VSEPR模型理论无法解释甲烷为什么能形成正四面体的空间构型。
情境创设
鲍林提出杂化轨道理论认为:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个能量相同的轨道,夹角为109°28′,成为sp3杂化轨道,形成4个键长和键角都相等的C-Hδ键,因此,CH4分子呈正四面体的立体结构。
三.杂化轨道理论简介
(一)杂化:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化。其中产生的新轨道叫杂化轨道。
鲍林认为:
注意 (1)类型不同能量相近的原子轨道(其 中能量相近是指同一能层中ns和np轨道)
(2)杂化前后轨道数目不变
(3)杂化后轨道伸展方向和形状发生改变
(4)杂化轨道都是能量相同的轨道(即等价轨道)
(二)杂化过程:
杂化轨道理论认为:在形成分子时,通常存在激发、杂化和轨道重叠等过程。
(三)杂化轨道的类型:
sp3杂化:其中包含一个ns轨道和三个np轨道杂化得到4个能量相同的sp3轨道,夹角为109°28′,四条sp3杂化轨道形成正四面体。
氮原子价电子的轨道排布式:
SP3杂化轨道
SP3杂化
2S 2P
N:
NH3中N以SP3杂化轨道成键
SP3杂化轨道
氧原子价电子的轨道排布式:
2S 2P
O:
SP3杂化
(2) sp2杂化:其中包含一个nS轨道和两个nP轨道杂化组合为三个能量相等的sp2杂化轨道,夹角为120°, 三条sp2杂化轨道形成平面正三角形
BF3中心原子B的SP2杂化
杂化前
杂化后
(3) sp 杂化:其中包含一个 ns 轨道和 一 个n p 轨道杂化组合成两个能量相等的 sp 杂化轨道,夹角为180°,两条sp 杂化轨道为直线形。
BeCl2分子中Be原子的SP杂化
(四)SP型的杂化方式间的对比
杂化类型 SP SP2 SP3
参与杂化的原子轨道数 1个S和1个P 1个S和2个P 1个S和3个P
杂化轨道数 2个等价的SP杂化轨道 3个等价的SP2杂化轨道 4个等价的SP3杂化轨道
轨道间的夹角 180° 120° 109°28′
空间构型 直线形 平面正三角形 正四面体形
典型事例 BeCl2,CO2 BF3,CH2O CH4,NH3,
H2O
注意:杂化轨道只用于形成 键或容纳未成键的孤电子对。
键的形成,只能由未参与杂化的P轨道重叠形成。
下面请同学们通过计算下表中典型例子的中心原子的价层电子对数,找出中心原子的价层电子对数与杂化轨道数目的关系。
(五)中心原子的价层电子对数与其杂化类型的关系
中心原子的价层电子对数=中心原子的杂化轨道数目
中心原子的价层电子对数 2 3 4
杂化轨道数 2 3 4
杂化方式 sp sp2 sp3
夹角 180° 120° 109°28′
VSEPR理想模型 直线形 平面三角形 四面体形
典型例子 CO2,BeCl2 BF3,CH2O CH4,H2O,NH3
思考与练习
请同学们结合价层电子对互斥理论判断一下分子的中心原子的杂化方式
分子或离子 中心原子价层电子对数 中心原子杂化方式 VSEPR理想模型
H3O+
BF3
NH4+
SO42-
CO2
(六)课后小结
思考与讨论
利用中心原子的价层电子对理论方便了我们判断单中心分子的杂化类型,请同学们回忆C2H4,C2H2,C6H6分子的空间构型及键角大小,并结合分子的空间构型及键角讨论:
(1)中心原子C 的杂化方式
(2)分子中双键和叁键是怎样形成的
