第四节 氨、硝酸 硫酸(2)
文档属性
| 名称 | 第四节 氨、硝酸 硫酸(2) |  | |
| 格式 | rar | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-20 15:16:53 | ||
图片预览






文档简介
(共25张PPT)
第四章非金属及其化合物
第四节 氨 硝酸 硫酸
(第二课时)
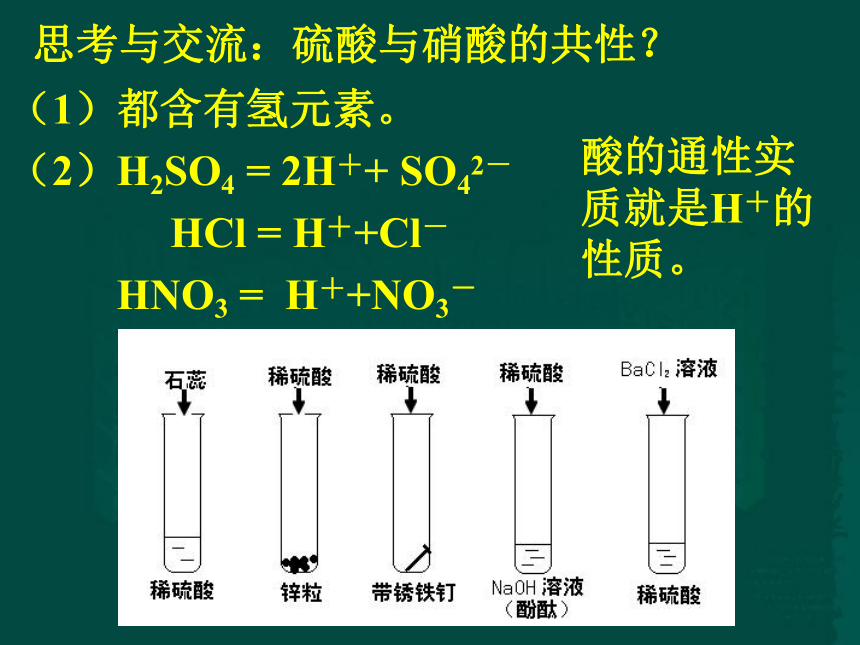
(1)都含有氢元素。
(2)H2SO4 = 2H++ SO42-
HCl = H++Cl-
HNO3 = H++NO3-
思考与交流:硫酸与硝酸的共性?
酸的通性实质就是H+的性质。
现有体积相同的浓硫酸和浓盐酸,分别放在等
质量的两个试剂瓶中,不用化学方法怎样识别?
提起试剂瓶,重者是浓硫酸;
振动试剂瓶,液体呈油状的是浓硫酸;
打开试剂瓶,瓶口不生白雾者是浓硫酸;
打开试剂瓶,无刺激性气味的是浓硫酸。
请总结浓硫酸的物理性质:
无色、无味、粘稠的油状
液体,密度大,沸点高,难挥发,与水任意比互溶。
一、硫酸和硝酸的氧化性
1、硫酸的强氧化性
现象:
固体由蓝色变为灰白色,
溶液仍为无色。
反应:
CuSO4·5H2O + H2SO4(浓)
= CuSO4 + H2SO4·5H2O
结论:
浓硫酸有吸水性
实验1
在点滴板中放入
少量胆矾,再加
入少量浓硫酸
现象:
滴有浓硫酸的滤纸炭化
变黑。
解释:
滤纸的主要成份是纤维素,由碳、氢、氧三种元素组成,浓硫酸能把滤纸中的氢、氧元素按水的比例脱去。
结论:
浓硫酸有脱水性
实验2
把少量浓硫酸
滴在纸片、火
柴梗上
比较学习
浓硫酸的吸水性和脱水性有什么区别?
吸水性是指浓硫酸直接与水分子结合。
脱水性是指浓硫酸将许多有机物中的氢、氧元素按水的比例脱去。
吸收现成的水
反应生成水
在试管中
放入一块铜片,
加热。用湿润
的品红试纸检
验放出的气体,
把反应后的溶
液倒在水中稀
释。
实验4-8
现象:
加热能反应,产生的气
体能使湿润的品红试纸褪色,
溶液稀释后呈蓝色。
反应:
Cu + 2H2SO4(浓)
= CuSO4 + SO2 + 2H2O
结论:
浓硫酸有氧化性
△
分析
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
△
0
+6
+6
+4
+2
还原剂
氧化剂
2e
注
意
⑴ 参加反应的硫酸只有一半被还原
⑵ 在与铜的反应中,浓硫酸既表现出 氧化性,又表现出酸性。
请标出电子的转移情况
把铁片放
入盛有浓硫酸
的试管中,加
热。
实 验
现象:
常温无明显变化,加热后能反应。
解释:
常温下,浓硫酸能使铁、铝等金属表面生成一层致密的氧化物保护膜,阻止内部金属继续跟硫酸起反应。此现象称 “钝化”。
氧化物能被热的浓硫酸氧化。
在烧杯中
放入少量蔗糖,
用少量水调成
糊状,注入浓
硫酸,用玻棒
搅拌。
实 验
现象:
蔗糖变黑,体积膨胀,放出大量热,放出有刺激性气味的气体。
反应:
结论:
体现出浓硫酸的吸水性、脱水性和氧化性
C12H22O11 12C + 11H2O
浓硫酸
2H2SO4 (浓) + C
= CO2 + 2H2O + 2SO2
△
总结
浓硫酸的特性
⑴ 吸水性
⑶ 强氧化性
① 加热时浓硫酸能与大多数金属反应,但不生成氢气。
常温下使铁铝钝化
⑵ 脱水性
Cu + 2H2SO4 (浓) = CuSO4 + SO2 + 2H2O
△
② 与某些非金属反应
C + 2H2SO4 (浓) = CO2 + SO2 + 2H2O
△
③ 与硫化氢、碘化氢等还原剂反应
H2S + H2SO4 (浓) = S + SO2 + 2H2O
分析
稀硫酸的氧化性和浓硫酸
的氧化性有何不同?
稀硫酸的氧化性是由电离出的H+引起的,
氢离子只能氧化金属活动顺序表中氢前的金属,
所以稀硫酸具有弱的氧化性。
浓硫酸的氧化性是由硫酸分子中+6价硫元素引起的,它可以氧化金属活动顺序表氢后的金属;
所以浓硫酸具有强的氧化性。
硫酸用途
制过磷酸钙
电镀前去锈
制硫酸铵
制硫酸盐
制挥发性酸
精炼石油,制炸
药、农药、染料
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
浓硫酸具有如下性质:A、酸性 B、强氧化性 C、难挥发性 D、吸水性 E、脱水性,下列实验或事实表现了浓硫酸的什么性质,将适当的序号填入括号里。
(1)浓硫酸可做气体干燥剂 ( )
(2)浓硫酸不能干燥氨气 ( )
(3)浓硫酸可用来制取氯化氢气体 ( )
(4)铁片投入浓硫酸中不溶解 ( )
(5)胆矾遇浓硫酸变白色 ( )
(6)清洗浓硫酸罐见明火易爆炸 ( )
大多数金属(Pt、Au除外)都能被硝酸氧化
不活泼金属与硝酸反应,硝酸被还原为NO2或NO,活泼金属与硝酸反应,硝酸的还原产物很复杂。
2、硝酸的强氧化性(随浓度增大而增强)
常识:
王水?
VHNO3:VHCl = 1:3
组成的混合物
##
第四章非金属及其化合物
第四节 氨 硝酸 硫酸
(第二课时)
(1)都含有氢元素。
(2)H2SO4 = 2H++ SO42-
HCl = H++Cl-
HNO3 = H++NO3-
思考与交流:硫酸与硝酸的共性?
酸的通性实质就是H+的性质。
现有体积相同的浓硫酸和浓盐酸,分别放在等
质量的两个试剂瓶中,不用化学方法怎样识别?
提起试剂瓶,重者是浓硫酸;
振动试剂瓶,液体呈油状的是浓硫酸;
打开试剂瓶,瓶口不生白雾者是浓硫酸;
打开试剂瓶,无刺激性气味的是浓硫酸。
请总结浓硫酸的物理性质:
无色、无味、粘稠的油状
液体,密度大,沸点高,难挥发,与水任意比互溶。
一、硫酸和硝酸的氧化性
1、硫酸的强氧化性
现象:
固体由蓝色变为灰白色,
溶液仍为无色。
反应:
CuSO4·5H2O + H2SO4(浓)
= CuSO4 + H2SO4·5H2O
结论:
浓硫酸有吸水性
实验1
在点滴板中放入
少量胆矾,再加
入少量浓硫酸
现象:
滴有浓硫酸的滤纸炭化
变黑。
解释:
滤纸的主要成份是纤维素,由碳、氢、氧三种元素组成,浓硫酸能把滤纸中的氢、氧元素按水的比例脱去。
结论:
浓硫酸有脱水性
实验2
把少量浓硫酸
滴在纸片、火
柴梗上
比较学习
浓硫酸的吸水性和脱水性有什么区别?
吸水性是指浓硫酸直接与水分子结合。
脱水性是指浓硫酸将许多有机物中的氢、氧元素按水的比例脱去。
吸收现成的水
反应生成水
在试管中
放入一块铜片,
加热。用湿润
的品红试纸检
验放出的气体,
把反应后的溶
液倒在水中稀
释。
实验4-8
现象:
加热能反应,产生的气
体能使湿润的品红试纸褪色,
溶液稀释后呈蓝色。
反应:
Cu + 2H2SO4(浓)
= CuSO4 + SO2 + 2H2O
结论:
浓硫酸有氧化性
△
分析
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
△
0
+6
+6
+4
+2
还原剂
氧化剂
2e
注
意
⑴ 参加反应的硫酸只有一半被还原
⑵ 在与铜的反应中,浓硫酸既表现出 氧化性,又表现出酸性。
请标出电子的转移情况
把铁片放
入盛有浓硫酸
的试管中,加
热。
实 验
现象:
常温无明显变化,加热后能反应。
解释:
常温下,浓硫酸能使铁、铝等金属表面生成一层致密的氧化物保护膜,阻止内部金属继续跟硫酸起反应。此现象称 “钝化”。
氧化物能被热的浓硫酸氧化。
在烧杯中
放入少量蔗糖,
用少量水调成
糊状,注入浓
硫酸,用玻棒
搅拌。
实 验
现象:
蔗糖变黑,体积膨胀,放出大量热,放出有刺激性气味的气体。
反应:
结论:
体现出浓硫酸的吸水性、脱水性和氧化性
C12H22O11 12C + 11H2O
浓硫酸
2H2SO4 (浓) + C
= CO2 + 2H2O + 2SO2
△
总结
浓硫酸的特性
⑴ 吸水性
⑶ 强氧化性
① 加热时浓硫酸能与大多数金属反应,但不生成氢气。
常温下使铁铝钝化
⑵ 脱水性
Cu + 2H2SO4 (浓) = CuSO4 + SO2 + 2H2O
△
② 与某些非金属反应
C + 2H2SO4 (浓) = CO2 + SO2 + 2H2O
△
③ 与硫化氢、碘化氢等还原剂反应
H2S + H2SO4 (浓) = S + SO2 + 2H2O
分析
稀硫酸的氧化性和浓硫酸
的氧化性有何不同?
稀硫酸的氧化性是由电离出的H+引起的,
氢离子只能氧化金属活动顺序表中氢前的金属,
所以稀硫酸具有弱的氧化性。
浓硫酸的氧化性是由硫酸分子中+6价硫元素引起的,它可以氧化金属活动顺序表氢后的金属;
所以浓硫酸具有强的氧化性。
硫酸用途
制过磷酸钙
电镀前去锈
制硫酸铵
制硫酸盐
制挥发性酸
精炼石油,制炸
药、农药、染料
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
浓硫酸具有如下性质:A、酸性 B、强氧化性 C、难挥发性 D、吸水性 E、脱水性,下列实验或事实表现了浓硫酸的什么性质,将适当的序号填入括号里。
(1)浓硫酸可做气体干燥剂 ( )
(2)浓硫酸不能干燥氨气 ( )
(3)浓硫酸可用来制取氯化氢气体 ( )
(4)铁片投入浓硫酸中不溶解 ( )
(5)胆矾遇浓硫酸变白色 ( )
(6)清洗浓硫酸罐见明火易爆炸 ( )
大多数金属(Pt、Au除外)都能被硝酸氧化
不活泼金属与硝酸反应,硝酸被还原为NO2或NO,活泼金属与硝酸反应,硝酸的还原产物很复杂。
2、硝酸的强氧化性(随浓度增大而增强)
常识:
王水?
VHNO3:VHCl = 1:3
组成的混合物
##
